自身免疫性肝炎大鼠血清IL-38和β2GPI水平及其与肝组织病变的关系*
史雪丽,张万里,毛 俊,颜悦蓉
自身免疫性肝炎(autoimmune hepatitis,AIH)是由异常自身免疫反应介导的慢性肝实质炎症性病变性疾病,具有血清转氨酶和免疫球蛋白G升高、肝组织学炎症和血循环有多种自身抗体存在的特点[1]。AIH临床表现不一,诊断需要排除其他肝脏疾病。对AIH的及时诊断和治疗可防止肝硬化和终末期肝病的发生[2]。AIH的确切病因尚不清楚,但越来越多的研究证据表明,在特定的自身免疫生态系统中,遗传易感性、血清趋化因子、分子模型学说和效应与调节免疫之间的不平衡是AIH发展的关键性病理学因素[3]。白介素(interleukin,IL)-1家族成员是固有免疫的重要组成部分,IL-38是IL-1家族成员之一,位于2号染色体q12-14位置,在包括扁桃体、胎盘、心脏和大脑在内的多种组织中均有表达,与自身免疫性疾病等多种疾病密切相关[4]。研究[5]显示,系统性红斑狼疮患者血浆IL-38水平显著高于健康人,在活动期患者体内水平更高,应用IL-38干预系统性红斑狼疮小鼠可明显下调炎症细胞因子表达,提示IL-38水平与系统性红斑狼疮有关,并可能通过抑制促炎细胞因子的生成而调节系统性红斑狼疮的发生。β2糖蛋白I(β2-glycoprotein I,β2GPI)是一个大小为50 kDa的磷脂结合蛋白,位于17号染色体q23-24位置,具有两种不同的构象,主要在肝细胞中合成,血浆β2GPI水平可被检测[6]。既往研究发现,β2GPI是自身免疫性疾病抗磷脂抗体综合征中最重要的自身抗原[7]。此外,在抗磷脂抗体综合征患者和系统性红斑狼疮患者外周血均可检测到氧化低密度脂蛋白(oxLDL)-β2GPI复合体[8]。本研究检测了AIH大鼠血清IL-38和β2GPI水平,并分析了其与肝组织病变的关系,现报道如下。
1 材料与方法
1.1 动物、试剂与仪器 清洁级、雄性Wistar大鼠40只,12周龄,体质量210~250 g,购自北京维通利华实验动物技术有限公司【许可证号SCXK(京):2020-0005】。饲养条件:温度24±2℃,相对湿度50%~60%,12 h光照和12 h暗适应处理,适应性饲养2 w。弗氏完全佐剂(北京Solarbio科技有限公司);水合氯醛(天津一方科技有限公司);检测血清IL-38的ELISA试剂盒(上海仁捷生物科技有限公司);检测血清β2GPI 的ELISA试剂盒(美国Ebioscience公司);低温冰箱(青岛海尔公司)。
1.2 AIH大鼠模型的建立 将弗氏完全佐剂2 mg与肝细胞特异性脂蛋白1:1混匀,取0.2 ml腹腔注射,1次/10 d,连续注射2次;取肝细胞特异性脂蛋白1 mg腹腔注射,1次/w,注射3次,再改为1次/m,注射3次。于末次注射后的第3 d,取肝细胞特异性脂蛋白2 mg腹腔注射,加强免疫1次。3 d后,随机取3只大鼠处死,行肝组织病理学检查,显示大鼠肝细胞变性坏死明显,出现中度碎屑样坏死和桥接坏死,小叶内有纤维间隔形成,表明AIH大鼠模型制作成功。在建模成功后,使用水合氯醛麻醉大鼠,开腹并于腹主动脉取血,立即收集于抗凝管中,静置,离心,置于-20℃冰箱。同时,取大鼠肝组织,行病理学检查[9],肝组织表现为肝细胞变性,汇管区炎症细胞浸润、小叶结构完整、伴或者不伴局限性碎屑样坏死、血管点状或者灶状坏死或者出现凋亡小体,为轻度AIH;肝细胞变性,汇管区明显血管壁炎症细胞浸润、小叶炎症明显、存在中度碎屑样坏死、出现融合性坏死或者存在少数桥接坏死,形成纤维间隔,为中度AIH;汇管区血管壁弥漫性炎症细胞浸润、小叶结构紊乱、伴随有严重的碎屑样坏死、存在多数的桥接坏死,形成大量的纤维间隔,为重度AIH。
1.3 肝内血管病变分级法[10]分为1级、2级和3级,其中1级:血管壁少量炎性细胞浸润,仅有血管点状破坏,纤维化区血管≤5个,汇管区或炎症区1~3个血管被阻塞;2级:血管壁炎性细胞浸润介于1~3级,血管点状破坏介于1~3级,汇管增生介于1~3级,血管阻塞介于1~3级;3级:血管壁弥漫性炎性细胞浸润,血管壁大部分被破坏,汇管区和纤维化区血管≥20个,汇管区或炎症区或纤维化区血管阻塞>5个。
1.4 大鼠血清IL-38和β2GPI水平检测 采用ELISA法。
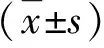
2 结果
2.1 不同肝组织病变的AIH大鼠血清IL-38和β2GPI水平比较 重度AIH大鼠血清IL-38水平显著低于(P<0.05),而血清β2GPI水平显著高于轻度或中度AIH大鼠(P<0.05),中度AIH大鼠血清IL-38水平显著低于(P<0.05),而血清β2GPI水平显著高于轻度AIH大鼠(P<0.05,表1)。

表1 不同肝组织病变的AIH大鼠血清IL-38和β2GPI水平比较
2.2 不同肝组织血管病变的AIH大鼠血清IL-38和β2GPI水平比较 随着肝组织血管病变分级的增加,AIH大鼠血清IL-38水平逐渐降低,而β2GPI水平逐渐升高。3级肝组织血管病变的AIH大鼠血清IL-38水平显著低于,而血清β2GPI水平显著高于1级或2级AIH大鼠(P<0.05),2级肝组织血管病变的AIH大鼠血清IL-38水平显著低于(P<0.05),而血清β2GPI水平显著高于1级AIH大鼠(P<0.05,表2)。

表2 不同肝组织血管病变的AIH大鼠血清IL-38和β2GPI水平比较
3 讨论
AIH是一种慢性炎症性肝病,主要由自身免疫反应攻击所致,具有以淋巴细胞和浆细胞浸润为主的炎症性肝组织学特征,病情严重可进一步导致肝纤维化,乃至肝硬化以及肝细胞癌,并最终导致肝功能衰竭[11,12]。尽管AIH致癌风险低于病毒性肝炎,但因AIH导致的肝硬化患者肝癌发生率为3.3%~5.1%,在一定程度上可能与疾病长期进展有关[13]。因此,尽早对AIH进行诊断,及时予以治疗,对于促进患者预后的良好转归至关重要。AIH的病因尚不明确,但遗传和免疫调节失衡、自身抗体以及一些诱导因子所致的自身免疫反应不耐受均可能诱导疾病的发生。IL-38和β2GPI与系统性红斑狼疮等自身免疫性炎症性疾病有关。因此,本研究通过建立AIH大鼠模型,检测了AIH大鼠血清IL-38和β2GPI水平,并分析其与肝组织病变的关系。
IL-38是一种新发现的IL-1家族细胞因子,可在多种组织中表达,并由外周血单个核细胞、成纤维细胞样滑膜细胞、B细胞、角质形成细胞和各种免疫细胞等多种细胞分泌[14]。报道[15]称,IL-38通过与多种受体,如IL-36受体(IL-36 receptor,IL-36R)、IL-1受体辅助性蛋白1(IL-1 receptor accessory protein-like 1,IL-1RAPL 1)和IL-1受体1(IL-1 receptor 1,IL-1R1)结合而发挥抗炎作用,从而阻断与其他促炎细胞因子的结合,并抑制下游信号通路,从而调节T细胞、外周血单个核细胞、巨噬细胞和树突状细胞的活化和功能发挥,最终抑制辅助性T细胞(T helper cells,Th)17的成熟,促进调节性T细胞(regulatory T cells,Treg)的增殖。最近的研究[16]表明,IL-38在类风湿性关节炎、银屑病、系统性红斑狼疮、原发性干燥综合征、炎症性肠病、化脓性汗腺炎、强直性脊柱炎、青光眼等炎症性自身免疫性疾病患者异常表达,提示IL-38可能是预测炎症性自身免疫性疾病发展和炎症性自身免疫性疾病治疗转归的潜在的生物标志物。β2GPI为主要在肝组织合成的磷脂结合蛋白,在体内可与磷脂结合,进而参与凝血功能发挥和凋亡机制的进行[17]。研究[18]发现,β2GPI与膜Toll样受体直接发生相互作用,β2GPI及其抗体复合物通过Toll样受体诱导细胞内信号转导,进而导致内皮细胞、单核细胞的活化和促炎细胞因子的表达。β2GPI是抗磷脂抗体综合征患者体内最重要的自身抗原[19]。另外,β2GPI还可能与乙型肝炎病毒感染、肝硬化和肝细胞癌的发生有关[20,21]。
本研究结果显示,不同严重程度的肝组织病变AIH大鼠血清IL-38和β2GPI水平存在显著性差异。重度AIH大鼠血清IL-38水平显著低于轻度或中度AIH大鼠,而血清β2GPI水平显著高于轻度或中度AIH大鼠,且中度AIH大鼠血清IL-38水平显著低于轻度AIH大鼠,血清β2GPI水平显著高于轻度AIH大鼠,表明AIH大鼠肝组织病变严重程度与其血清IL-38和β2GPI水平有关。肝组织病变越严重,血清IL-38水平越低,而β2GPI水平越高。此外,本研究结果还显示,严重血管病变的AIH大鼠血清IL-38水平显著低于轻度AIH大鼠,而血清β2GPI水平显著高于轻度血管病变的AIH大鼠;肝组织血管病变3级的AIH大鼠血清IL-38水平显著低于1级或2级AIH大鼠,而血清β2GPI水平显著高于1级或2级AIH大鼠,肝组织血管病变2级AIH大鼠血清IL-38水平显著低于1级AIH大鼠,而β2GPI水平也显著高于1级AIH大鼠,表明AIH大鼠血清IL-38水平随着肝组织炎症分级和血管病变分级的加重而降低,而血清β2GPI水平随着肝组织炎症分级和血管病变分级的加重而升高。故我们认为,AIH大鼠血清IL-38和β2GPI水平升高与其肝组织病变严重程度密切相关,血清IL-38和β2GPI水平可能是反映AIH肝损伤的良好指标。尽管我们还没有证实血清IL-38和β2GPI水平变化是否为AIH肝损伤的诱因,但两者水平的变化能够在一定程度上预示肝组织病变的进展。
综上所述,随着肝组织病变的加重,AIH大鼠血清IL-38水平随之降低,而血清β2GPI水平随之升高,为进一步揭示AIH的发生和发展机制奠定了理论基础。监测血清IL-38和β2GPI水平可能有助于对AIH病情进行评估,进而为及时采取干预方案提供科学的指导。本研究未检测AIH动物肝组织两种细胞因子表达及其基因水平变化情况,后续研究需对这些问题予以阐明,将为AIH发病机制研究提供更多的视角,从而为制定干预措施提供方向性的指导。

