大鼠不同时期高脂饮食对子代糖脂代谢的影响及机制研究
魏铭 詹迪 李柱锡 汪欢玉 邢影 罗小平
(华中科技大学同济医学院附属同济医院儿科,湖北武汉430030)
“健康与疾病发育起源”学说认为:宫内不良的营养环境可扰乱发育早期细胞增殖分化过程并对胎儿程序化产生永久的影响,导致成年期代谢性疾病的发生[1]。流行病学和临床研究表明,围生期环境如母亲营养、激素水平、胎盘功能等可对胎儿的组织、器官发育产生永久性损害,孕期营养过剩可增加子代肥胖和肥胖相关疾病的风险[2-3]。
随着经济社会的发展,肥胖已经成为全球公共卫生危机。在世界范围内,中国肥胖人口数量最多,成人肥胖和超重率为42%,青少年肥胖和超重率为16%[4]。育龄妇女的肥胖率随着肥胖人口的增多而逐年升高,肥胖导致的妊娠并发症如妊娠糖尿病、先兆子痫,以及分娩、产后并发症的风险亦随之增加[5-6]。妊娠期肥胖在危害孕母健康的同时,还会影响子代的肥胖易感性、胰岛素敏感性等,增加子代成年后发生代谢性疾病的风险[7-8]。
研究表明,在妊娠早期、妊娠晚期等不同的发育窗口,母体肥胖对子代肥胖、代谢等有独立的编程效应[9-10]。为了明确孕前、孕后高脂饮食干预对子代糖脂代谢的影响差异,本研究通过在孕前和/或孕期哺乳期给予高脂饮食构建妊娠期肥胖动物模型,观察子代糖脂代谢的差异情况。
1 材料与方法
1.1 实验动物及试剂
SPF级8周龄Sprague-Dawley(SD)大鼠,雌性40只,雄性20只,购于湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2019-0004。饲养于华中科技大学同济医学院附属同济医院动物实验中心SPF动物房内,环境温度20~26℃,湿度40%~70%,12 h/12 h昼夜光照,自由饮水,按实验分组给予相应饮食。
45%高脂饲料(江苏省协同医药生物工程有限责任公司);拜安康血糖仪、血糖试纸(安晟信糖尿病保健美国股份有限公司);大鼠胰岛素(insulin,INS)ELISA试剂盒(北京索莱宝科技有限公司);三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)含量测定试剂盒(南京建成生物工程研究所);苏木精染液、伊红染液、油红O染液(武汉赛维尔生物科技有限公司);RNA提取试剂盒、逆转录试剂盒、PCR SYBR Green试剂、β-actin抗体、二抗(上海翌圣生物科技股份有限公司);4%多聚甲醛、蛋白酶抑制剂、RIPA裂解液、上样缓冲液、ECL曝光液(武汉博士德生物工程有限公司);胰岛素受体(insulin receptor,IR)、胰岛素受体底物(insulin receptor substrate,IRS)、磷酸化蛋白激酶B(p-AKT)、胆固醇调节元件结合蛋白1c(sterol-regulatory element binding protein 1c,SREBP1c)抗体(武汉爱博泰克生物科技有限公司);丝氨酸磷酸化IRS(p-IRS)抗体(美国Thermo Fisher公司);蛋白激酶B(AKT)、过氧化物酶体增殖物激活受体α(peroxisome proliferatoractivated receptor alpha,PPARα)抗 体(英 国Abcam公司);脂肪酸合酶(fatty acid synthase,FASN)抗体(美国CST公司)。
1.2 实验分组及妊娠期肥胖动物模型的建立
本研究通过对母鼠的饮食干预构建妊娠期肥胖动物模型[11]。8周龄SD大鼠适应性喂养1周后,将雌性SD大鼠随机分为两组(n=20),分别给予正常饮食、高脂饮食6周。雄性SD大鼠保持正常饮食。6周后,按雌雄2∶1合笼,次晨行阴道涂片,显微镜观察到精子视为怀孕。每组剔除2只不孕、假孕的雌性大鼠后,将孕前正常饮食大鼠随机分为CC组(孕前、孕期哺乳期均正常饮食)和CH组(孕前正常饮食,孕期哺乳期高脂饮食)(n=9);将孕前高脂饮食大鼠随机分为HC组(孕前高脂饮食,孕期哺乳期正常饮食)和HH组(孕前、孕期哺乳期均高脂饮食)(n=9)。CH组在孕期哺乳期更换为高脂饮食,HC组在孕期哺乳期更换为正常饮食,CC组和HH组在孕期哺乳期继续延续孕前饮食。母鼠自然分娩后,每窝随机保留4只雄性仔鼠,进行均一化处理,避免哺乳条件、性别等的不同造成的差异。仔鼠生后3周断奶,断奶后全部采取正常饮食。记录母鼠孕前、孕期体重及仔鼠体重。
1.3 检测空腹血糖和INS水平
每组各取9只幼年期(3周)、成年期(12周)雄性仔鼠,禁食12 h,尾尖取血,血糖仪检测空腹血糖(glucose,GLU)水平;然后腹腔内注射10%水合氯醛麻醉,暴露心脏后取血,分离血清,按照说明书要求,ELISA试剂盒检测空腹INS水平。胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR)=[空 腹GLU(mmol/L)×空腹INS(μU/mL)]/22.5。
1.4 糖耐量试验和胰岛素耐量试验
每组取9只仔鼠行糖耐量试验(glucose tolerance test,GTT):3周、12周仔鼠禁食过夜,腹腔注射2 g/kg葡萄糖。尾尖取血,血糖仪检测0、15、30、60、90、120 min血糖值。计算曲线下面积(area under the curve,AUC)。
每组取9只仔鼠行胰岛素耐量试验(insulin tolerance test,ITT):3周、12周仔鼠禁食4 h,腹腔注射0.8 U/kg胰岛素,尾尖取血,血糖仪检测0、15、30、60、90、120 min血糖值。计算AUC。
1.5 检测肝脏TG和TC水平
每组取9只仔鼠,将采集的肝脏组织样本研磨后提取上清用于检测。根据说明书操作,酶标仪测定各孔光密度值,计算各组仔鼠肝脏的TG、TC水平。
1.6 肝脏苏木精-伊红染色和油红O染色
苏木精-伊红染色:新鲜的肝脏组织在4%多聚甲醛中固定24 h,石蜡包埋后切片。石蜡切片脱蜡水化,苏木精-伊红染色,中性树胶封片,光学显微镜下观察。
油红O染色:肝脏冰冻切片后干燥复温10 min,60%异丙醇漂洗,油红O染色,中性树胶封片,光学显微镜下观察。
1.7 RT-PCR检测肝脏糖脂代谢关键基因mRNA水平
每组取9只仔鼠,利用RNA提取试剂盒提取肝脏组织RNA,分光光度计检测RNA浓度及纯度。根据逆转录试剂盒说明,冰上配制逆转录反应体系。逆转录仪将RNA逆转录为cDNA后,冰上配制PCR反应体系(10 μL):PCR SYBR Green 5 μL,上下游引物各0.2 μL,cDNA 1 μL,ddH2O 3.6 μL。PCR反应条件:95℃预变性2 min;95℃变性10 s,60℃退火/延伸30 s,40个循环。根据得到的CT值,利用2-ΔΔCT计算分析,得到相对定量的结果。引物序列见表1。

表1 RT-PCR引物序列
1.8 Western blot检测肝脏糖脂代谢关键蛋白水平
每组取3只仔鼠肝脏组织,利用含蛋白酶抑制剂的RIPA裂解液裂解组织并离心取上清,加入上样缓冲液并沸水浴加热使蛋白变性。取等体积蛋白加样,电泳、转膜。PVDF膜封闭后加入一抗IR、p-IRS、IRS、p-AKT、FASN、SREBP1c(均1∶1 000稀释),AKT、PPARα(均1∶2 000稀释),β-actin(1∶5 000稀释),4℃过夜,TBST洗膜3次,加入二抗(1∶5 000稀释),室温孵育1 h,TBST洗膜3次。ECL化学发光试剂浸泡2 min,凝胶成像仪曝光成像,以β-actin为内参,计算目的蛋白的相对表达量。
1.9 统计学分析
采用SPSS 19.0统计软件对数据进行统计学分析,计量资料以均数±标准差(xˉ±s)表示。重复测量数据比较采用重复测量方差分析;多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同饮食组母鼠孕前体重及孕期增重变化情况
两组SD母鼠孕前体重均随时间推移逐渐增加(P<0.001);孕前各时间点高脂饮食组母鼠体重高于正常饮食组,且孕前3周开始,高脂饮食组与正常饮食组母鼠体重差距逐渐增大(P<0.001);时间因素与分组因素存在交互作用(P<0.001)。见表2。

表2 不同饮食干预组母鼠孕前6周内体重变化比较(xˉ±s,g)
4组SD母鼠孕期体重均随时间推移逐渐增加(P<0.001);SD母鼠怀孕后3周,HC组、CH组、HH组母鼠孕期增重均较CC组有明显增加,且HH组母鼠孕期增重最显著(P<0.001)。时间因素与分组因素存在交互作用(P=0.01)。见表3。

表3 各组母鼠孕期3周内体重变化比较(xˉ±s,g)
高脂饮食大鼠孕前体重增加和孕期增重过多,与正常饮食大鼠比较差异有统计学意义,提示孕前和/或孕期高脂饲料喂养均可成功构建妊娠期肥胖动物模型。
2.2 生后3周仔鼠体重及糖脂代谢情况
仔鼠生后3周时,HC组、CH组、HH组仔鼠体重均较CC组显著增加,HH组仔鼠体重较HC组、CH组显著增加(P<0.05),见表4。
糖代谢方面,HH组空腹GLU水平较CC组、HC组显著增加,空腹INS水平较CC组显著增加,HOMA-IR、GTT-AUC、ITT-AUC较其他3组均显著增加(P<0.05),即HH组胰岛素抵抗增加,糖耐量、胰岛素耐量均降低(表4)。RT-PCR结果提示,HH组糖代谢通路关键基因IR、IRS的mRNA水平较CC组显著降低(P<0.05),AKT的mRNA水平在4组中比较差异无统计学意义(P>0.05)(表5)。Western blot结果提示,HH组IR、IRS蛋白表达水平较其他3组显著降低,p-IRS蛋白表达水平较其他3组显著升高(P<0.05);CC组IR蛋白表达水平较HC组、CH组显著升高,CH组IR蛋白表达水平较HC组显著降低(P<0.05)。p-AKT、AKT蛋白表达水平在4组间比较差异无统计学意义(P>0.05)。见图1和表6。
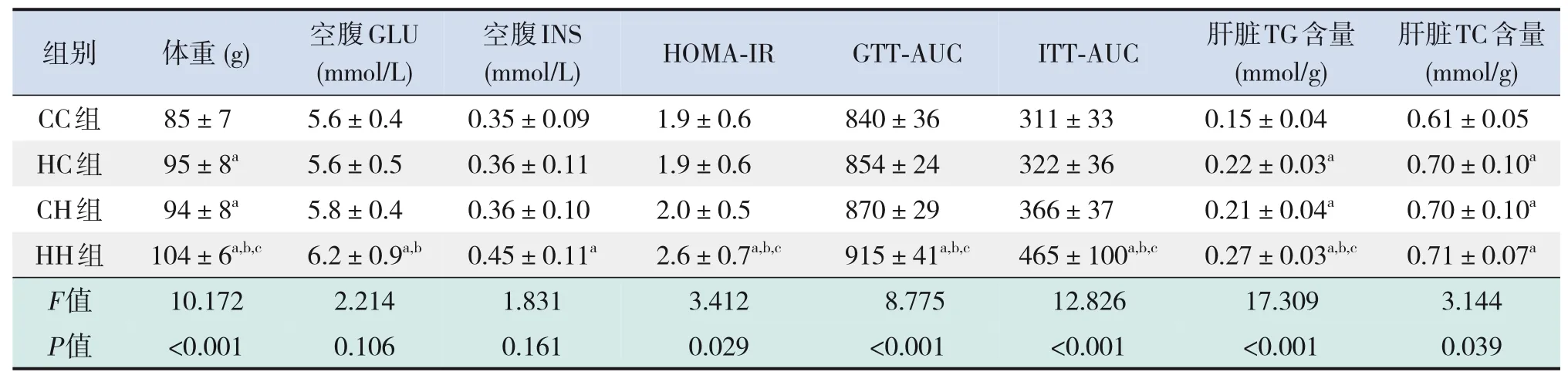
表4 各组生后3周仔鼠体重及糖脂代谢指标水平比较(n=9,xˉ±s)
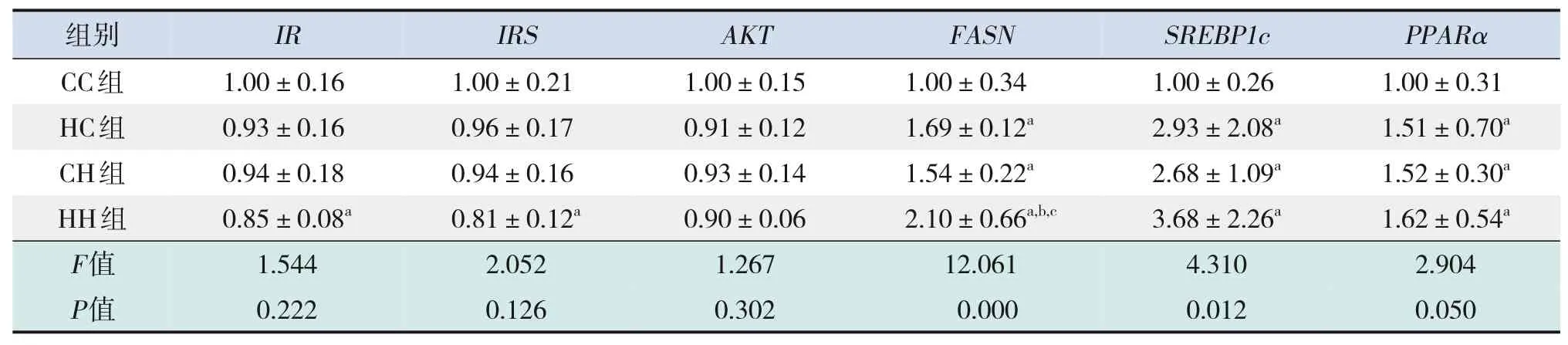
表5 各组生后3周仔鼠糖脂代谢相关基因的mRNA水平比较(n=9,xˉ±s)
脂代谢方面,HC组、CH组、HH组肝脏TG、TC水平均较CC组显著增加,HH组肝脏TG水平较HC组、CH组显著升高(P<0.05)(表4)。肝脏苏木精-伊红染色及油红O染色结果提示,HH组肝脏空泡形成及脂质沉积最明显,其次为HC组、CH组(图2)。HC组、CH组、HH组肝脏脂质代谢关键基因FASN、SREBP1c、PPARα的mRNA水平均较CC组显著增加,HH组FASN的mRNA水平较HC组、CH组显著升高(P<0.05)(表5)。HC组、CH组、HH组FASN、SREBP1c、PPARα蛋白表达水平均较CC组显著升高(P<0.05);HH组FASN蛋白表达水平较HC组、CH组显著升高,CH组FASN蛋白表达水平较HC组显著升高(P<0.05)。见图1和表6。
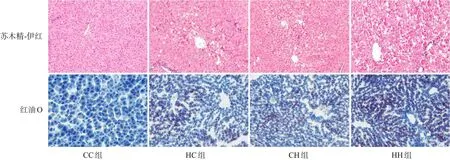
图2 各组生后3周仔鼠肝脏病理改变(×200) 肝脏苏木精-伊红染色提示HH组肝细胞空泡增多,脂肪变性最明显,其次为HC组、CH组;油红O染色提示HH组肝脏脂质沉积最严重(脂滴被染为红色),其次为HC组、CH组。
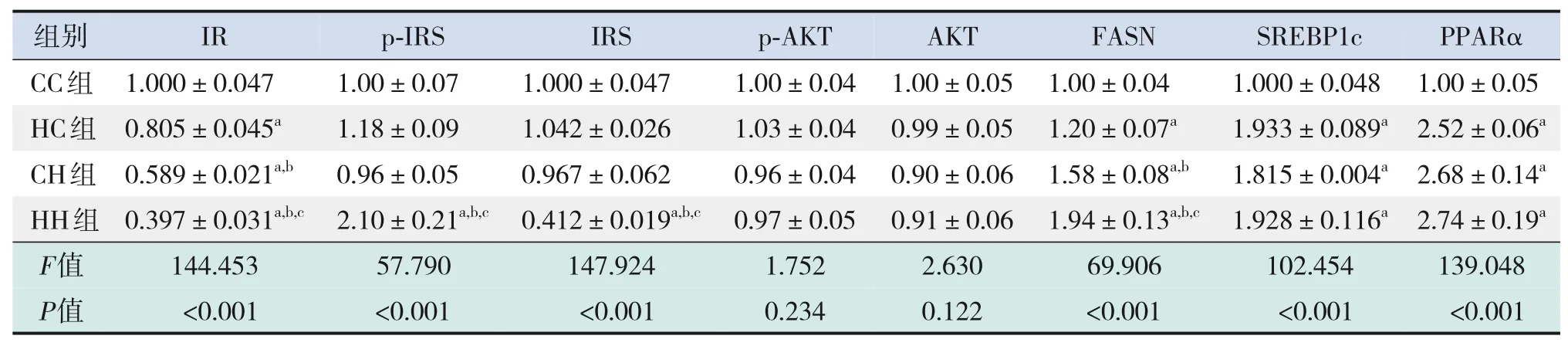
表6 各组生后3周仔鼠肝脏糖脂代谢相关蛋白表达水平比较(n=3,xˉ±s)
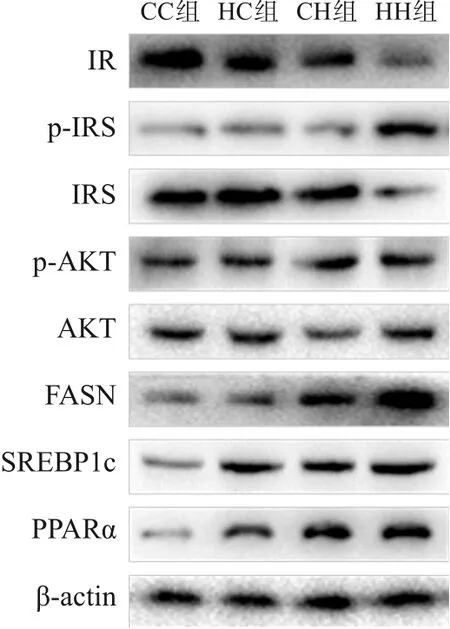
图1 Western blot检测各组生后3周仔鼠肝脏糖脂代谢相关蛋白表达电泳图
2.3 生后12周仔鼠体重及糖脂代谢情况
仔鼠生后12周时,HC组、CH组、HH组仔鼠体重均较CC组显著增加(P<0.05),见表7。
糖代谢方面,HC组、CH组、HH组空腹GLU及INS水平、HOMA-IR、GTT-AUC、ITT-AUC均较CC组显著增加(P<0.05);HH组空腹INS水平、HOMA-IR较HC组、CH组显著增加,GTT-AUC较HC组显著增加(P<0.05)(表7)。RT-PCR结果提示,HC组、CH组、HH组糖代谢通路关键基因IR、IRS、AKT的mRNA水平较CC组显著降低(P<0.05);HH组IRS的mRNA水平较HC组显著降低,AKT的mRNA水平较HC组、CH组显著降低(P<0.05)(表8)。Western blot结果提示,HC组、CH组、HH组IR、IRS、p-AKT蛋白表达水平均较CC组显著降低,p-IRS蛋白表达水平较CC组显著升高(P<0.05);AKT蛋白表达水平在4组中比较差异无统计学意义(P>0.05)。见图3和表9。
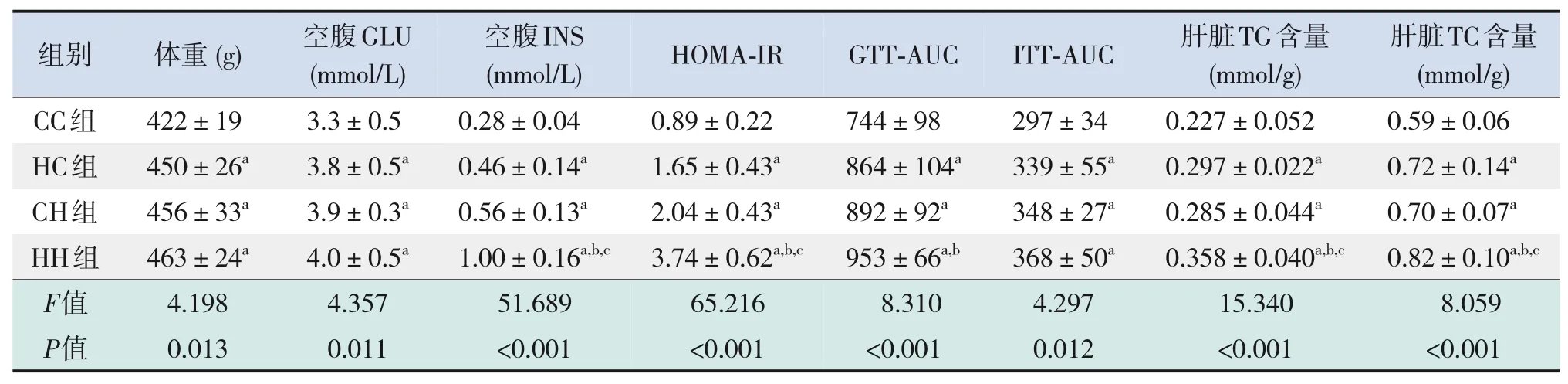
表7 各组生后12周仔鼠体重及糖脂代谢指标水平比较(n=9,xˉ±s)
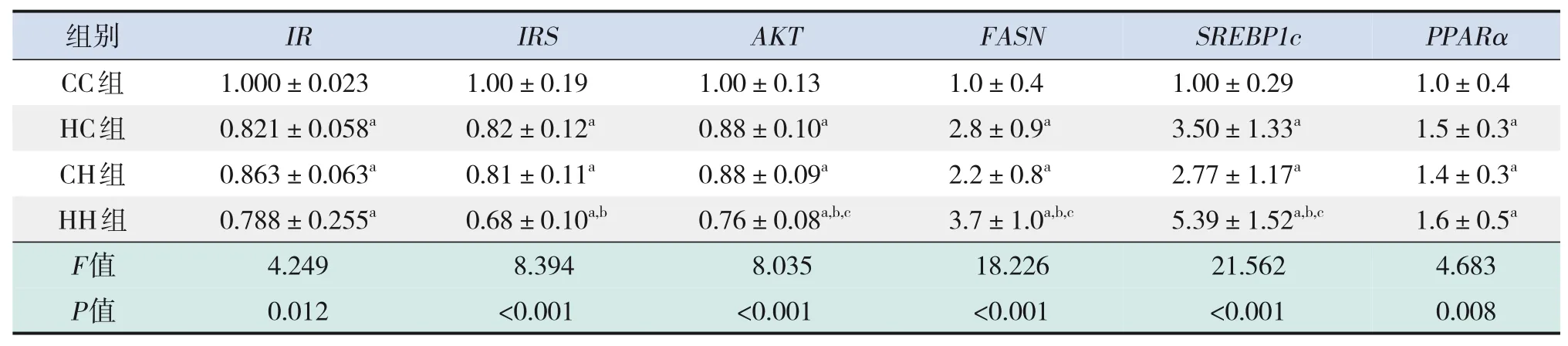
表8 各组生后12周仔鼠肝脏糖脂代谢相关基因的mRNA水平比较(n=9,xˉ±s)
脂代谢方面,HC组、CH组、HH组肝脏TG、TC水平均较CC组显著增加(P<0.05);HH组肝脏TG、TC水平较HC组、CH组显著增加(P<0.05)(表7)。肝脏苏木精-伊红染色及油红O染色结果提示,HH组肝脏空泡形成及脂质沉积最明显,其次为HC组、CH组(图4)。HC组、CH组、HH组肝脏脂质代谢关键基因FASN、SREBP1c、PPARα的mRNA水平较CC组显著增加(P<0.05);HH组FASN、SREBP1c的mRNA水平较HC组、CH组显著增加(P<0.05)(表8)。HC组、CH组、HH组FASN、SREBP1c、PPARα蛋白表达水平均较CC组显著升高,且HH组SREBP1c蛋白表达水平较HC组、CH组显著升高(P<0.05)。见图3和表9。
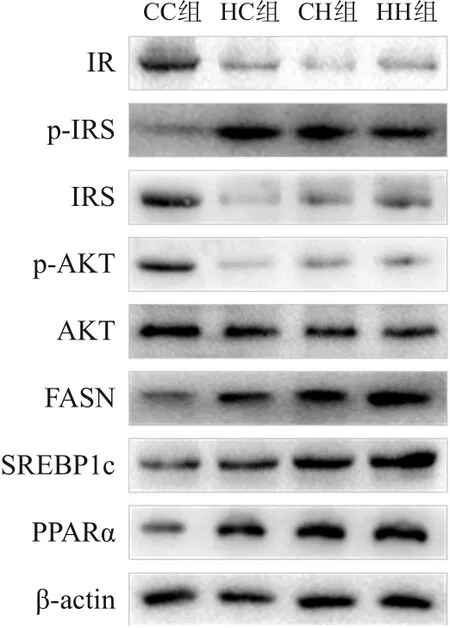
图3 Western blot检测各组生后12周仔鼠肝脏糖脂代谢相关蛋白表达电泳图

图4 各组生后12周仔鼠肝脏病理改变(×200) 肝脏苏木精-伊红染色提示HH组肝细胞空泡增多,脂肪变性最明显,其次为HC组、CH组;油红O染色提示HH组肝脏脂质沉积最严重(脂滴被染为红色),其次为HC组、CH组。
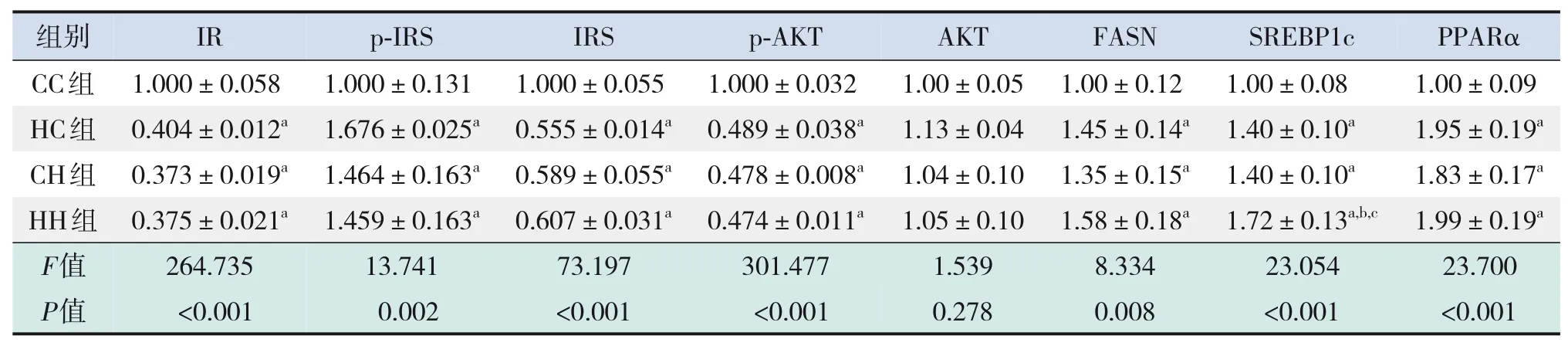
表9 各组生后12周仔鼠肝脏糖脂代谢相关蛋白表达水平比较(n=3,xˉ±s)
3 讨论
在代谢研究中,干预的时机不同,可导致后代不同的表型。Zhao等[7]分别在孕期和哺乳期应用高脂饲料喂养ICR小鼠,探究分娩前后母鼠饮食的差异对子代的不同影响,研究发现,哺乳期高脂饮食组的雄性仔鼠生后21 d的肝脏TG含量较孕期高脂饮食组显著增加。Choi[12]研究了断奶前后母鼠和子代的饮食调整对子代成年后肥胖、胰岛素抵抗等的影响,研究发现,断奶前母鼠的高脂饮食和断奶后子代的高脂饮食通过下丘脑促食欲基因的表达增加导致子代肥胖和胰岛素抵抗,断奶后的饮食调整可部分改善此作用。以上研究分别探讨了分娩前后、断奶前后母鼠或子代的高脂饮食对子代的影响,鉴于孕前、孕期、哺乳期母体肥胖对子代代谢的独立编程作用,本研究重点讨论了怀孕前后饮食的不同对子代糖脂代谢的影响。
由于SD大鼠体型适中便于取材,给予SD大鼠高脂饮食易构建出与人类肥胖发生过程相似的肥胖模型,故本研究中使用SD大鼠进行模型的构建。妊娠期肥胖包括孕前肥胖和孕期增重过多[13]。本研究中,孕前给予高脂饮食6周的SD母鼠,较正常饮食的母鼠,孕前体重明显增加;孕前正常饮食或高脂饮食的母鼠,孕期给予高脂饮食,其孕期增重较正常饮食组显著增加,说明三种方式均可成功构建妊娠期肥胖动物模型。为阐明怀孕前后的高脂饮食干预对子代糖脂代谢的影响,本研究在孕前、孕期哺乳期对SD大鼠进行高脂饲料喂养,并选取幼年期、成年期的仔鼠进行糖脂代谢研究。研究发现孕前、孕期哺乳期全程高脂饮食对子代糖脂代谢影响最大;仅孕前高脂饮食或孕期哺乳期高脂饮食对子代的影响在本研究中未见差异;孕前高脂饮食的大鼠,即使孕期哺乳期更换为正常饮食,其对子代的不利影响仍然存在;高脂饮食对子代糖脂代谢的影响考虑与糖脂代谢基因的表达改变有关。目前较少有研究强调妊娠不同时期的饮食干预对子代代谢的不同影响,本研究不仅对不同时期高脂饮食对子代的糖脂代谢影响进行了比较,而且选取了不同时期的子代进行动态观察,本研究为后期进一步进行妊娠期肥胖相关的机制研究提供了重要依据。
本研究中,HC组、CH组子代断奶时仅表现出脂代谢异常,成年后出现糖代谢异常,提示高脂饮食母鼠子代出现糖代谢异常的时间晚于脂代谢。GTT和ITT分别用于评估葡萄糖耐量和胰岛素敏感性,AUC的增加表明葡萄糖耐量受损和胰岛素敏感性下降。HOMA-IR亦被用来评估胰岛素敏感性,主要预测肝脏胰岛素敏感性,而ITT代表全身胰岛素敏感性[14-15]。胰岛素是体内唯一的降血糖激素,促进糖原生成,减少糖原分解,加速糖酵解,并抑制糖异生。胰岛素抵抗是Ⅱ型糖尿病、代谢综合征等多种慢性病的基础,其特征是肝脏和骨骼肌等对胰岛素的反应减弱[16-17]。在胰岛素抵抗初期,胰岛β细胞分泌胰岛素代偿性增加,导致高胰岛素血症,使血糖维持在正常水平。随着胰岛素抵抗的进展,胰岛素水平急剧下降,机体对胰岛素的反应性减弱,从而出现高血糖[18]。IR/IRS/AKT是经典的胰岛素受体信号转导通路,在糖代谢中发挥重要作用。胰岛素激活IR酪氨酸激酶,从而磷酸化IRS,酪氨酸磷酸化的IRS激活AKT,通过下游因子诱导糖原合成并抑制糖异生,从而发挥降血糖的作用[18-19]。IRS总蛋白减少,丝氨酸磷酸化蛋白增加,p-AKT蛋白减少是胰岛素抵抗的典型特征[20-21]。本研究中,妊娠期肥胖的子代后期均出现不同程度的糖代谢异常,考虑与胰岛素通路基因IR、IRS、AKT的表达改变有关。
本研究中,高脂饮食组子代在断奶时、成年后均表现出脂代谢异常,表现为肝脏TG、TC含量升高。TG是由长链脂肪酸和甘油形成的脂肪分子。FASN利用乙酰辅酶A作为引物,丙二酰辅酶A作为双碳供体,NADPH作为还原等价物,将碳水化合物转化为长链脂肪酸,是脂肪酸从头合成中的重要调节酶[22]。SREBP1c是脂肪酸从头合成的关键转录因子,通过上调肝脏中参与脂肪酸合成的关键基因的mRNA水平,转录激活脂肪酸合成所需的一系列酶[23-24]。PPARα是一种在肝脏中高度表达的配体激活的核受体,参与脂肪酸转运等基因的转录调节,在脂质代谢中发挥重要作用[25]。本研究中,高脂饮食组子代断奶时及成年后肝脏FASN、SREBP1c、PPARα的mRNA及其蛋白表达水平均高于正常饮食组,高脂饮食导致子代肝脏脂质沉积加重,考虑与FASN、SREBP1c、PPARα介导的脂质代谢相关。其深入机制还有待进一步探讨,可能与营养过剩的宫内环境诱导的表观遗传学调控有关,如DNA甲基化、组蛋白修饰、非编码RNA等[26]。
本研究中,虽然HC组与CH组相比,不同时期的子代糖脂代谢水平未见显著性差异,但不能证明孕前高脂饮食与孕期哺乳期高脂饮食相比,其对子代健康的影响无差异。有研究应用自助餐饮食诱导母鼠孕前肥胖,并研究了孕前肥胖和孕期自助餐喂养对胎鼠的独立影响,结果证明母鼠的肥胖状态和孕期的自助餐喂养对子代有独立的影响[27]。该研究应用多样性自助餐饮食干预Wistar大鼠,与本研究中结果的不一致,可能与动物品系、饲料类型等不同有较大关系。由于本研究仅选取了幼年期、成年期两个时间点,且每组大鼠数量有限,尚需增加观察时间,扩大样本数目加以验证。
利益冲突声明:所有作者均声明不存在利益冲突。

