经腋动脉入路全程无对比剂经导管主动脉瓣置换术1例
郑耀富,姜 宇,华经海,黄 俊,郑泽琪,彭景添,彭小平
1 临床资料
患者女,80岁。于2020年5月18日因“反复胸闷5年、加重伴双下肢水肿3 d”入院。入院时体格检查:身高155 cm,体质量46 kg,体温36.5℃,脉搏71次/min,呼吸20次/min,血压110/70 mm Hg(1 mmHg=0.133 kPa)。双肺呼吸音稍低,未闻及干湿啰音;心率71次/min,律齐,心界向左扩大,第3~4肋间可闻及3/6级收缩期杂音;双下肢轻度水肿。既往高血压病史15年。入院实验室检查显示:氨基酸末端脑钠肽前体6 239 pg/mL,血红蛋白115 g/L,凝血酶原时间12.2 s,国际标准化比值1.06。肌酐:144.4μmol/L,eGFR:20.1 mL/(min×1.73 cm2)。2020年5月20日心脏超声提示:重度主动脉瓣狭窄,跨瓣最高流速4 m/s,平均跨瓣压差39 mm Hg,左心室舒张末期内径54 mm,左室射血分数36%。术前CT血管造影示:主动脉瓣瓣环大小28.4 mm×29.7 mm,周长71.9 mm;主动脉窦大小29.7mm×29.4 mm×28.4 mm;窦管交界处大小25.1 mm×25.5 mm;左冠状动脉高度12.1 mm;右冠状动脉高度16.5 mm;三叶瓣,中重度钙化,左冠开口起源于左右冠瓣交界处,左右冠开口均可见钙化,钙化体积约532.6 mm3(图1);主动脉与左心室夹角为46°,右侧髂动脉最狭窄处:4.30 mm×6.8 mm;左侧髂动脉最狭窄处:4.60 mm×5.6 mm,双侧股动脉上段、双侧髂动脉、腹主动脉均可见多发钙化,局部呈环状、半环状钙化,右髂动脉可见动脉瘤(图2)。术前评估:美国纽约心脏病学会心功能Ⅲ级,STS评分为16.6%。诊断为:①重度主动脉瓣狭窄,心功能Ⅲ级;②原发性高血压3级,很高危;③冠状动脉粥样硬化性心脏病;④肾功能不全;⑤动脉粥样硬化。
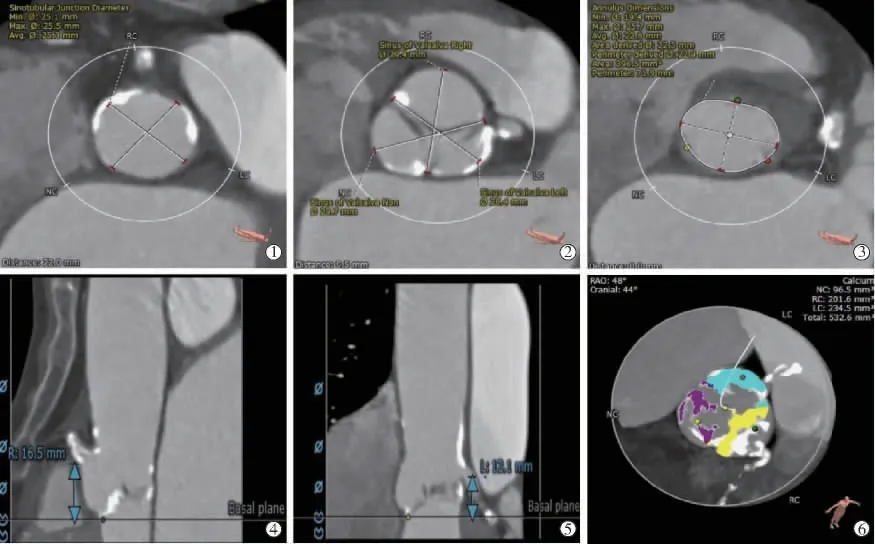
图1 患者主动脉根部解剖结构评估
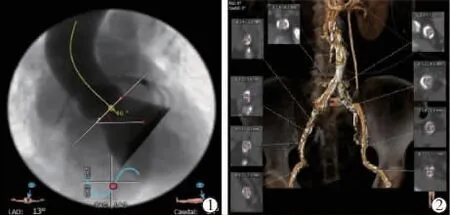
图2 患者主动脉根部解剖结构及外周动脉CT
治疗计划:①患者超声提示跨主动脉瓣血流速度4 m/s,跨主动脉瓣平均压差39 mm Hg,纽约心脏病协会心功能分级Ⅲ级,结合患者临床症状有行主动脉瓣置换指征;患者临床评估为外科手术高危;患者影像学评估:主动脉瓣环内径、主动脉窦宽及窦高、升主动脉内径符合经导管主动脉瓣置换(TAVR)手术要求,可以选择直径26 mm瓣膜,备23 mm瓣膜,患者右冠开口后完全闭塞,可见前降支至右冠侧枝循环,考虑患者右冠为慢性完全闭塞性(CTO)病变,且患者高龄,不再处理冠状动脉。②患者股动脉管径小、粥样斑块及钙化严重,经股动脉入路风险较大,且狭窄处管径较小,同时左右侧颈总动脉管径较小,不利于后续手术,颈动脉CTA分析提示腋动脉-左锁骨下动脉入路可行,拟选择腋动脉切开入路(图3)。③患者主动脉瓣、主动脉窦、主动脉根部、左右冠脉开口均钙化明显,且患者eGFR20.1 mL/(min×1.73 cm2),术中各标记部位在X线下依据钙化标记进行观察定位,在超声指导评估下能否尽量少用、甚至不用对比剂造影进行手术,从而保护患者肾脏。④术中采用静脉复合麻醉,术毕尽早拔管。⑤围手术期予以双抗血小板聚集、调脂、利尿、抗感染等治疗。
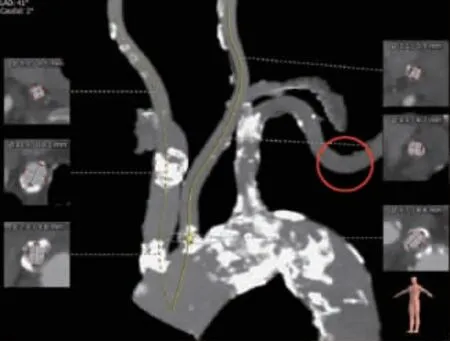
图3 颈动脉CTA
手术过程:常规消毒铺巾,于左侧股动脉置入6 F动脉鞘。经右侧颈内静脉放置临时起搏电极。外科分离切开暴露左侧腋动脉,随后穿刺腋动脉置入9 F动脉鞘管(图4①②③)。经9 F鞘管送入泰尔茂直头“泥鳅”导丝,在AL1.0指引导管支撑下将直头导丝送入左心室,后送入AL1.0指引导管至左心室,Cook Lunderquist Extra stiff超硬导丝进行塑形,使其远端形成2~3个圆圈,交换出直头泥鳅导丝,退出9 F鞘管,再缓慢置入18 F动脉鞘管至升主动脉(图4②)。经18 F鞘管送入NUMED球囊(23 mm×45 mm)至主动脉瓣环处,同时以180次/min快速起搏(当收缩压降至60 mmHg以下时开始扩张),扩张主动脉瓣显示球囊充盈良好,无明显腰征(图4③)。经术前CTA和超声心动图评估,选择并装配启明26 mm Venus-A瓣膜及输送系统,送入瓣膜输送系统至主动脉瓣环处;该患者主动脉瓣、主动脉窦、主动脉根部、左右冠脉开口均钙化明显,在猪尾导管协助,以窦底钙化作为标识确定瓣环位置,瓣膜MARK点准确定位瓣环上2 mm左右处,固定位置后逐渐释放打开瓣膜支架(图4④~⑥);经食管超声心动图提示无二尖瓣返流,人工主动脉瓣膜膨胀形态良好,微量瓣周漏,平均跨瓣压差为9 mmHg(图5)。主动脉及左心室内压力测定跨瓣压差为6 mmHg。拔除鞘管,荷包缝合腋动脉,缝合皮下组织及皮肤。留置临时起搏器返回CCU。静脉应用抗生素3 d。术中静脉给予普通肝素5 000 U。术后2 h复苏后拔出气管插管。患者出院前症状得到明显改善,NYHA心功能Ⅱ级;超声心动图示人工瓣膜工作正常,跨瓣压差明显减少,平均跨瓣压差7 mmHg,无瓣周漏,心功能改善。术后口服阿司匹林和氯吡格雷双联抗血小板治疗。

图4 手术过程
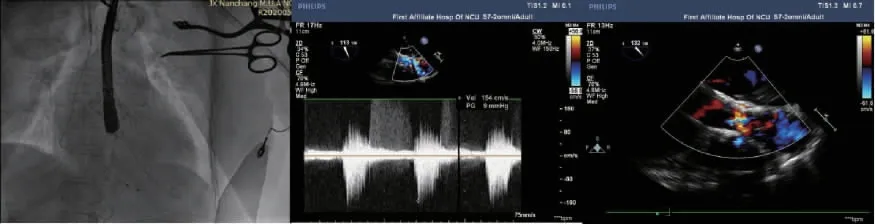
图5 术中瓣膜释放后经食管超声评估
2 讨论
主动脉瓣病变单纯药物治疗效果差,传统手术只能选择外科开胸置换主动脉瓣,我国经导管主动脉瓣置换术已有10余年的发展,其安全性和有效性已得到普遍认可,使得无法耐受外科开胸手术、外科手术中/高危的患者有了更好的选择,创伤小,恢复也较开胸手术快,已广泛应用于临床[1-3]。
血管并发症与TAVR术后致死率和致残率增加有关,约为4.5%[4],入路的选择尤为重要。对于手术患者外周血管条件不一,也决定在施行TAVR手术时,需考虑多种血管入路[5]。根据目前国内TAVR术前影像学评估入路情况,约80%以上TAVR手术可以选择股动脉入路[5]。经股动脉途径是TAVR手术最优选的手术入路,操作简便、创伤也小,对于并发症的控制也更好。但仍有部分患者股动脉血管内径细小,管径<6 mm,血管条件差,有迂曲、重度钙化或由于入路存在严重疾病,不能作为TAVR手术的主要入路,需选择其他入路。目前可以选择的入路包括心尖、升主动脉、锁骨下动脉、颈动脉、腋动脉以及下腔静脉入路[6-7]。2017美国心脏病学会(ACC)专家共识对TAVR入路的推荐顺序为:股动脉>锁骨下>心尖>其他入路[8]。近年来临床发现,经皮腋动脉入路行TAVR手术具有广阔的应用前景[9]。通常腋动脉的直径普遍小于股动脉,患者BMI指数与腋动脉直径呈正相关;目前商用的TAVR手术要求最低管腔直径为5.0~6.0 mm,这取决于选择心脏瓣膜经导管的类型和尺寸。相关研究也表明,11%患者双侧腋动脉<5.5 mm,只有4%双腋动脉<5.0 mm。一般来说,即使股动脉有病变,上肢动脉也相对没有钙化、狭窄和弯曲。综上所述,这些观察结果表明,对于不适合常规经股动脉入路的患者,经腋动脉途径可行[10-12]。
本例患者股动脉粥样斑块及钙化严重,经股动脉入路风险较大,且狭窄处管径较小,同时左右侧颈总动脉管径也较小,不利于后续手术,颈动脉CTA分析提示腋动脉-左锁骨下动脉入路可行。经腋动脉-左锁骨下动脉途径国内尚无先例,与股动脉及颈动脉入路相似,决定是否能行腋动脉入路的先决条件是腋动脉有足够的直径及血管条件良好,该患者腋动脉无明显钙化及斑块,入路后直径均有6 mm以上,能满足送入大鞘的条件。相对于颈动脉,腋动脉-锁骨下动脉途径,斑块脱落后的风险要更小,不易造成脑血管栓塞;且术中发现,术者可以像股动脉入路一样操作,站于患者右侧操控输送系统,另一助手协助即可,操作上也比颈动脉入路更加顺手。
术前CT评估发现该患者血管钙化非常严重,患者主动脉瓣、主动脉窦、主动脉根部、左右冠脉开口均钙化明显,无冠窦底钙化明显,这也为术中瓣膜的定位提供了良好的基础。术前患者eGFR20.1 mL/(min×1.73 cm2),因此介于选择肾功能异常及钙化标志清晰的基础上,在术中未使用对比剂,仅在钙化标记及经食管超声协助下进行瓣膜的定位及释放,最终经食管超声提示瓣膜释放后瓣膜位置及瓣周情况良好。随着近年来我国TAVR手术量的不断增加,不同瓣膜类型、血管入路类型的TAVR也逐渐增多,包括主动脉瓣返流患者,TAVR手术也可以有不错的效果。本文旨在为这类患者的治疗提供参考,希望能通过不断的临床实践,提供一个更安全、更高效的治疗方案。

