液相色谱串联质谱法对原发性醛固酮增多症的诊断价值
程子韵, 陆志强
复旦大学附属中山医院内分泌科,上海 200032
原发性醛固酮增多症(primary aldosteronism,PA)是已知的继发性高血压中的最常见病因,在1、2、3级高血压患者中的患病率分别为1.99%、8.02%和13.2%,而在难治性高血压患者中高达17%~23%[1-3]。PA的诊断主要分为疾病筛查、确诊试验及分型3个步骤,对于筛查试验阳性的患者需进一步行确诊试验来明确诊断。
目前常用于PA筛查和确诊的检测方法是以免疫技术为基础的放射免疫法或化学发光法,但免疫法准确性差、存在交叉干扰。液相色谱串联质谱(liquid chromatography tandem mass spectro-metry,LC-MS/MS)具有灵敏度高、特异度高等优点,正逐渐应用于临床,但其在PA筛查和确诊中尚无统一的诊断标准。我国指南目前推荐的生理盐水抑制试验(saline infusion test,SIT)诊断标准与国外一致,而卡托普利试验(captopril test,CCT)推荐的诊断指标与美国指南存在差异,上述结论均基于免疫法检测结果推导而出[4-5]。本研究旨在探讨LC-MS/MS测定下SIT和CCT对PA的诊断价值及最佳诊断截断值。
1 资料与方法
1.1 研究对象 回顾性选取2018年2月至2019年2月复旦大学附属中山医院内分泌科收治入院的高血压患者127例,年龄18~80岁。纳入标准:(1)持续性高血压(3次非同日测定血压>150/100 mmHg,1 mmHg=0.133 kPa)、难治性高血压(联合使用包括利尿剂在内的3种降压药物,血压大于140/90 mmHg;或联合使用4种及以上降压药物,血压<140/90 mmHg);(2)高血压合并自发性或利尿剂所致低钾血症;(3)高血压合并肾上腺意外瘤;(4)具有早发性高血压家族史或早发(<40岁)脑血管意外家族史;(5)患高血压且一级亲属中存在PA家族史患者;(6)高血压合并阻塞性呼吸睡眠暂停。排除标准:(1)其他继发性高血压病因患者,如肾性高血压、肾动脉狭窄、嗜铬细胞瘤、库欣综合征等;(2)慢性肾功能不全患者(估计肾小球滤过率<70 mL·min-1·1.72 m-2);(3)严重心肺疾病患者(呼吸衰竭、心功能不全3级以上);(4)肝功能不全、肝衰竭患者(肝脏转氨酶升高超过正常上限2倍);(5)妊娠或目前正在应用性激素、糖皮质激素治疗患者。本研究经复旦大学附属中山医院伦理委员会批准(2010-70),所有患者均知情并签署知情同意书。
1.2 检测前准备 检测前停用对激素检测结果存在影响的药物,包括利尿剂、血管紧张素转换酶抑制剂、血管紧张素Ⅱ受体阻滞剂、二氢吡啶类钙离子通道阻滞剂和甘草制剂。其中利尿剂及甘草制剂检查前停用4周,其余药物停用2周。
1.3 激素检测方法 以核素氘为内标,以甲醇和水作为流动相,采用CORTEX C18色谱柱进行分离,采用Xevo TQS ACQUITY UPLC System仪器(Waters公司,美国)检测血浆醛固酮浓度(plasma aldosterone concentration,PAC)。以arginine13C15N为内标,甲醇水溶液和甲酸甲醇溶液作为流动相,采用Phenomenex Kinetex C18色谱柱进行分离,采用QTRAP○R6500(SCIEX公司,美国)仪器检测肾素活性(plasma renin activity,PRA)。PAC的检测线性范围为25~2 000 pg/mL,定量检出下限为12.5 pg/mL,批内和批间不精密度的变异系数(coefficient of variation,CV)分别为<6%和小于10%。建立的PAC生物参考区间为21~211.6 pg/mL(立位)。PRA的检测线性范围为0.028~10.000 ng·mL-1·h-1,定量检出下限为0.028 ng·mL-1·h-1,批内和批间不精密度的CV均小于15%。建立的PRA生物参考区间为0.25~5.12 ng·mL-1·h-1(立位)。2种方法通过性能验证,能有效应用于临床。
1.4 其他相关检查 于6∶00采集患者空腹静脉血,检测肝肾功能、电解质、空腹血糖、血脂等指标。
1.5 CCT和SIT方法 (1)CCT:患者于8∶00口服卡托普利25 mg,服药前静卧30 min,分别于服药前0 min、服药后1 h、服药后2 h,采用EDTA抗凝管抽取静脉血测PAC和血浆肾素活性(plasma renin activity,PRA)水平。在整个试验过程中患者保持坐位或平卧位。(2)SIT:试验于8∶00至9∶30间开始,试验前30 min及试验期间患者均保持平卧位,于4 h内连续静脉滴注0.9%生理盐水2 000 mL。于试验前0 min和生理盐水滴注4 h后,采用EDTA抗凝管抽取静脉血测PAC和PRA水平。
1.6 诊断标准 PA诊断金标准包括2项,满足其中任意1项即可确诊。(1)螺内酯口服试验:对于疑似PA患者予螺内酯80 mg tid口服治疗,并于门诊持续随访,逐渐减少其他抗高血压药物至停用。若患者口服螺内酯后,高血压得到明显控制,同时低钾血症得到改善,则确诊PA;(2)手术切除:若双侧肾上腺静脉采血提示患者肾上腺存在单侧醛固酮优势分泌,则予以手术切除单侧肾上腺,术后随访患者血压、血钾变化情况,若患者症状明显好转则确诊为PA。

2 结 果
2.1 一般资料分析 结果(表1)显示:通过安体舒通试验及手术治疗确诊PA患者57例,其中男性31例,女性26例,平均年龄(53.67±12.02)岁。原发性高血压(essential hypertension,EH)组患者70例,其中男性32例,女性38例,平均年龄(52.70±13.55)岁。2组患者年龄、性别、体质指数、高血压病程、血压值等差异均无统计学意义。PA组患者的血钾水平低于EH组,而血钠及24 h尿钾较EH组升高,差异具有统计学意义(P<0.05)。
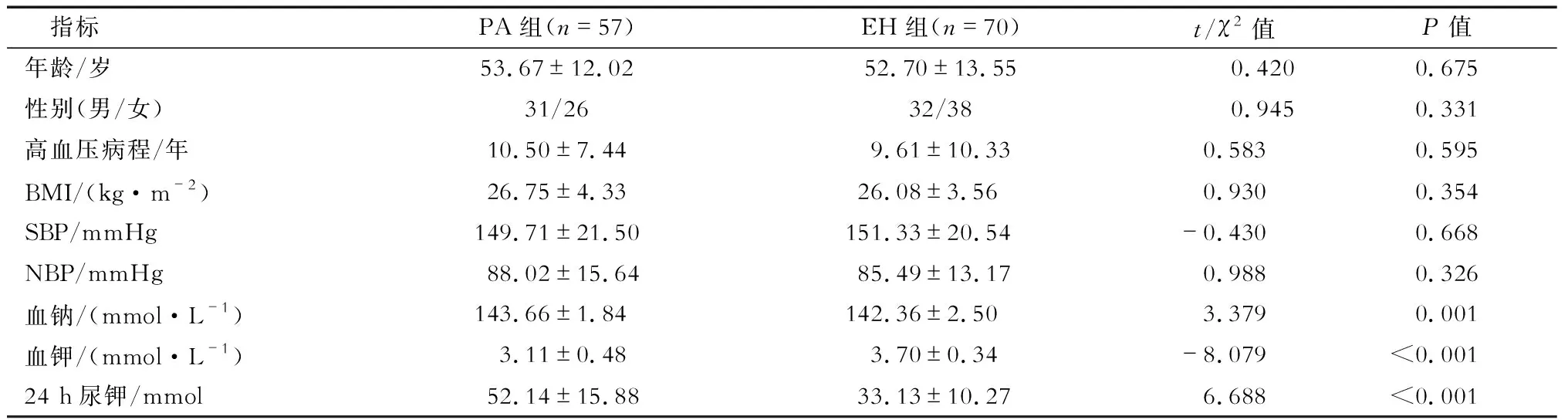
表1 2组患者的一般资料比较
2.2 试验前后PAC和PRA变化情况 结果(表2)显示:CCT和SIT试验前,PA组的PAC均明显高于EH组,PRA均明显低于EH组,差异有统计学意义(P<0.001)。在PA组和EH组中,CCT和SIT试验后的PAC和醛固酮/肾素比值(aldosterone/renin concentration ratio,ARR)较试验前均下降(P<0.001)。
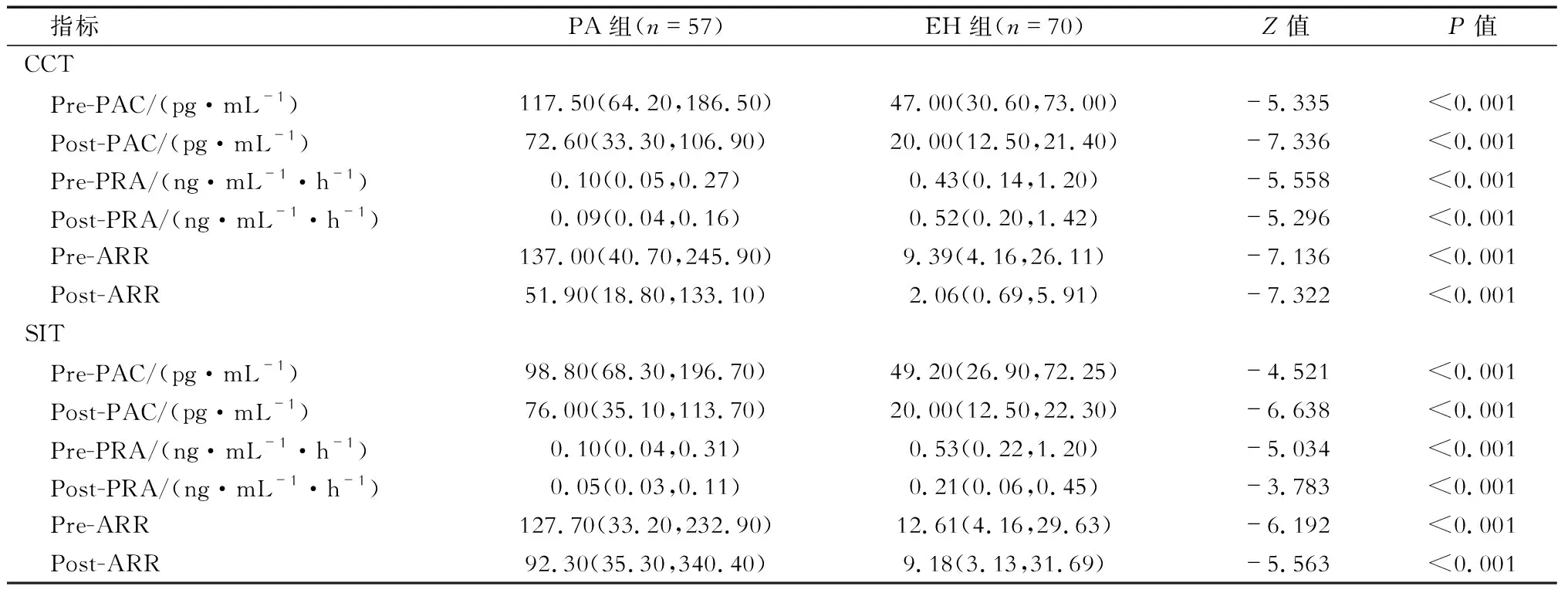
表2 CCT和SIT试验前后患者PAC、PRA和ARR的水平变化情况
2.3 CCT的诊断价值和最佳诊断截断值 结果(图1)显示:CCT试验后PAC、ARR及PAC抑制率对应的AUC分别为0.876(95%CI 0.804~0.948)、0.902(95%CI 0.846~0.959)和0.751(95%CI 0.659~0.842)。三者相比,试验后ARR的诊断价值最高。当ARR=6.5时,YI值达到最大,诊断灵敏度为94.2%,特异度为78.0%。若以试验后PAC绝对值为诊断指标,PAC=34.8 pg/mL时诊断特异度可升至93.2%,但诊断的灵敏度降至75.5%。CCT中不同指标的诊断价值见表3。

图1 CCT诊断价值的ROC曲线
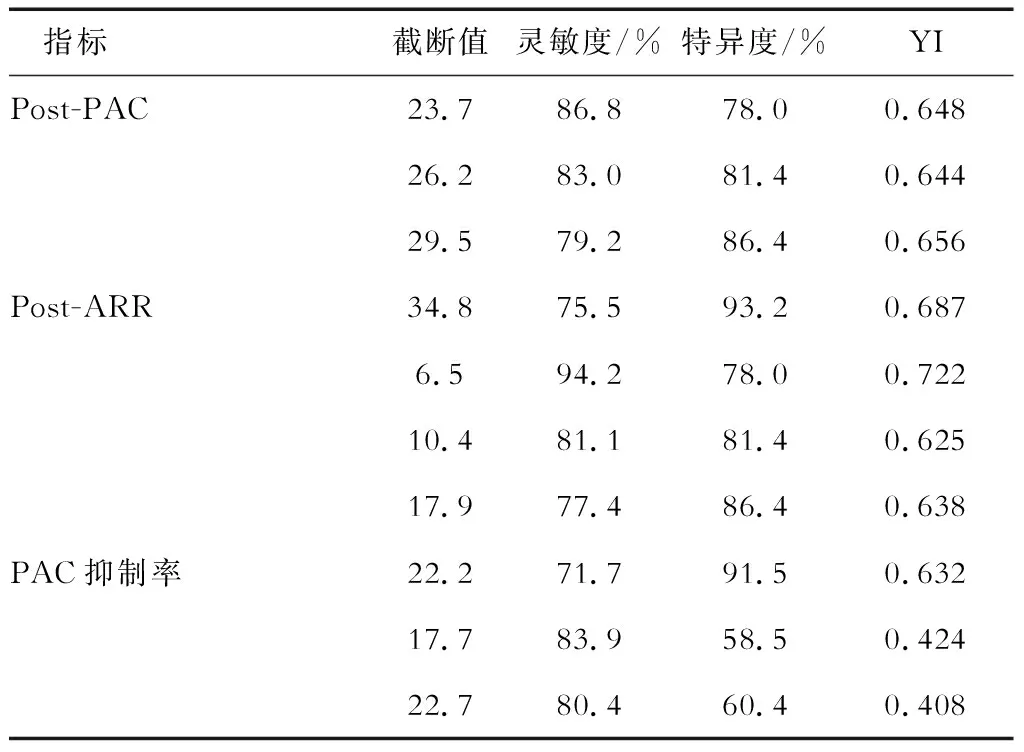
表3 CCT中不同指标的诊断截断值和诊断价值
2.4 SIT的诊断价值和最佳诊断截断值 结果(图2、表4)显示: SIT后PAC、ARR及PAC抑制率对应的AUC分别为0.881(95%CI 0.810~0.952)、0.823(95%CI 0.738~0.909)和0.652(95%CI 0.544~0.760)。SIT后PAC的诊断效率最高,PAC截断值为24 pg/mL时YI达到最大,诊断灵敏度为87.2%,特异度为78.8%。
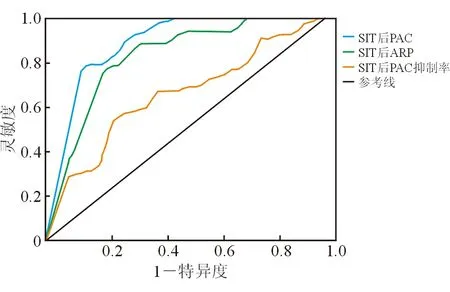
图2 SIT诊断价值的ROC曲线
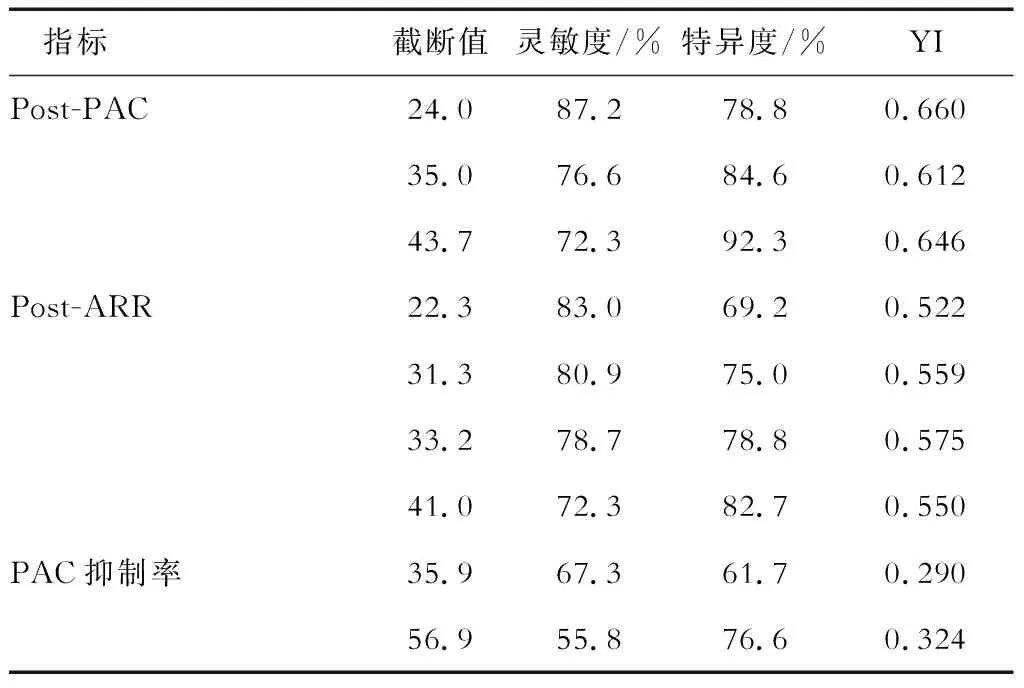
表4 SIT中不同指标的诊断截断值和诊断价值
2.5 CCT和SIT联合诊断的价值 同时完成CCT和SIT的患者84例,若以CCT后ARR>6.5、SIT后PAC>24 pg/mL作为PA的诊断标准,设定满足其中之一即考虑为PA,则在84例患者中漏诊2例,但误诊患者增加至15例,灵敏度和特异度分别为97.7%和82.2%。若以CCT后PAC>34.8 pg/mL、SIT后PAC>24 pg/mL作为诊断标准,则在84例患者中漏诊4例,误诊9例,灵敏度和特异度分别为95.3%和89.3%。
3 讨 论
醛固酮是肾上腺皮质分泌的类固醇激素之一,由血液中的胆固醇经过一系列酶促反应合成。醛固酮在血液循环中的含量低至以pg/mL为单位,精确检测存在困难。传统检测包括放射免疫法和化学发光法[6-7],但由于与醛固酮代谢物及其他类固醇激素存在交叉反应,这2种方法在检测结果上都存在较大数据变异性,采用不同厂商和试剂检测得到的结果缺乏可比性[8-9]。肾素检测目前包括PRA和血浆肾素浓度2种方式。直接测定血浆肾素浓度更具成本和时间效益,但其与肾素原产生的交叉反应可导致结果假阳性,此外还易受到雌激素的影响,检测时需注意避开女性经期[10]。而通过放射免疫法测PRA也存在免疫交叉干扰、线性窄、核素污染等问题,同时孵育时间、pH和酶抑制剂的选择对PRA结果也会造成影响[11]。LC-MS/MS检测可避免检测时的交叉反应,具有更高的检测灵敏度和特异度,正逐渐取代免疫法成为类固醇激素检测的金标准[12-13]。
美国内分泌学会2016年指南推荐的PA确诊试验包括4种试验,受限于试验用药和临床操作,国内目前开展较多的是SIT和CCT。CCT试验操作简便,不会增加循环容量负荷,不良反应小,当患者患有难以控制的高血压或严重心功能不全时可作为首选试验。正常人进行CCT时,作为血管紧张素转换酶抑制剂的卡托普利抑制了体内醛固酮生成,导致PAC降低。CCT诊断性能在东西方人群中的结果不一,Rossi等[14]在1 125例患者中筛查出317例阳性患者并进行CCT,结果发现,PAC取385 pmol/L(即13.9 ng/dL)时诊断价值最大,诊断灵敏度和特异度为69.6%和74%。我国和日本文献[15-17]报道的CCT诊断性能较西方高,试验后PAC诊断截断值为11~25 ng/dL,亦有研究[18]认为以试验后ARR作为诊断指标时的诊断性能更佳。从指南角度出发,美国指南[4]认为非PA患者在CCT后的PAC抑制率应大于30%,我国[5]和日本指南[19]推荐的诊断截断值则分别为11 ng/dL和12 ng/dL。本研究共对111例患者进行CCT,结果发现,当试验后ARR取6.5时诊断性能最佳,此时在52例PA患者中漏诊3例,59例EH组患者中误诊13例。同时,当试验后PAC截断值为34.8 pg/mL(即3.48 ng/dL)时,诊断的特异度达93.2%,由于确诊试验较疾病筛查更需避免误诊,也可将CCT后PAC作为诊断标准截断值。
SIT是目前应用最为广泛的PA确诊试验,但该试验导致患者短时间内的血容量明显增加,可能诱发血压剧烈升高、心力衰竭、电解质紊乱等,在心功能不全、严重低钾血症的患者中应谨慎使用。大部分研究均认可将试验后PAC作为诊断指标,但所得出的最佳截断值及诊断价值存在较大差异。针对西方人群的研究[20-22]得出的截断值多为6~7 ng/dL,美国指南推荐SIT后PAC>10 ng/dL可确诊PA,<5 ng/dL时排除PA。有研究[4,15,17,23]表明,针对中国人群研究得到的最佳截断值较西方国家偏高,SIT后PAC最佳截断值波动在8~14.5 ng/dL。另外,SIT试验具备一定的假阴性率。在一项以双侧肾上腺静脉采血为诊断金标准的小样本研究[24]中,SIT后PAC截断值为5 ng/dL时,漏诊率为29%,而当截断值取10 ng/dL时,漏诊率升至37%。本研究对101例患者进行了SIT,其中2例因血压过高终止试验,总体认为SIT较安全。同样对试验后PAC、ARR和PAC抑制率3个指标的分析结果提示,试验后PAC诊断价值高于其他指标。当截断值取24 pg/mL(2.4 ng/dL)时,灵敏度和特异度分别为87.2%和78.8%。
目前不同文献报道的PA诊断截断值存在明显差异,造成差异的部分原因是研究人群及研究方案设计不同,如部分研究中使用氟氢可的松试验作为诊断金标准,但试验自身也存在一定的假阳性与假阴性率。在各种影响因素中,检测技术对试验结果的准确性和可靠性至关重要。本研究基于LC-MS/MS技术探讨PA确诊试验的诊断价值和截断值,结果较指南和既往文献推荐的数值均明显降低,这可能与本研究采用的检测方法为LC-MS/MS有关。既往研究[25]发现,LC-MS/MS检测下的PAC水平较放射免疫法降低约30%。同时需要注意的是,在进行CCT的111例患者中,66%的患者试验前的PAC小于100 pg/mL,基础PAC水平对结果会造成一定影响,而本研究中试验后PAC抑制率的诊断价值偏低同样也可能与此相关。同时本研究发现,CCT和SIT联合试验可进一步提高诊断效率,考虑到确诊试验对特异度要求较高,建议将CCT后PAC和SIT后PAC作为联合试验的诊断指标。
综上所述,CCT试验后ARR和PAC均可作为PA的诊断指标,诊断截断值为6.5 pg/mL和34.8 pg/mL;SIT后PAC的诊断截断值为24 pg/mL。随着质谱技术的不断普及,未来还需针对LC-MS/MS技术诊断PA进行更加深入的临床研究。
利益冲突:所有作者声明不存在利益冲突。

