玛纳斯湖卤水自然蒸发析盐规律及硼、锂富集规律研究
边绍菊,许乃才,张永兴,李 武
(1.青海师范大学化学化工学院,青海西宁810016;2.中国地质科学院郑州矿产综合利用研究所;3.中国科学院青海盐湖研究所)
玛纳斯盐湖[1]位于新疆维吾尔自治区准噶尔盆地西部塔城地区和布克赛尔蒙古自治县和什托洛盖镇境内。阿勒泰-奎屯217国道及和什托洛盖-克拉玛依公路均从湖区西侧经过,交通方便。湖盆深居准噶尔盆地腹地,古尔班通古特沙漠之中,多风沙,少降水,为温带大陆性干旱-半干旱气候。
玛纳斯河水已不能入湖,主要靠大气降水和地下水补给。晶间卤水富含于石盐和芒硝层中。玛纳斯湖卤水主要是晶间卤水,仅在雨季湖面才有少量湖表卤水。晶间卤水相对密度为1.241、pH为6.87、矿化度为328.44 g/L,盐湖水化学类型为硫酸盐型硫酸镁亚型。玛纳斯湖石盐生产始于20世纪50年代,曾建立和丰(玛纳斯)盐场开采表层石盐。后来利用沟渠生产再生盐,并开始利用盐田生产滩晒盐,年产原盐10余万t。主要产品有原盐、再生盐、粉精盐、加碘盐等系列品种。自2005年开始新疆新雅泰化工有限公司以玛纳斯湖的晶间卤水为原料,生产硫酸钾和硫酸钾镁肥。
黄雪莉等[2]曾对玛纳斯湖水进行了25℃等温蒸发及室温蒸发实验,实验给出了玛纳斯湖卤水蒸发析盐规律,以及自然蒸发析出钾镁混盐的结论,但未提到硼、锂等资源的含量以及在蒸发过程中的分布和富集规律。
卤水蒸发结晶顺序与析盐规律为卤水开发的工艺设计提供最基础和直接的依据,同时为了对卤水资源进行全面的利用,对硼、锂等元素的分布和富集规律的了解也是必不可少的。因此,对卤水进行蒸发实验获得析盐规律和硼、锂等元素的分布规律是非常必要的[3-5]。
水盐体系相图是盐湖卤水资源加工利用过程的重要依据,是整个工艺设计与计算的基础与理论依据。实际过程中很难找到完全适合于工艺生产的水盐体系相图数据,更多的是以相似的水盐体系相图为工艺生产设计和指导的依据,这样往往会给实际生产控制过程带来偏差,更有甚者会严重影响到生产的正常进行。解决的最佳办法是针对每一种盐湖卤水开展卤水蒸发结晶析盐实验[6-7],依据实验结果确定生产工艺技术,然而盲目的蒸发实验耗时耗力,很难通过一两次实验摸准分离节点。
ISLEC(Integrated of Solution Equilibrium Calculator)是一个基于相图方法和Pitzer-Simonson-Clegg超自由能模型开发的卤水-盐矿平衡模拟模型[8-9],可应用于包含Ca-Na-K-Mg-Li-Cl-SO4-H2O多元体系多温范围的相平衡模拟计算。此模型虽然不像相图一样可视直观,但能进行快速计算,以其计算的节点为依据进行实验可以极大地缩短实验时间。本文引用此软件联网版进行卤水常温蒸发模拟计算,并以模拟结果指导蒸发实验的进行,得出玛纳斯湖水自然蒸发时的结晶路线和析盐规律。
1 实验
1.1 原料和分析方法
本文所用卤水为2015年11月取于玛纳斯湖的晶间卤水。化学组成见表1中L0,表中LH数据为文献[2]报道的玛纳斯卤水组成,从表中数据可知,L0卤水除NaCl外,其他组成含量均高于文献报道的组成,但各组成大概是文献的3倍,并且组成类似。
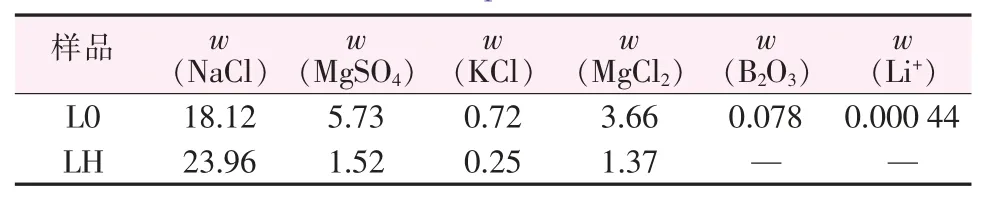
表1 玛纳斯湖卤水组成Table 1 Chemical composition of Manasi brine %
所有样品中常规离子包括K+、Mg2+、Ca2+、Cl-、SO42-、B2O3采用化学分析方法分析,Li+采用原子吸收光谱分析。K+采用四苯硼钠-季铵盐反滴定法;Mg2+、Ca2+采用EDTA容量法;Cl-采用汞量法;SO42-采用BaCl2沉淀质量法;B2O3采用甘露醇法;Na+采用电荷平衡法计算,未列于表中。
1.2 研究方法
本研究用水为玛纳斯湖晶间卤水,起始卤水标记为L0。文章中涉及的模拟计算采用ISLEC软件联网版进行。模拟采用体系为Na-K-Mg-Li-Cl-SO4-H2O。
自然蒸发于青海西宁室内进行,取9.000 kg玛纳斯湖卤水(L0)置于塑料箱,室内自然蒸发,采取电风扇模拟自然风,其间室温变化为17.5~21.5℃。根据ISLEC计算结果分阶段分离取样,固液分离采取真空泵抽滤,分离所得到的固液相均进行化学分析,同时送粉末进行XRD检测确定物相组成,并对固相分析结果进行配矿。
1.3 玛纳斯湖卤水ISLEC计算及蒸发实验
1.3.1 ISLEC模拟计算玛纳斯湖卤水20℃自然蒸发过程
以L0为起始卤水进行计算,每一种新盐饱和时作为分段节点,共计3段:L0到L1C(泻利盐饱和)为石盐段;L1C到L2C(光卤石饱和)为泻利盐段;L2C到L3C(水氯镁石饱和)为钾混盐段。表2为模拟计算各阶段液相组成,表3是模拟计算各阶段析出盐的组成。
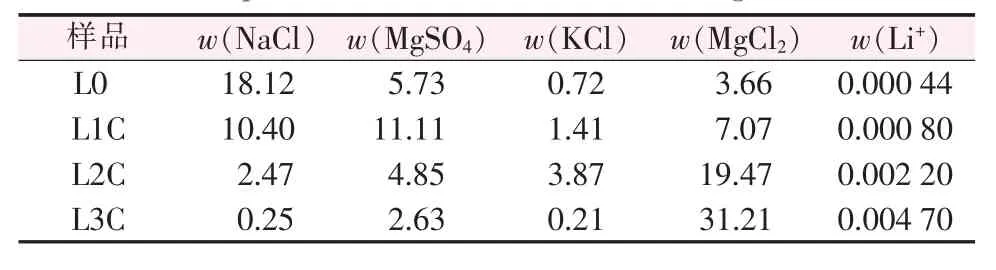
表2 ISLEC计算玛纳斯卤水20℃蒸发过程液相组成Table 2 Chemical composition of Manasi brine during the evaporation at 20℃calculated through ISLEC %
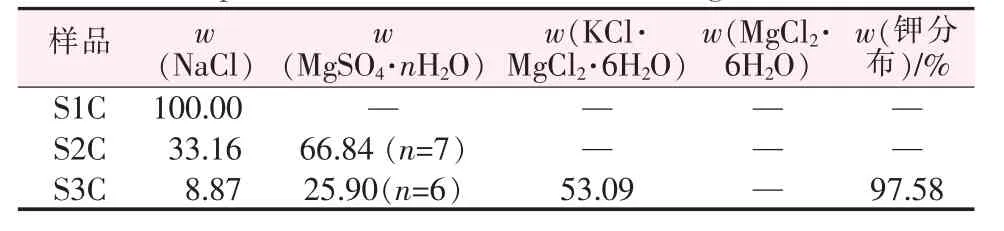
表3 ISLEC计算玛纳斯卤水20℃蒸发过程析出盐种类及含量Table 3 Chemical composition of the solids during the evaporation at 20℃calculated through ISLEC %
1.3.2 玛纳斯湖卤水自然蒸发实验
表4 列出了玛纳斯湖晶间卤水室内自然蒸发实验中每次分离液相的化学分析组成。表5为分离固相的化学分析组成及XRD物相鉴定结果,以盐矿组成形式和夹带母液的含量表示。
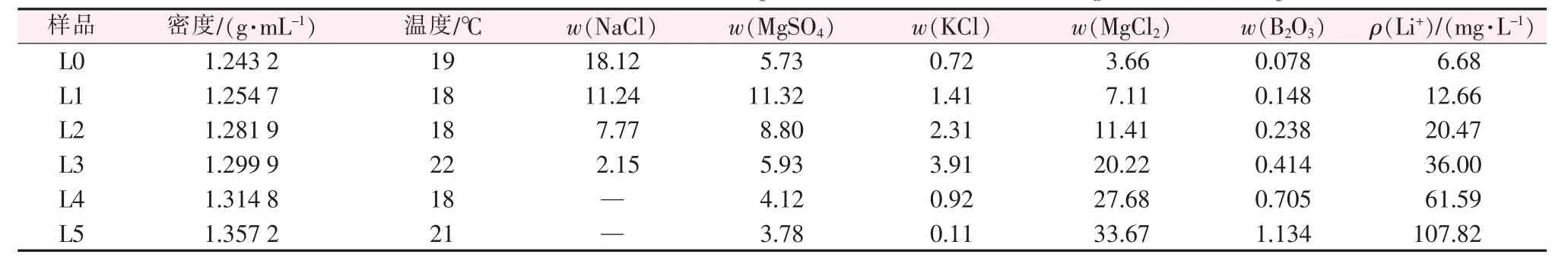
表4 玛纳斯湖卤水自然蒸发液相组成Table 4 Chemical composition of Manasi brine during the natural evaporation %
表5 玛纳斯卤水自然蒸发固相组成Table 5 Chemical composition of the solids during the natural evaporation %
2 结果与讨论
2.1 蒸发过程相图分析及液相组成在相图中的走向
玛纳斯湖水组成位于Na+,K+,Mg2+∥Cl-,SO42--H2O五元体系25℃介稳相图(图1)的泻利盐区(L0),属于典型的硫酸镁亚型卤水。
从相图1a中分析,此湖水在自然蒸发过程中氯化钠饱和之后将会析出大量的泻利盐,液相组成将沿着AL0的延长方向移动,一直到达氯化钾和泻利盐共饱线,交于B点;继续蒸发,析出泻利盐和氯化钾,液相组成沿着共饱线由B到达C;C点是泻利盐、氯化钾和光卤石的共饱和点。根据过程向量分析,此阶段KCl溶解、泻利盐和光卤石析出,直到氯化钾溶解完全,液相组成在C保持不动;继续蒸发,析出泻利盐与光卤石,液相组成沿着共饱线由C到达D点;D点是泻利盐、光卤石与水氯镁石的共饱点,继续蒸发析出泻利盐、光卤石与水氯镁石,直至溶液被蒸干。
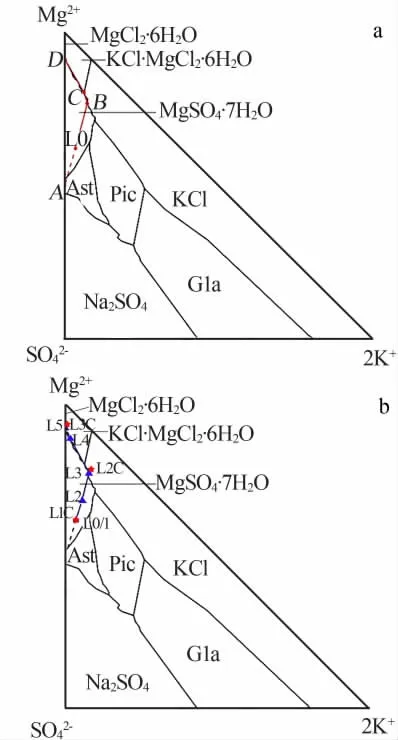
图1 Na+,K+,Mg2+∥Cl-,SO42-·H2O五元体系25℃介稳相图[10]预示的L0卤水蒸发时的液相走势(a)及ISLEC计算和实验获得的液相组成在相图中的位置(b)Fig.1 Liquid phase trend of L0 brines in the evaporation process indicated by the metastable phase diagram[10]of Na+,K+,Mg2+∥Cl-,SO42-·H2O at 25℃(a)and the location of brine of ISLEC and experiment in the diagram(b)
将ISLEC模拟计算蒸发过程中液相的组成(L1C、L2C、L3C)及实际蒸发过程中液相组成(L0-L5)标注于Na+,K+,Mg2+∥Cl-,SO42--H2O五元体系25℃介稳相图中(图2b)。可以看出,模拟计算及室内自然蒸发实验各阶段的液相组成,基本与介稳相图预示的路线一致。
2.2 蒸发过程结晶路线及析盐规律
2.2.1 模拟蒸发过程结晶路线及析盐规律
ISLEC程序模拟计算结果(表3)可知,玛纳斯湖水L0在20℃时自然蒸发的结晶路线:①NaCl;②NaCl+MgSO4·7H2O;③NaCl+MgSO4·6H2O+KCl·MgCl2·6H2O;④NaCl+MgSO4·4H2O+KCl·MgCl2·6H2O+MgCl2·6H2O。
第一阶段为石盐阶段,析出固相为NaCl。第二阶段为泻利盐阶段,析出固相为NaCl+MgSO4·7H2O。第三阶段为光卤石阶段,析出固相为NaCl+MgSO4·7H2O+KCl·MgCl2·6H2O,该阶段析出光卤石品位为53.09%(KCl品位为14.24%),钾收率97.58%。由相图分析可知,钾盐饱和后有一小段氯化钾、泻利盐共析阶段,但当光卤石饱和后,又有一小段KCl回溶而光卤石析出阶段,而后才是光卤石和泻利盐共析阶段,如果这一小段氯化钾阶段不做分段分离,合并到光卤石阶段,最终固相中不出现氯化钾。第四阶段为水氯镁石阶段,光卤石基本析出完毕,剩余卤水为氯化镁饱和的老卤,继续蒸发少量水即可析出大量水氯镁石及少量氯化钠、泻利盐和光卤石。
2.2.2 实际蒸发过程结晶路线及析盐规律
由表5可知,玛纳斯晶间卤水在实际自然蒸发过程中的结晶路线:①CaSO4·2H2O+NaCl;②CaSO4·2H2O+NaCl+MgSO4·6H2O;③NaCl+MgSO4·6H2O+KCl(少量)+KCl·MgCl2·6H2O;④NaCl+MgSO4·6H2O+KCl·MgCl2·6H2O+MgCl2·6H2O。
自然蒸发实验中析盐种类和析盐顺序与介稳相图预示和ISLEC模拟计算的基本一致。主要的差别在于卤水实际蒸发过程中:1)石盐及泻利盐阶段有石膏存在;2)实际过程中泻利盐为六水泻盐;3)光卤石阶段混合有少量氯化钾,这是由于实际过程KCl不能完全回溶所致。光卤石段(S4+S5合并)获得的光卤石品位为36.72%,KCl品位为10.59%,品位比ISLEC计算的略低是由于实际实验中盐矿分离时夹带了10%~20%的母液。
其结晶路线和析盐顺序与其他硫酸盐型盐湖卤水如大柴旦夏季盐湖卤水的结晶路线是类似的[11]。同时,本文研究所得玛纳斯湖晶间卤水自然蒸发的结晶路线与黄雪莉等[2]研究的结果有不一致的地方。黄雪莉等[2]给出的结晶路线中前期有白钠镁矾析出,且钾是以钾镁盐的形式析出,这主要是因为具体实验条件和操作的差别导致。
2.3 蒸发过程中液相组成变化
图2 为玛纳斯湖水蒸发过程中液相组成的变化趋势,其中虚线为ISLEC计算结果,实线为实验结果;绿色线条代表NaCl、红色线条代表MgSO4、黑色线条代表KCl、蓝色代表MgCl2。
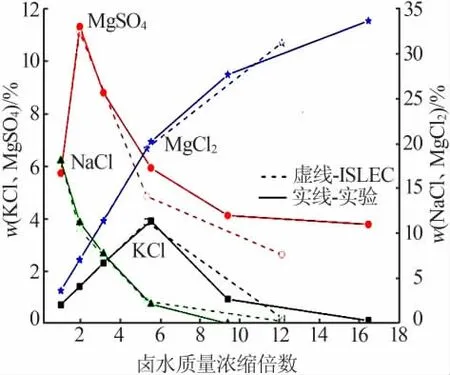
图2 玛纳斯卤水蒸发过程中液相组成变化趋势Fig.2 Variation trend of liquid phase composition during evaporation of Manasi brine
由表2、表4和图2可知,随着蒸发的进行,已饱和的氯化钠析出,溶液中的氯化钠不断减少。液相中的硫酸镁随着蒸发的进行不断富集,当质量分数达到约11%时饱和,而后硫酸镁以泻利盐的形式析出,溶液中硫酸镁含量开始降低。液相中氯化钾浓度也随着蒸发的进行直线升高,硫酸镁析出一定量后,液相中氯化钾质量分数约3.9%时达到饱和,随后随着氯化钾以光卤石的形式析出后,液相中氯化钾含量急剧下降。随着蒸发的进行,液相中氯化镁含量一直处于富集上升阶段,在光卤石析出之前氯化镁的含量随蒸发的进行直线升高;而随着光卤石的析出,溶液中氯化镁的浓缩趋势放缓,到水氯镁石饱和时,溶液中氯化镁质量分数可达到30%以上。由图2可以看出,ISLEC计算及实验得到的液相组成变化趋势基本一致。
2.4 蒸发过程中硼、锂的富集分布规律
玛纳斯湖晶间卤水室内蒸发实验的不同浓缩阶段,液相中硼、锂及卤水质量浓缩倍数关系见表6。由表6看出,整个蒸发过程中,卤水浓缩了约16倍,每一阶段液相中B2O3及Li+的浓缩倍数基本与卤水浓缩倍数一致,且固相中B2O3及Li+的含量属母液夹带范围。这表明,在蒸发过程中B2O3和Li+并未析出,而是一直富集在卤水中,当氯化镁饱和时,B2O3可富集到约1%(质量分数),Li+约100 mg/L。这个结论与海水型硫酸镁亚型卤水蒸发过程中硼、锂富集规律是一致的,高世扬等[11]指出,这一类型的卤水中硼可富集到极限动态硼酸盐溶解度(B2O3约5.3%)而不析出,而Li+在到达MgCl2、MgSO4及Li2SO4共饱和前也可以富集到约0.4%。
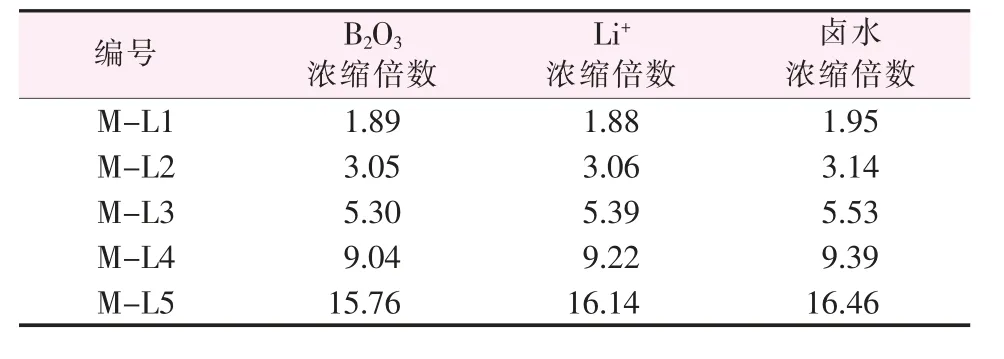
表6 卤水及卤水中B2O3、Li+的浓缩倍数Table 6 Concentrated times of brine and B2O3,Li+in brine
3 结论
1)通过对ISLEC模拟计算与实验结果的比较可以看出,实验中自然蒸发的结晶路线和节点与ISLEC模拟的结果基本一致,在实验中只要按照ISLEC计算的节点分离可以得到与模拟一致的结果。这也印证 了ISLEC在Na+,K+,Mg2+∥Cl-,SO42--H2O体系自然蒸发模拟计算的准确性,可以用于预测其结晶路线和分离节点,指导室内实验和盐田实验的进行。
2)玛纳斯湖水在自然蒸发过程中析盐顺序为:NaCl-MgSO4·6H2O-KCl·MgCl2·6H2O-MgCl2·6H2O。钾盐开始析出时,约需要蒸失水分54%,钾盐以光卤石的形式析出,且在整个钾盐析出阶段都伴随着泻利盐的析出,得到品位较低且较难加工的镁、钾混盐矿,建议采用冬季除硝后再进行盐田摊晒,得到不含硫酸盐的光卤石矿。
3)玛纳斯湖水硼含量较低,原始卤水中B2O3含量仅为0.078%(质量分数,下同),但其在蒸发过程中并不析出,可以一直富集在卤水中,当大部分钾析出完毕时,可富集到约1%,可以提取利用。原始玛纳斯湖水中Li+含量极低,质量浓度仅为6.68 mg/L,即使富集到老卤阶段也仅约100 mg/L,难以开发利用。

