驴骨胶原蛋白肽对骨质疏松大鼠的改善作用
周广运,樊雨梅,刘楚怡,廖 峰,张筱梒,李八方,
(1.国家胶类中药工程技术研究中心/东阿阿胶股份有限公司,山东聊城 252200;2.青岛海洋生物医药研究院,山东青岛 266001)
驴骨是驴屠宰后的副产物,约占驴总重量的10%。目前,大多数的驴骨被废弃,只有少部分被加工成骨粉或骨泥等附加值较低的产品[1]。分析驴骨的化学组成可知,驴骨中蛋白质的含量可达25%[2],且主要组成蛋白为胶原蛋白。胶原蛋白作为一类结构特殊的蛋白,在美容、医药及食品中都有着广泛的应用[3-5],但同时作为大分子蛋白,胶原蛋白只有在人体内逐步分解为氨基酸才能被吸收利用。而肽作为蛋白质的中间水解产物之一,与蛋白质相比较,能被人体更好地消化吸收利用,同时,相关研究也表明小分子肽还具有多种调节人体生理功能的作用[6-8]。
骨质疏松是中老年人常见的一种病症,主要表现为骨质量下降、骨脆性增加、易骨折等[9]。目前用于改善和治疗骨质疏松的方法包括药物干预及营养补充剂等,但由于药物治疗存在着一定的副作用,越来越多的患者将营养补充剂作为首选。在营养补充剂的使用报道中,除含钙类物质使用较普遍外,胶原蛋白肽类抗骨质疏松的研究报道也备受关注[10-12]。
驴骨胶原蛋白肽(donkey bone collagen peptide,DBCP)是驴骨胶原蛋白水解后的产物,由于驴资源的稀缺和珍贵,关于DBCP的功效研究报道很少,其中刘楚怡等[13]开发了一种不同分子量抗骨质疏松驴骨肽的制备工艺,但具体的生理作用效果并未作研究。相关研究也表明不同分子量的胶原蛋白肽在理化、功能及吸收方面都存在着较大的差异[14-16]。对此,本研究以刘楚怡等[13]的驴骨活性肽制备工艺为基础,对相关制备方法进行了优化,重点研究了不同分子量DBCP对改善骨质疏松的功效作用,以期为DBCP的功效证实、扩展及产品开发转化提供理论基础。
1 材料与方法
1.1 材料与仪器
驴骨胶原蛋白 东阿阿胶股份有限公司;SD大鼠 SPF级(动物许可证号SCXK(鲁)20140007),济南朋悦实验动物繁育有限公司;血清钙检测试剂盒、血磷检测试剂盒、TNF-αELISA检测试剂盒、碱性磷酸酶检测试剂盒 南京建成生物工程研究所;氢氧化钠、盐酸、乙醇、氯化钠 分析纯,北京化学试剂公司;胰蛋白酶 食品级,南京庞博公司;青霉素、乙醚、PBS缓冲液 生物级,美国Gibico公司。
AY220电子分析天平 日本岛津公司;VORTEX 1圆周振荡摇床 广州仪科实验室技术有限公司;TS-1涡旋振荡器 海门市其林贝尔仪器制造有限公司;GL-20B高速冷冻离心机 上海安亭实验仪器厂;pHS-3C精密pH计 上海精密科学仪器有限公司;SY21-NI4V恒温水浴锅 北京长风仪器仪表公司;UV-2010PC紫外分光光度计 上海尤尼克仪器有限公司;SM-2.8-10型马弗炉 天津市华北实验电炉厂;BH-2显微镜 Olympus公司;680型全自动酶标仪 美国BIORAD公司;GK99-UNIGAMMA XRAY PLUS双能X射线骨密度仪 北京中西远大科技有限公司。
1.2 实验方法
1.2.1 不同分子量DBCP的制备 参考刘楚怡等[13]不同分子量DBCP的制备方法。以驴骨胶原蛋白为原料,采用胰蛋白酶进行酶解,使用氢氧化钠溶液调节体系pH,具体制备工艺条件见表1。酶解结束后,95 ℃条件下灭酶活,得到的酶解产物过滤去杂,并进行0.8 μm抽滤膜超滤,最后将溶液通过旋转蒸发仪浓缩,倒入玻璃平板冻干。
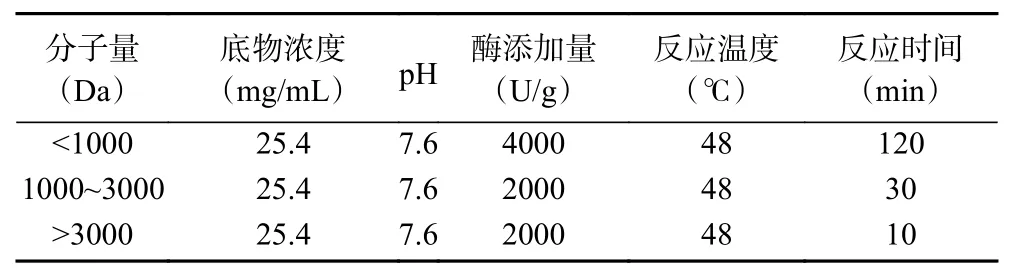
表1 不同分子量驴骨胶原蛋白肽的制备工艺条件Table 1 Preparation conditions of donkey bone collagen peptides with different molecular weights
1.2.2 大鼠骨质疏松模型的构建 本研究参考较常用的去卵巢手术法构建大鼠的体内骨质疏松模型[12]。选取健康的SPF级雌性SD大鼠,体重200±20 g,全部动物适应性喂养14 d后,将动物随机分为假手术组和去卵巢手术组。大鼠去卵巢操作:首先将大鼠麻醉仰卧固定,于腹中线两侧处去毛,并使用75%酒精消毒,待稍干后做纵形切口,切开皮肤和腹肌;之后打开腹腔,拨开脂肪层找到子宫角,沿子宫角方向向上将其尽头处的组织轻轻拉出,分离脂肪,即可找到被脂肪包裹的卵巢组织;用止血钳夹在卵巢与子宫角末端位置,使用手术线结扎后,将卵巢组织及其连带的脂肪全部切除,然后将剩余子宫角送回腹腔;最后将腹肌和皮肤分层进行缝合后,伤口处洒适量青霉素钠溶液进行消毒。同法剪除另一侧卵巢。假手术组大鼠仅打开腹腔后摘除少量脂肪组织。
1.2.3 动物分组及配方饲喂 手术后4周,将接受去卵巢手术的大鼠随机分为7组,其中1~6组为受试样品组,第7组为阴性对照组,假手术大鼠设为第8组,总计8组,每组10只。大鼠饲料的配制参照AIN-93标准配方(见表2),其中3种不同分子量的DBCP各设2个剂量组,DBCP分别占比2%和4%。1~6组按照A~F饲料配方喂养,阴性对照组和假手术组按照G配方喂养,实验期间动物自由饮用蒸馏水。大鼠按各配方饲喂12周,期间观察大鼠活动、饮食等一般状况,每周称量体重一次。
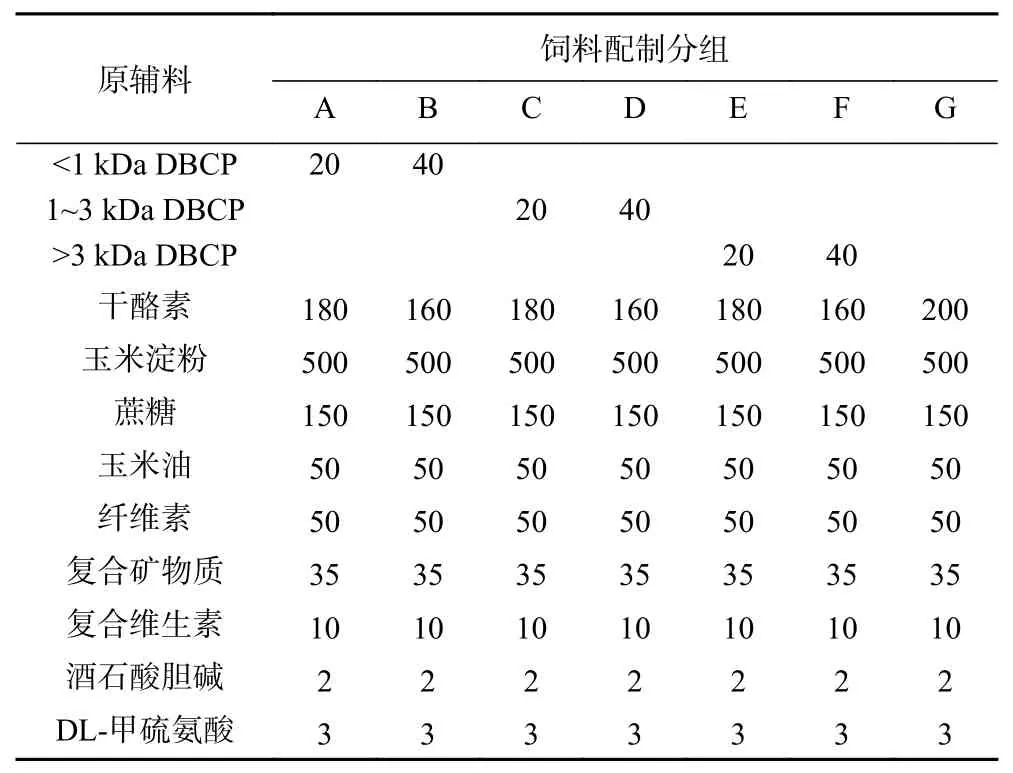
表2 不同分子量驴骨胶原蛋白肽饲料配方Table 2 Formula of donkey bone collagen peptide with different molecular weights
1.2.4 大鼠子宫指数及形态观察 喂养结束后,大鼠放血处死,取出子宫器官,仔细清除周围结缔组织并立即称重,计算子宫指数。之后,将子宫置于中性甲醛溶液中固定,流水冲洗,对子宫样本进行常规石蜡包埋并切片染色。染色采用苏木精-伊红染色法,染色流程为:切片复水后,苏木素染液染色5 min,用1%的盐酸-乙醇分色,水洗15 min左右;伊红染液染60 s,95%的酒精和100%的酒精各分色3 min,二甲苯中脱水完全,中性树胶封片。最后使用光学显微镜对各组大鼠子宫形态变化进行观察。
1.2.5 血清样本的处理及生化指标的测定 大鼠饲喂12周,末次喂养后,各组禁食不禁水12 h。将大鼠用乙醚麻醉后进行腹主动脉取血,血液于室温静置30 min后,于4 ℃、4000 r/min条件下离心15 min,分离得到的血清-80 ℃贮存。血清样本解冻后涡旋振荡混匀,按照各试剂盒说明书检测血清样本中各基本指标含量,包括血钙、血磷、谷丙转氨酶、谷草转氨酶、肌酐、尿素氮、碱性磷酸酶、肿瘤坏死因子和雌二醇等。
1.2.6 大鼠股骨与胫骨分离处理 沿大鼠关节走向,小心将双侧股骨与胫骨取下,并用剪刀及纱布剔净附着于骨上的肌肉与结缔组织。使用生理盐水浸泡过的纱布将右侧股骨样本包裹,使其保持湿润,置于-80 ℃冰箱保存,用于骨密度检测;左侧股骨样本置于-80 ℃冰箱保存,备用。右侧胫骨样本置于中性甲醛溶液中固定备用,用于制作骨切片;左侧胫骨样本快速清理后保存于-80 ℃冰箱中,备用。
1.2.7 大鼠股骨骨密度测定 将大鼠股骨样本取出,去除包裹样本所用的纱布,将保持湿润的股骨样本放于测试台水膜之上,使用双能X射线骨密度仪对样品进行扫描,扫描时切换至小动物模式。扫描结束后使用配套软件对股骨样本的骨密度进行分析。
1.3 数据处理
采用SPSS21.0对数据进行显著性分析,组间比较采用单因素方差分析,显著性水平为P<0.05或P<0.01。
2 结果与分析
2.1 DBCP对骨质疏松大鼠的安全性评价
2.1.1 DBCP对大鼠体重的影响 体重能够在一定程度上反映出生物体的健康状况,样品饲喂期间各组大鼠的体重变化如图1所示。
由图1可知,随着整个实验过程的进行,各组大鼠的体重均呈现逐渐上升的趋势。不同组间比较,去卵巢的阴性对照组大鼠体重增加速度明显高于假手
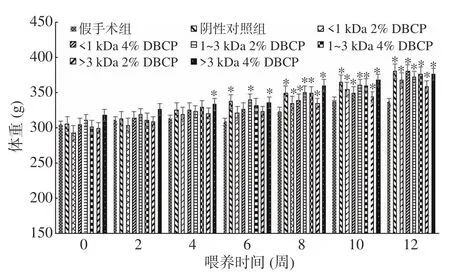
图1 各组大鼠体重随喂养时间的变化情况Fig.1 Changes of body weight of rats in each group with feeding time
术组,这主要为大鼠去卵巢后,自主活动减少致体重增加,即去卵巢手术对大鼠体重的增加有一定的激发作用,这与相关文献报道相一致[17]。自第8周起,所有实施去卵巢手术组的大鼠体重与假手术组相比,均呈现出显著性差异(P<0.05)。进行至第12周时,六组DBCP组与去卵巢阴性对照组相比,均不存在显著性差异,这表明DBCP不会引起去卵巢大鼠体重的显著变化,即DBCP不能逆转摘除卵巢对大鼠体重产生的代偿性肥胖。
2.1.2 DBCP对大鼠子宫的影响 大鼠去卵巢后,由于雌激素水平的降低,会使子宫发生萎缩等现象。喂养结束后,在对大鼠的解剖过程中,可明显看出假手术组大鼠子宫形态饱满,子宫角粗大且颜色红润健康;而摘除卵巢的大鼠子宫萎缩、子宫角变细,色泽泛白,可比较直观地判断出去卵巢大鼠骨质疏松模型造模成功。数据比对方面,子宫指数作为评价子宫变化的衡量标准之一,DBCP对大鼠子宫指数的影响结果如图2所示。与假手术组相比,去卵巢后的大鼠子宫指数均呈现极显著性降低(P<0.01),说明去卵巢手术成功,大鼠骨质疏松模型造模成功,可用于受试物评价。而与阴性对照组相比,样品组大鼠子宫指数虽有一定程度的下降,但差异不显著(P>0.05),说明受试样品均不能改善去卵巢所致的子宫萎缩现象,同时也说明各样品均不会对大鼠体内雌激素的分泌产生影响,长期食用不会引起副作用。
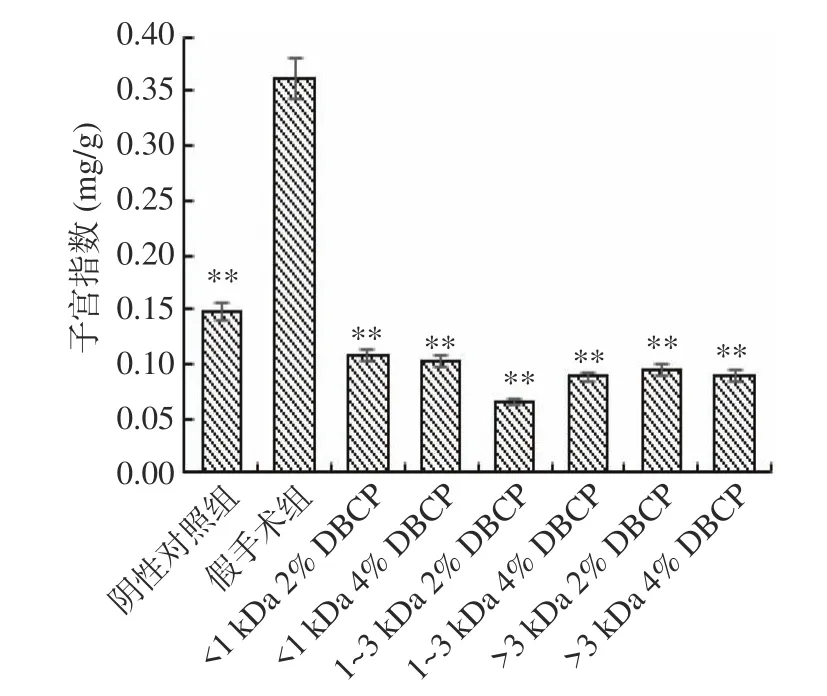
图2 DBCP对大鼠子宫指数的影响Fig.2 Effect of DBCP on uterine index in rats
为了更好地观察大鼠子宫的变化,分别对各组大鼠子宫进行了切片染色,观察结果如图3所示。可以看出:假手术组子宫壁细胞形态饱满,且子宫内膜较厚,去卵巢组的子宫内膜壁显著变薄,且发生了明显的萎缩。而六组DBCP均未对去卵巢大鼠的子宫形态产生显著性影响,切片结果均与阴性对照组类似。因此,可判定各样品组均不能改善由去卵巢所致的子宫萎缩现象,对子宫的形态及质量亦均无显著性作用。此研究结果与DBCP对大鼠子宫指数的影响相一致。
2.1.3 DBCP对大鼠肝功能的影响 谷丙转氨酶(Alanine aminotransferase,ALT)和 谷 草 转 氨 酶(Aspartate aminotransferase,AST)是评价肝功能受损的重要指标,可指示急性肝细胞的损伤。图4展示了DBCP对大鼠ALT和AST活力的影响。由图可知,各组间ALT、AST酶活力均未见显著性差异(P>0.05),可判定DBCP不会引起大鼠肝功能的损伤。
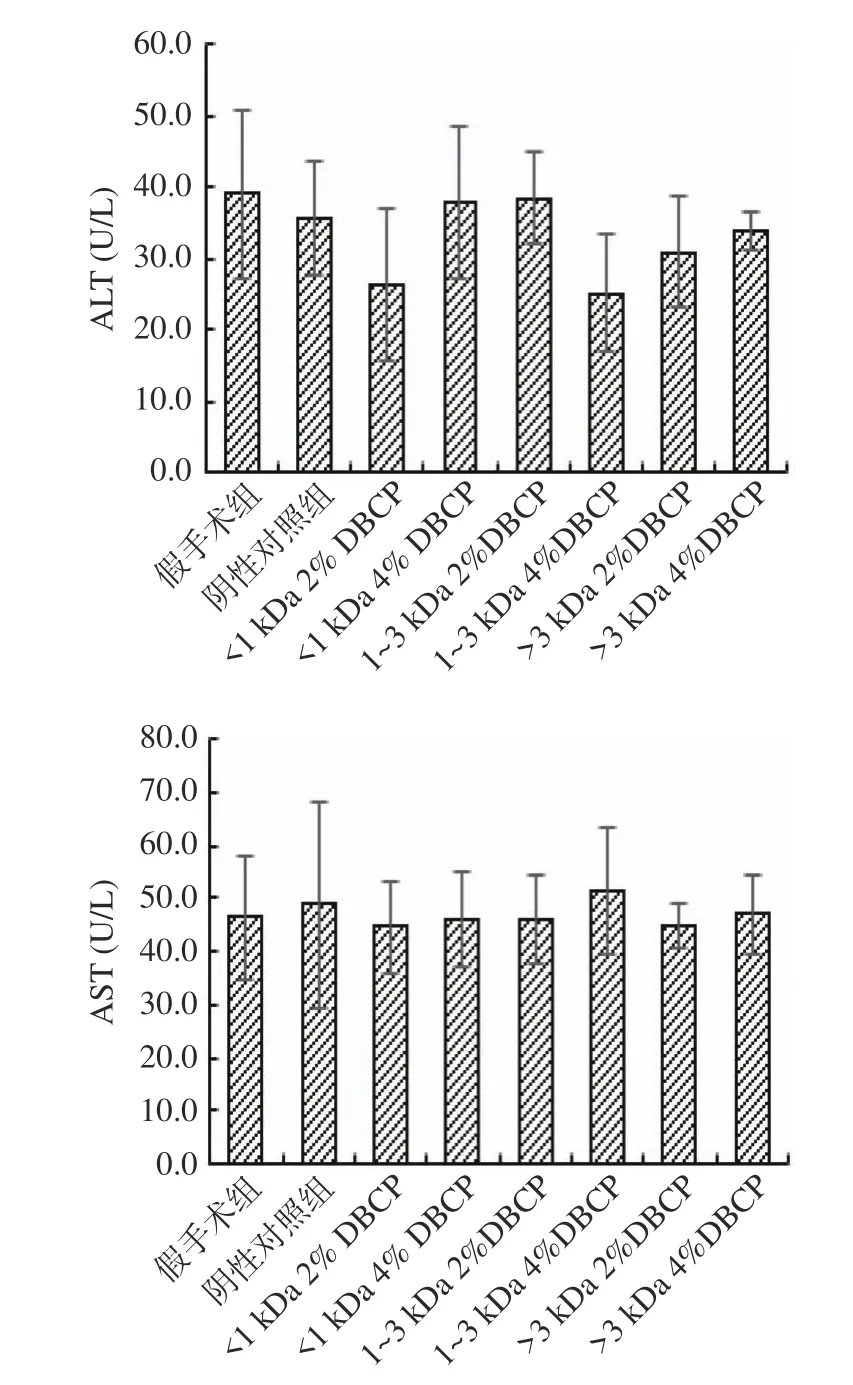
图4 DBCP对大鼠ALT和AST酶活力的影响Fig.4 Effect of DBCP on ALT and AST activities in rats
2.1.4 DBCP对大鼠肾功能的影响 血清尿素氮(Blood urea nitrogen,BUN)由肾小球滤过排出,正常BUN参考值为:2.9~7.5 mmol/L,肾功能不全时,BUN将升高。图5显示了DBCP对大鼠BUN含量的影响,与假手术组相比,阴性对照组大鼠BUN含量呈现极显著性升高(P<0.01),但仍在正常值范围内;而各组DBCP与阴性对照组相比,除1~3 kDa 2% DBCP和>3 kDa 4% DBCP外,BUN含量均呈现极显著性下降(P<0.01),说明DBCP对骨质疏松大鼠肾小球滤过功能有一定的促进作用。
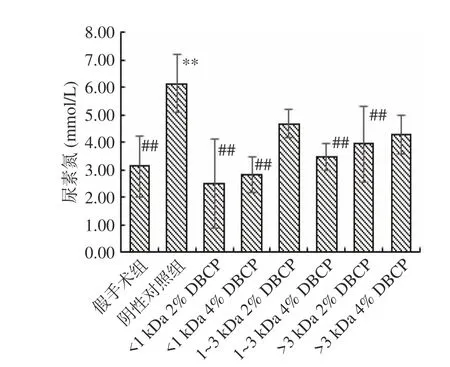
图5 DBCP对大鼠BUN含量的影响Fig.5 Effect of DBCP on BUN content in rats
肌酐(Creatinine,Cr)通常也作为评价肾脏的功能性指标,DBCP对Cr含量的影响如图6所示。由图6可知,与假手术组相比,各组大鼠的Cr含量均未见显著性差异(P>0.05)。说明去卵巢手术和各组DBCP喂养均不会对大鼠Cr含量带来显著性影响。
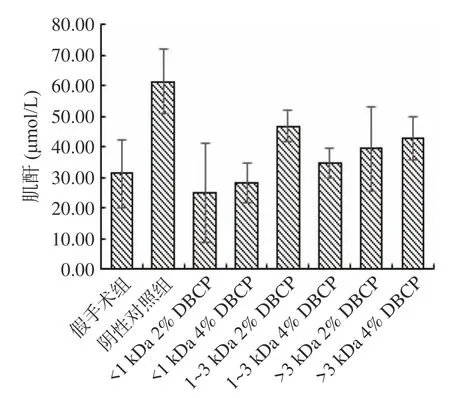
图6 DBCP对大鼠Cr含量的影响Fig.6 Effect of DBCP on Cr content in rats
综上所述,受试样品DBCP各剂量组均不会显著影响大鼠的体重、子宫指数及肝肾功能,DBCP能够作为安全的天然补充剂长期服用。
2.2 DBCP对骨质疏松大鼠血清相关指标的影响
骨质疏松可能会对大鼠血清中与骨转换相关的一系列生化指标产生影响,为呈现DBCP作用效果,对各组大鼠的血清相关生化指标进行了检测分析。
2.2.1 DBCP对大鼠碱性磷酸酶(Alkaline phosphatase,ALP)活力的影响 ALP是衡量成骨细胞活性的重要指标,具体的DBCP对大鼠ALP活性的影响见图7。结果显示:与假手术组相比,阴性对照组大鼠的ALP酶活力呈现极显著提升(P<0.01),添加受试样品后,<1 kDa、1~3 kDa、>3 kDa三个分子量的DBCP高剂量组与阴性对照组相比,均呈现极显著性降低(P<0.01),与假手术组的ALP活性处于同一水平。此研究结果与Zhang等[18]的研究结论相一致,主要原因为去卵巢后雌激素减少,使得骨吸收亢进,出现代偿性骨形成增加,而饲喂DBCP干预后,代偿性反应减弱,抑制了破骨细胞活性,抑制了骨吸收,从而使得ALP活性降低。

图7 DBCP对大鼠ALP酶活力的影响Fig.7 Effect of DBCP on ALP activity in rats
2.2.2 DBCP对大鼠肿瘤坏死因子(Tumor necrosis factor,TNF-α)的影响 TNF-α能够刺激破骨细胞的形成,反应骨吸收状况。图8显示了DBCP对大鼠TNF-α活性的影响。与假手术组相比,阴性对照组大鼠的TNF-α酶活力呈现极显著提高(P<0.01),说明去卵巢后骨吸收功能增强,骨形成增加,骨代谢处于高转换的状态,这也反映出去卵巢手术能够诱导高骨转换型骨质疏松症的形成。添加受试样品后,<1、1~3、>3 kDa三个分子量的DBCP高剂量组与阴性对照组均有显著性差异(P<0.05),证明三种分子量的高剂量DBCP均能够抑制去卵巢后代谢失衡对于骨吸收和骨形成的提高作用,缓解去卵巢后的高骨转换症状和骨质疏松症状。此结果与DBCP对大鼠ALP活力的影响相呼应。
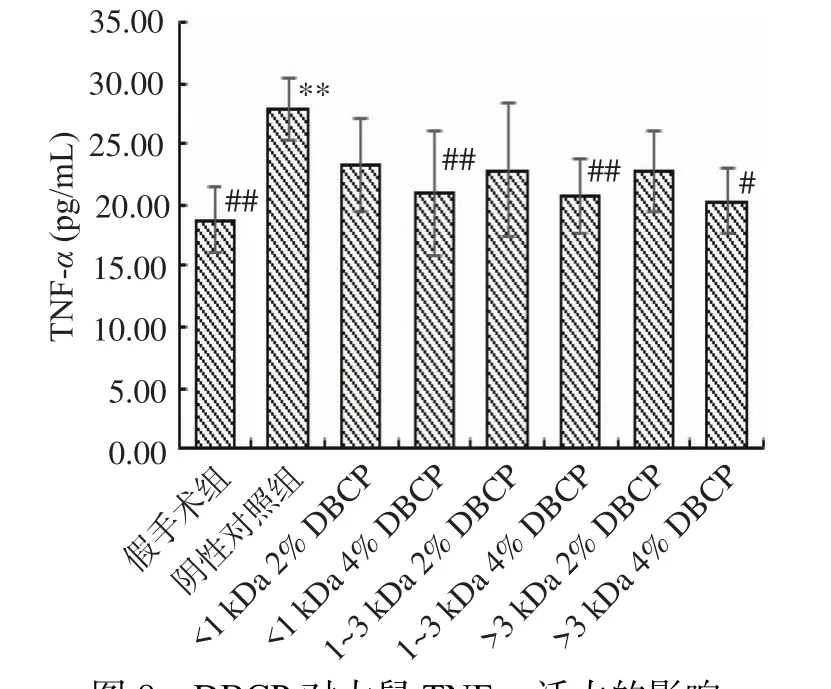
图8 DBCP对大鼠TNF-α活力的影响Fig.8 Effect of DBCP on TNF-α activity in rats
2.2.3 DBCP对大鼠雌二醇(Estradiol,E2)含量的影响 相关研究表明[19],雌二醇(E2)水平的降低,会造成骨转换平衡的打破,最终使骨钙代谢成为负平衡,骨量减少。在本研究中,分别检测了各组大鼠的E2含量变化,如图9所示。与阴性对照组相比,虽然各受试样品组E2均有不同程度的提高,但经统计学分析,均无显著性差异(P>0.05),这表明DBCP对骨质疏松大鼠E2单一指标的作用不明显。
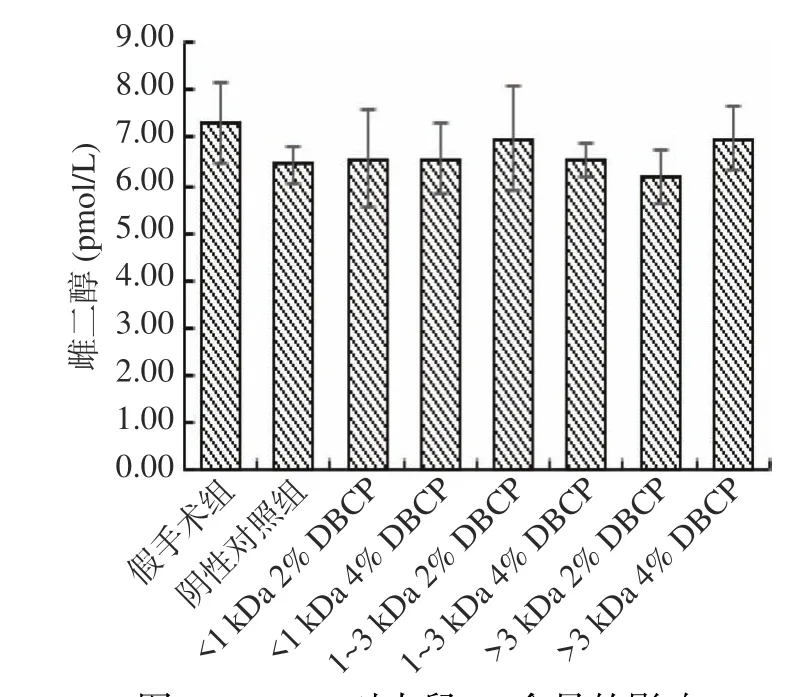
图9 DBCP对大鼠E2含量的影响Fig.9 Effect of DBCP on E2 Content in rats
2.2.4 DBCP对大鼠血钙、血磷含量的影响 血钙和血磷是与骨矿化有关的指标。如图10所示,与假手术组相比,阴性对照组大鼠的血钙和血磷含量均呈现显著性降低(P<0.05);而与阴性对照组相比,<1 kDa DBCP和1~3 kDa DBCP组的血钙和血磷含量则均呈现出显著性升高(P<0.05)。这表明:<1 kDa DBCP和1-3 kDa DBCP对于骨质疏松大鼠有较好的提高其体内钙、磷水平,促进钙、磷沉积,增强体内成骨细胞增殖的作用,此研究结果与Liu等[11]的研究相一致。
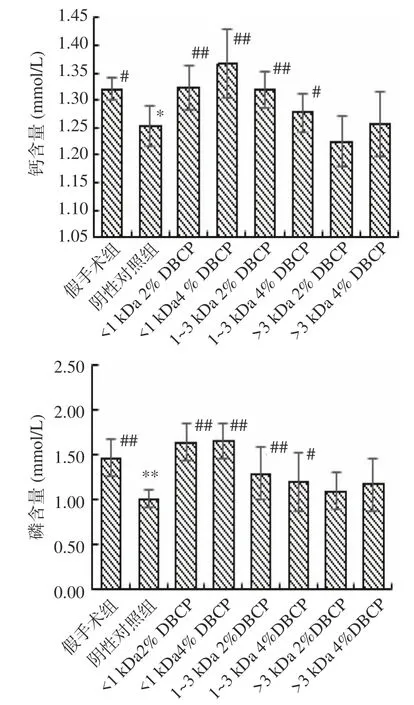
图10 DBCP对大鼠血钙和血磷含量的影响Fig.10 Effects of DBCP on blood calcium and phosphorus content in rats
2.3 DBCP对骨质疏松大鼠骨指标的影响
2.3.1 DBCP对大鼠骨组织形态学的影响 图11反映了各组大鼠胫骨的组织形态学变化,可以看出假手术组大鼠胫骨骨小梁是完整的网状结构,且结构较为紧密。而摘除卵巢后的阴性对照组大鼠的骨小梁数目明显减少,且网状结构不完整,骨小梁间的空隙也明显变大,另外胫骨部分区域还出现了骨质断裂的现象,这是骨质疏松的典型病变。而在饲喂DBCP的各组大鼠中,与阴性对照组相比,其结构得到了一定的恢复,骨连接状态有所好转,间隙更小,无骨质断裂等状况,说明DBCP对改善骨质疏松症状具有一定的作用。
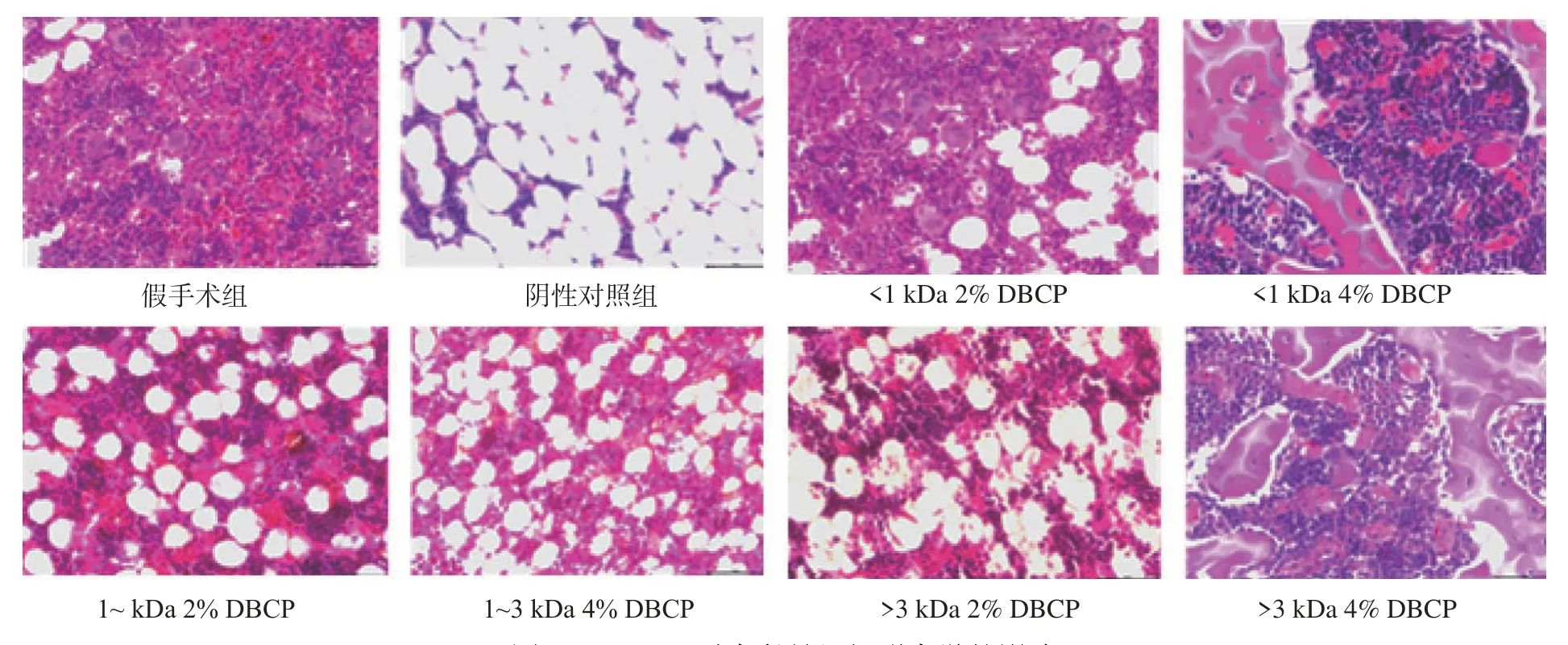
图11 DBCP对大鼠骨组织形态学的影响Fig.11 Effects of DBCP on bone histomorphology in rats
2.3.2 DBCP对大鼠骨密度(Bone mineral density,BMD)的影响 BMD是骨质疏松症的重点考察指标[20-21],为使BMD数据更具代表性,分别对各组大鼠的总股骨、股骨前端、股骨骨干及骨骺端4个部位进行了BMD数据测定,具体结果见表3。可以看出,与阴性对照组相比,除>3 kDa 2% DBCP组外,其余各样品组的BMD均显著性升高(P<0.05),其中<1 kDa DBCP和1~3 kDa DBCP的两个剂量组BMD与假手术组间已无显著性差异(P>0.01),即<1 kDa DBCP和1~3 kDa DBCP可使去卵巢大鼠BMD恢复至未去除卵巢水平,即能有效的缓解骨质疏松症状。而>3 kDa 2% DBCP作用效果不明显可能与肽纯度及分子量相对较大有关,影响到了肽的消化吸收效率;而增加剂量至4%时,伴随着剂量的增加,肽的吸收起到了一定的累积,达到了作用效果。
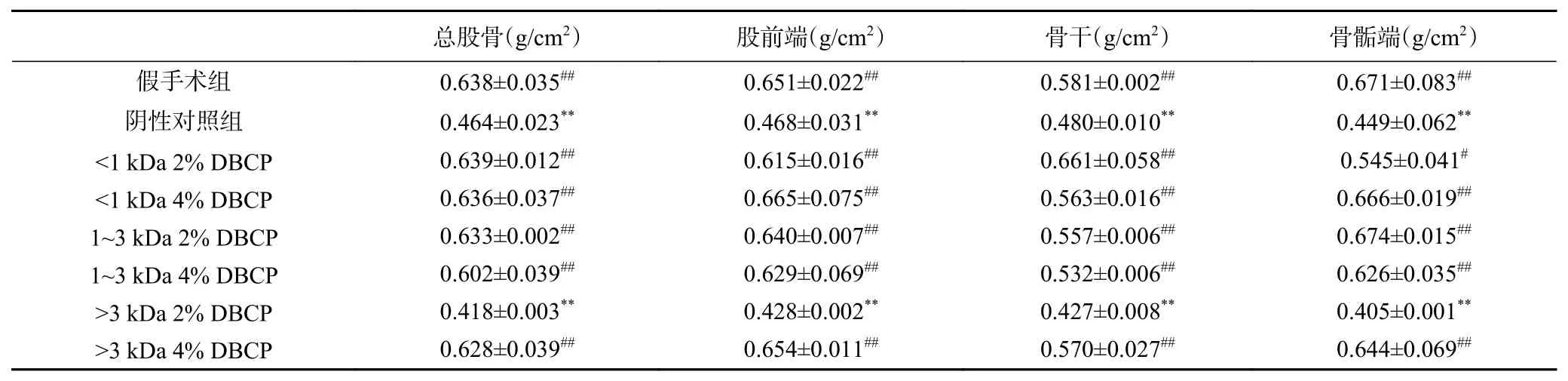
表3 DBCP对大鼠BMD的影响Table 3 Effect of DBCP on BMD in rats
3 结论
本研究以动物体内实验的形式探究了不同分子量的DBCP对骨质疏松大鼠的改善作用。结果表明:各实验组大鼠生长活动良好,肝肾功能等指标均未见异常,表明DBCP作为天然产物无明显副作用;三种分子量(<1 kDa、1~3 kDa、>3 kDa)的高剂量组(4%)DBCP均能够不同程度下调血清中ALP酶活力和TNF-α的含量,即能够抑制去卵巢后由于代谢失衡对于骨吸收和骨形成的提高作用,缓解去卵巢后的高骨转换症状和骨质疏松症状;<1 kDa DBCP和1~3 kDa DBCP对骨质疏松大鼠有较好的提高其体内钙、磷水平的作用,并可使去卵巢大鼠BMD恢复至未切除卵巢水平,即能够有效地缓解骨质疏松症状。
本研究结果的提出,充分论证了驴骨胶原蛋白肽缓解骨质疏松的功效作用,丰富了骨胶原蛋白肽的功效研究成果,并为驴骨胶原蛋白肽类产品的开发及功能宣称提供了理论依据。但同时胶原蛋白肽在推广应用及产品开发方面也面临着一些问题,例如:不同分子量的胶原蛋白肽与功效间的关系、不同来源的胶原蛋白肽的功效研究论证以及法规标准建设不健全等。虽然存在着一些问题,但伴随着肽制备及分离纯化工艺的逐步成熟、新技术研究手段的升级以及相关法规标准的完善,胶原蛋白肽仍具有较广阔的发展空间。

