GSK-3β在大鼠背根神经节神经元细胞内质网应激中的作用机制研究*
傅 文,农小连,刘可鹏,蓝雨雁
(广西医科大学第一附属医院,南宁 530021)
神经病理性疼痛(neuropathic pain,NP)是指由中枢或周围神经系统躯体感觉传导通路的损伤或疾病所导致的疼痛。损伤或疾病痊愈后疼痛仍可持续,常演变为慢性疼痛,表现为异常性疼痛和痛觉过敏[1]。一般人群NP 患病率在6.9%~10.0%[2]。NP 发病率高,但诊断和治疗较为困难,患者除疼痛外常伴有焦虑、抑郁和睡眠障碍,严重影响患者的生活质量[3]。糖原合成酶激酶-3β(GSK-3β)在中枢神经系统中广泛表达,是调节正常大脑结构和功能突触可塑性的关键信号分子,通过其磷酸化位点影响神经元的保护或变性[4],参与神经元发育和神经退行性变相关的神经元凋亡过程[5]。研究表明,NP大鼠背根神经节(dorsal root ganglion,DRG)中发生内质网应激(endoplasmic reticulum stress,ERS),GSK-3β在ERS期间被激活[6-7],而抑制GSK-3β可显著减弱体内和体外的ERS 程度[8-9]。然而,GSK-3β在NP 大鼠DRG 神经元细胞ERS 时通过何种途径参与NP的具体机制目前仍不清楚。本课题组前期体内实验研究发现,通过鞘内注GSK-3β 抑制剂A014418 可以减轻慢性坐骨神经压迫(chronic constrictive injury,CCI)大鼠的机械痛阈值和热痛阈值,减轻ERS相关蛋白BIP和CHOP的表达,对CCI大鼠具有较好的镇痛作用。
本实验通过体外建立衣霉素(TM)诱导的大鼠DRG 神经元细胞ERS 模型模拟NP 大鼠DRG 神经元细胞ERS,并给予A014418,探究GSK-3β 对大鼠DRG 神经元细胞ESR 与凋亡的影响,为寻找新的NP治疗方法提供思路。
1 材料与方法
1.1 细胞和主要试剂 大鼠DRG神经元细胞系购于上海赛百慷生物技术公司。TM购自北京索莱宝科技有限公司。DMEM低糖培养基、10%胎牛血清(FBS)(Gibco 公司,美国);Total RNA 提取试剂、实时荧光定量PCR(qPCR)试剂盒(Takara 公司,日本);PCR 扩增引物(生工生物公司,中国);实时荧光定量PCR 仪(ABI7500,赛默飞公司,美国);GSK-3β抑制剂A014418(MCE公司,美国);兔抗GSK-3β抗体、兔抗磷酸化(p)-GSK-3β 抗体(CST 公司,美国);兔抗GRP78/BIP 抗体、兔抗Bcl-2 抗体、兔抗Bax 抗体、山羊抗兔及山羊抗鼠二抗(Abcam 公司,英国);兔抗鼠Tubμlin抗体(中杉金桥公司,中国);超敏ECL化学发光底物试剂盒(雅酶公司,中国)。
1.2 细胞培养和分组 大鼠DRG 神经元细胞用10%FBS、1%青—链霉素混合液的低糖DEME培养基,在37 ℃、5% CO2培养箱中培养,及时换液、传代。取对数生长期细胞进行实验。将细胞分为4 组:空白对照组(C 组)、TM 组、TM+A014418 组(TM+A 组)和单独A014418 组(A 组)。TM 组和TM+A 组 以2 μg/mL TM作用24 h诱导细胞ERS[10]。TM+A 组和A 组加入10 μmol/L GSK-3β 抑制剂A014418作用24 h。C组细胞不作任何处理。
1.3 CCK-8法检测大鼠DRG神经元细胞活性 收集各组DRG神经元细胞,调整细胞悬液浓度(5×104个/mL),96 孔板中每孔加入100 μL,37 ℃、5%CO2培养24 h后,加入CCK-8溶液10 μL,混匀后继续培养2 h。用酶标仪检测450 nm波长处各孔的吸光度(OD)值,计算细胞存活率。
1.4 实时荧光定量PCR(RT-qPCR)法检测大鼠GSK-3β、Bax、BIP 和Bcl-2 mRNA 表达 提取细胞总RNA,逆转录为cDNA,按照试剂盒说明书,进行PCR扩增,PCR反应条件:95 ℃预变性15 s,95 ℃变性5 s,60 ℃退火、延伸34 s,共40个循环。引物序列如下:GSK-3β 上游:5’-GACAGTGGTGTGGATCAGTTGGTG-3’,下游:5’-GCGATTGCCTCTGGTGGAGTTC-3’;Bax 上游:5’-GACGCATCCACCAAGAAGCTGAG-3’,下游:5’-GCTGCCACACGGAAGAAGACC-3’;Bcl-2 上游:5’-GGGCTACGAGTGGGATACTGGAG-3’,下游:5’-TCGGTTGCTCTCAGGCTGGAAG-3’;BIP 上游:5’-CGGAGGAGGAGGACAAGAAGGAG-3’,下游:5’-ATACGACGGTGTGATGCGGTTG-3’;GAPDH 上游:5’-CCAATGTGTCCGTCGCGTGGATCT-3’,下游:5’-GTTGAAGTCGCAGGAGACAACC-3’。用2-ΔΔCT法计算目的基因相对表达量。
1.5 Western blotting 法检测大鼠GSK-3β、p-GSK-3β、Bax、BIP 和Bcl-2 蛋白表达 取各组DRG 神经元细胞,加入RIPA蛋白裂解液,BCA法检测蛋白浓度;煮沸使蛋白变性,10% SDS-PAGE 电泳分离蛋白,将蛋白转移至PVDF膜,脱脂牛奶封闭1 h;分别加入一抗Tubulin(1∶5 000)、GSK-3β(1∶1 000)、Bax(1∶1 000)、p-GSK-3β(1∶800)、BIP(1∶1 000)、Bcl-2(1∶1 000)4 ℃冰箱中孵育过夜,洗膜;加入山羊抗兔二抗(1∶3 000)室温孵育1 h,洗膜;ECL 发光液反应1 min,扫描图像后使用Image J 软件分析蛋白条带灰度值。
1.6 统计学方法 采用SPSS 16.0统计软件对数据进行统计分析,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 A014418能提高大鼠DRG神经元细胞生存率 A 组与C 组细胞存活率比较,差异无统计学意义(P>0.05);TM 组和TM+A 组细胞存活率较C 组明显降低(均P<0.05),TM+A组细胞存活率明显高于TM组(P<0.05),见表1。
表1 4组大鼠DRG神经元细胞生存率比较%,

表1 4组大鼠DRG神经元细胞生存率比较%,
与C组比较,*P<0.05;与TM组比较,#P<0.05。
2.2 A014418 下调BIP、Bax、GSK-3β mRNA 表达,上调Bcl-2 mRNA 表达 与C 组比较,TM 组BIP、Bax、GSK-3β mRNA 表达上调,Bcl-2 表达下调,Bax/Bcl-2 比值升高(均P<0.05),TM+A 组BIP、Bax mRNA表达上调,GSK-3β、Bcl-2 mRNA表达下调,Bax/Bcl-2 比值升高(均P<0.05),A 组GSK-3β mRNA 表达下调(P<0.05),A 组与C 组Bax、BIP 和Bcl-2 mRNA 表达及Bax/Bcl-2 比值比较,差异均无统计学意义(均P>0.05);与TM 组比较,TM+A 组GSK-3β、Bax、BIP mRNA表达下调,Bcl-2 mRNA表达上调,Bax/Bcl-2比值降低(均P<0.05),见表2。
表2 4组大鼠DRG神经元细胞BIP、Bax、Bcl-2、GSK-3β mRNA表达比较
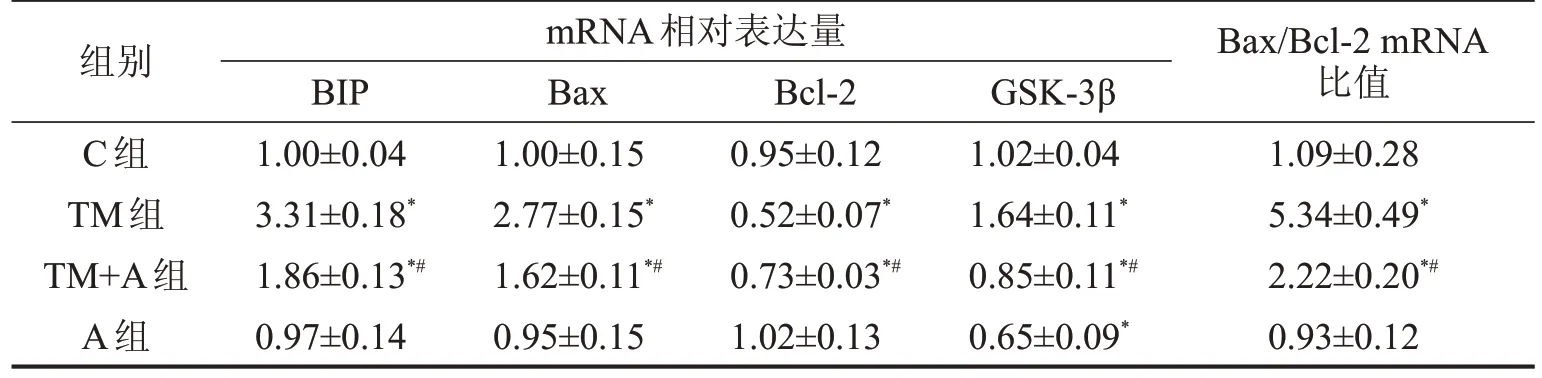
表2 4组大鼠DRG神经元细胞BIP、Bax、Bcl-2、GSK-3β mRNA表达比较
与C组比较,*P<0.05;与TM组比较,#P<0.05。
2.3 A014418下调BIP、Bax蛋白表达,上调p-GSK-3β、Bcl-2 蛋白表达 A 组与C 组BIP、Bax、Bcl-2 和p-GSK-3β 蛋白表达及Bax/Bcl-2 比值、p-GSK-3β/GSK-3β 比值比较,差异均无统计学意义(均P>0.05);与C 组比较,TM 组和TM+A 组Bcl-2 和p-GSK-3β蛋白表达下调,BIP和Bax蛋白表达上调,p-GSK-3β/GSK-3β 的比值降低,Bax/Bcl-2 比值升高(均P<0.05);与TM 组比较,TM+A 组Bcl-2 和p-GSK-3β蛋白表达上调,BIP和Bax蛋白表达下调,p-GSK-3β/GSK-3β 比值升高,Bax/Bcl-2 比值降低(均P<0.05);4 组GSK-3β 蛋白表达量比较,差异无统计学意义(均P>0.05),见图1。

图1 4组DRG神经元细胞GSK-3β、BIP、Bcl-2、Bax及p-GSK-3β蛋白表达比较
3 讨论
内质网是真核细胞中最重要的细胞器之一,主要参与维持胞内钙稳态以及新生蛋白多肽(膜蛋白、分泌型蛋白)的折叠修饰、并保证新生蛋白多肽折叠的正确、顺利进行。多种病理条件,如缺血、缺氧、钙代谢紊乱以及一些有害因素如损伤、细菌感染、中毒等刺激下,诱导细胞发生以伴侣蛋白表达及非折叠蛋白反应启动为特征的ERS[11]。如果应激反应过强或持续存在,细胞损伤严重,内环境无法及时恢复稳态时,则会引起蛋白错误折叠,进而引起一系列疾病,如NP。
本课题组前期实验以及研究报道均证实ERS参与了NP 的发病过程[12-14],NP 状态下,ERS 相关蛋白BIP 和CHOP 表达显著升高,在电子显微镜下可观察到CCI大鼠DRG组织细胞结构明显改变,粗面内质网表面颗粒脱落、肿胀,线粒体脊消失,线粒体空泡化;而在坐骨神经周围局部浸润GSK-3β 抑制剂后,DRG组织细胞结构只有少数内质网和线粒体轻度肿胀[15-16],提示CCI大鼠DRG组织发生ERS,并可能存在线粒体功能障碍。有研究表明,TM 通过N-糖基化作用,可影响内质网内蛋白质的合成和修饰,导致异常蛋白质积累诱发ERS[17-18]。本课题组前期研究发现,采用TM 浓度为2 μg/mL,作用24 h为条件构建诱导大鼠DRG 神经元细胞ERS 模型较为合适。在此条件下,体外建立TM 诱导的大鼠DRG神经元细胞ERS模型中,检测到ERS相关基因BIP、Bax mRNA和蛋白表达显著上调,Bcl-2 mRNA和蛋白表达显著下调,因此本实验模型的建立是成功的。此外,通过CCK-8 检测细胞活性发现TM 诱导ERS使细胞存活率显著降低,提示ERS可能促进大鼠DRG神经元细胞凋亡。
GSK-3β是一种在进化上非常保守的丝氨酸/苏氨酸激酶,参与调节众多蛋白质的磷酸化。在ER应激中,BIP 通过促进GSK-3β 与tau 的结合,在GSK-3β 依赖性tau 过度磷酸化中起着重要作用[19]。A014418 作为一种ATP 竞争性的GSK-3β 抑制剂,抑制GSK-3β特异性位点(Ser-396)的tau磷酸化,具有抗细胞凋亡效果[20],且本身不影响神经元细胞活力[21],因此,本研究选择A014418 作为GSK-3β 抑制剂。A014418 处理TM 组细胞后,p-GSK-3β(Ser9)表达上调,证明了A014418 对GSK-3β 活性的抑制作用。Bax、Bcl-2 蛋白是影响细胞凋亡的重要分子[22],两者比值是调控细胞凋亡的关键因素[23]。本研究中,A014418 使TM 诱导ERS 大鼠DRG 神经元细胞的ERS 相关分子伴侣BIP mRNA 表达显著下调,细胞凋亡相关Bax mRNA 与蛋白表达显著下调,Bcl-2 mRNA与蛋白表达显著上调,Bax/Bcl-2比值降低,细胞存活率显著升高,而单独应用A014418对未发生ERS 大鼠DRG 神经元细胞的生存状态则无明显影响,验证了A014418 的抗凋亡效果。这些结果提示,抑制GSK-3β 磷酸化,能减轻TM 诱导大鼠DRG神经元细胞的ERS,减少细胞凋亡。值得注意的是,经多次重复实验,本研究发现各组GSK-3β mRNA 表达有差异,而蛋白表达却无差异,这可能与转录后,蛋白未能完成完整的翻译、折叠、修饰等过程,从而影响其抗原性有关。同时,在ESR时,被激活的GSK-3β 通过何种途径对大鼠DRG 神经元细胞ERS产生影响,并导致细胞凋亡。这些问题仍需进一步的实验研究论证。
综上所述,抑制GSK-3β磷酸化可减轻TM诱导的大鼠DRG 神经元细胞ERS,减少细胞凋亡。GSK-3β有望成为治疗NP的一个新靶点。
- 广西医科大学学报的其它文章
- Effects of miR-203 targeting ΔNp63 on proliferation,invasion,apoptosis and stem-cell characteristics of squamous cell carcinoma cells
- 2021年诺贝尔生理学或医学奖揭晓!
- 血清外泌体对乳腺癌细胞生物学行为的影响*
- 干扰lncRNA SBF2-AS1通过靶向调控miR-582-5p表达抑制乳腺癌MCF-7细胞的增殖、迁移和侵袭*
- 舒芬太尼对人口腔鳞癌细胞系CAL27生长、侵袭和干细胞样特性的影响及线粒体凋亡通路的调节*
- 树鼩自发性乳腺癌的代谢组学分析*

