基于网络药理学研究雷公藤抗肝癌的分子机制及初步验证
刘 澍 卢建东 吕祎彤 喻长远* 熊国良*
(1.深圳市中医院, 深圳 518005; 2.北京化工大学 生命科学与技术学院, 北京 100029)
引 言
肝癌是最常见的肝脏恶性肿瘤,致其发生的主要因素包括慢性病毒性肝炎、肝硬化、脂肪性肝病等[1]。近年来,肝癌的发病率和死亡率逐年上升,已经成为威胁人类健康和妨碍社会发展的主要疾病之一,因此肝癌的预防与治疗成为人们研究的热点。对于肝癌的有效治疗方案主要包括手术、化疗等手段,索拉非尼和瑞格拉非尼是美国食品药品监督管理局(FDA)批准的治疗肝癌晚期的药物,尽管这类化学药物提高了癌症的治愈率,但它们具有较大的毒副作用及耐药性[2]。因此,探索与开发新的肝癌治疗药物是很有必要的。
癌症的早期发生和发展与多数的炎症反应密切相关,细胞的凋亡代谢又受自身免疫性疾病等多种疾病的影响。中药具有多靶点、不易产生耐药性等特点,可通过多途径抑制肝癌细胞的生长、增殖,因此日益受到人们的关注。雷公藤(TripterygiumwilfordiiHook F.)作为一种传统中药,用于治疗免疫系统疾病及炎性疾病已有数百年的历史。研究表明,雷公藤可用于胃癌、肝癌、乳腺癌、前列腺癌等多种癌症的治疗[3],雷公藤的提取物(如雷公藤甲素和雷公藤红素)可通过促进肝癌细胞的凋亡和诱导分化而发挥抗肝癌疗效[4]。
在雷公藤有效成分的抗癌机制研究中,Sun等[5]发现雷公藤甲素可以激活抑癌基因P53,诱导肝癌细胞凋亡。Li等[6]发现雷公藤红素可以通过激活线粒体凋亡途径,诱导肝癌Bel-7402细胞的凋亡。张乙川等[7]发现雷公藤红素通过激活caspase-3及抑制NF-κB通路来诱导人肝癌SMMC-7721细胞的凋亡。目前,对雷公藤抗肝癌机制的研究大多局限于单一成分的分析,尚未全面系统地阐述雷公藤的药效机制和作用靶点。本文运用网络分析方法,借助中药系统药理学数据库与分析平台(TCMSP)并结合多个疾病数据库,分析现有的相关信息资料(包括药物、疾病、基因组、蛋白组等相关数据库),多层次地建立“药物-靶点”网络以及蛋白互作网络(PPI),利用计算机解析软件全面展示药物与靶点、靶点与疾病之间的关系,从网络层面研究雷公藤对肝癌的干预和影响,揭示雷公藤治疗肝癌的分子作用机制,为肝癌的进一步治疗研究提供有力的理论依据。
1 网络分析
1.1 雷公藤药效成分数据库的构建
从TCMSP平台(http://www.tcmspw.com/tcmsp.php)中获取雷公藤的活性成分药理信息[8],以药代动力学(ADME)参数中的口服生物利用度(OB)≥30%和药物相似性(DL)≥0.18作为筛选条件,确定雷公藤在人体内生物活性较高的关键成分。同时结合文献收集雷公藤的药效成分信息,对其进行补充。
利用PubChem化学结构数据库(https://pubchem.ncbi.nl-m.nih.gov/)确认上述所得化合物的分子结构,将这些化合物转化为标准的Canonical SMILES格式,以 sdf格式储存。
1.2 雷公藤关键成分抗癌差异靶点的筛选
在TCMSP平台的Targets Information中搜集获取已确定药物成分的靶点蛋白。使用Swiss Target Prediction平台进行化合物靶点预测,补充上述药物的靶点信息,属性设置为“homo sapiens”,其余参数设置均为默认。
利用GeneCards、OMIM、Drugbank等数据库以“liver cancer”、“hepatocellular carcinoma”为关键词检索,收集人类肝癌的疾病基因。从GEO数据库中挑选数据集GSE33006,以此为肝细胞癌(HCC)组织样本和相邻的正常肝组织的基因表达特征数据,以GEO2R工具对此样本进行差异性表达分析,使用Rstudio 3.6.2软件以|log2FC|>1(FC为倍数变化)及P<0.05为筛选条件作火山图,获得肝癌差异基因。
1.3 基因标准化和比对
通过Uniprot数据库(http://www.Uniprot.org/)下载“homo sapiens”的所有基因数据,整理所得靶点蛋白和基因信息并对其进行标准化校正。将TCMSP中的靶点蛋白信息与Swiss Target Prediction的预测结果和主要成分信息进行去重校对,剔除无靶点的活性成分,完善雷公藤的药效成分数据库。将雷公藤药物靶点与挖掘到的肝癌相关基因进行映射筛选,确定雷公藤中关键成分的抗癌作用靶点。
1.4 药效成分- 靶点(C- T)网络构建
通过Cytoscape 3.7.2软件建立雷公藤药效成分-肝癌靶点网络,并使用network analyzer插件对该网络进行拓扑学特征分析。网络中的节点代表成分、靶点,节点的度值(degree value)越大,靶点的生物学重要性的权重越大,说明该节点越重要,越有可能是雷公藤作用的关键靶点,因此我们对度值较大的活性成分重点关注。
1.5 蛋白互作网络构建
为了更好地分析雷公藤抗肝癌靶点间的相互作用,将雷公藤抗癌靶点导入STRING数据库,利用Multiple proteins模块工具进行蛋白质-蛋白质相互作用分析,参数“organism” 设置为“homo sapiens”, 参数“minimum required interaction score”设置为“medium confidence(0.400)”,参数“network display options”设置为“hide disconnected nodes in the network”,其余参数设置均为系统默认。以此建立蛋白互作网络,并将结果存为TSV格式文件。导入Cytoscape 3.7.2软件,去除游离蛋白,进行可视化拓扑分析。
1.6 生物过程和代谢通路富集分析
为了进一步了解核心靶点的功能及在信号通路中的作用,将筛选的抗癌靶点导入DAVID数据库(https://david.ncifcrf.gov/),将所有靶基因ID类型校正为官方名称,输入靶基因名称列表,限定物种为“homo sapiens”,设定人类全基因组为背景参照,经DAVID数据库的检索和转化操作,获得gene ontology(GO)生物学过程富集分析和Kyoto encyclopedia of genes and genomes(KEGG)信号通路富集分析,然后使用Rstudio 3.6.2软件包对结果进行可视化加工。
1.7 分子对接模拟验证
选取重要的药效成分和关键靶点进行分子对接验证。通过PDB数据库搜索蛋白靶点来选择最佳的晶体结构,导入Pymol软件进行去水、除杂,保存为pdb格式文件。使用AutoDock 4.2软件进行对接,使用药物配体与蛋白受体的pdbqt格式文件,进行加氢,计算电荷,设置原子类型[9]。选定受体结构确定中心进行画盒,设置构象搜索方法等对接参数进行分子对接计算。
蛋白结构根据以下条件进行筛选[10-11]:1)物种选择“homo sapiens”;2)试验方法中选择通过X晶体衍射法获取的蛋白结构;3)蛋白的晶体分辨率选择2.0~3.0 Å,因为使用分辨率过低的晶体结构可能使对接结果不理想;4)优先选择已有文献报道的蛋白结构。
2 实验验证
2.1 实验材料
肝癌HepG2细胞,康源博创生物科技(北京)有限公司;雷公藤甲素(纯度≥98%)、雷公藤红素(纯度≥98%),上海源叶生物科技有限公司;DMEM培养基、磷酸盐缓冲液(PBS)、胰酶,SolarBio公司;RIPA裂解液,Thermo Scientific公司;凝胶快速制备试剂盒、STAT3、PTGS2抗体,CST公司;内参GAPDH、辣根过氧化物酶标记的山羊抗兔IgG二抗,Beyotime公司。
2.2 细胞培养
使用DMEM培养基,将HepG2细胞置于37 ℃、5% CO2培养箱(311型,Thermo Fisher公司)中贴壁培养,待细胞铺满培养皿底部80%左右,使用PBS洗涤,用0.25%胰酶消化传代。
2.3 Western Blot测定蛋白表达
取对数生长期的HepG2细胞,分于6孔板中,将0.5、1、1.5 μmol/L的雷公藤甲素或雷公藤红素处理的细胞孔设为实验组,未添加药物处理的细胞孔设为对照组,置于培养箱中孵育24 h,PBS清洗,收取细胞。使用RIPA裂解液裂解细胞,收集总蛋白。使用蛋白核酸电泳仪(EPS 600型,上海天能科技有限公司),以每孔100 μL的上样量进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),于120 V恒压1.5 h,将蛋白转移至聚偏二氟乙烯(PVDF)膜上,于350 mA恒流1.5 h,用8%脱脂奶粉孵育内参GAPDH和一抗(PTGS2、STAT3),4 ℃过夜。次日清洗膜,与辣根过氧化物酶标记的二抗孵育1 h,再次洗涤后,置于化学发光成像仪(ChemiScope-6000-Rro型,上海勤翔科学仪器有限公司)下观察并拍照。
3 结果与讨论
3.1 雷公藤药效成分的筛选结果
从TCMSP平台中筛选得到144种雷公藤有效成分,根据ADME参数对其进行评估、删选,最终筛选出51种,另外根据Targets Information结果删掉无蛋白靶点的成分。检索雷公藤成分的相关文献进行补充、排除,同时考虑到雷公藤红素是雷公藤抗炎和抑制免疫的非常重要的有效成分,故本文将其也纳入雷公藤的有效成分化合物库中,最终确定了雷公藤的31个药效成分,如表1所示。
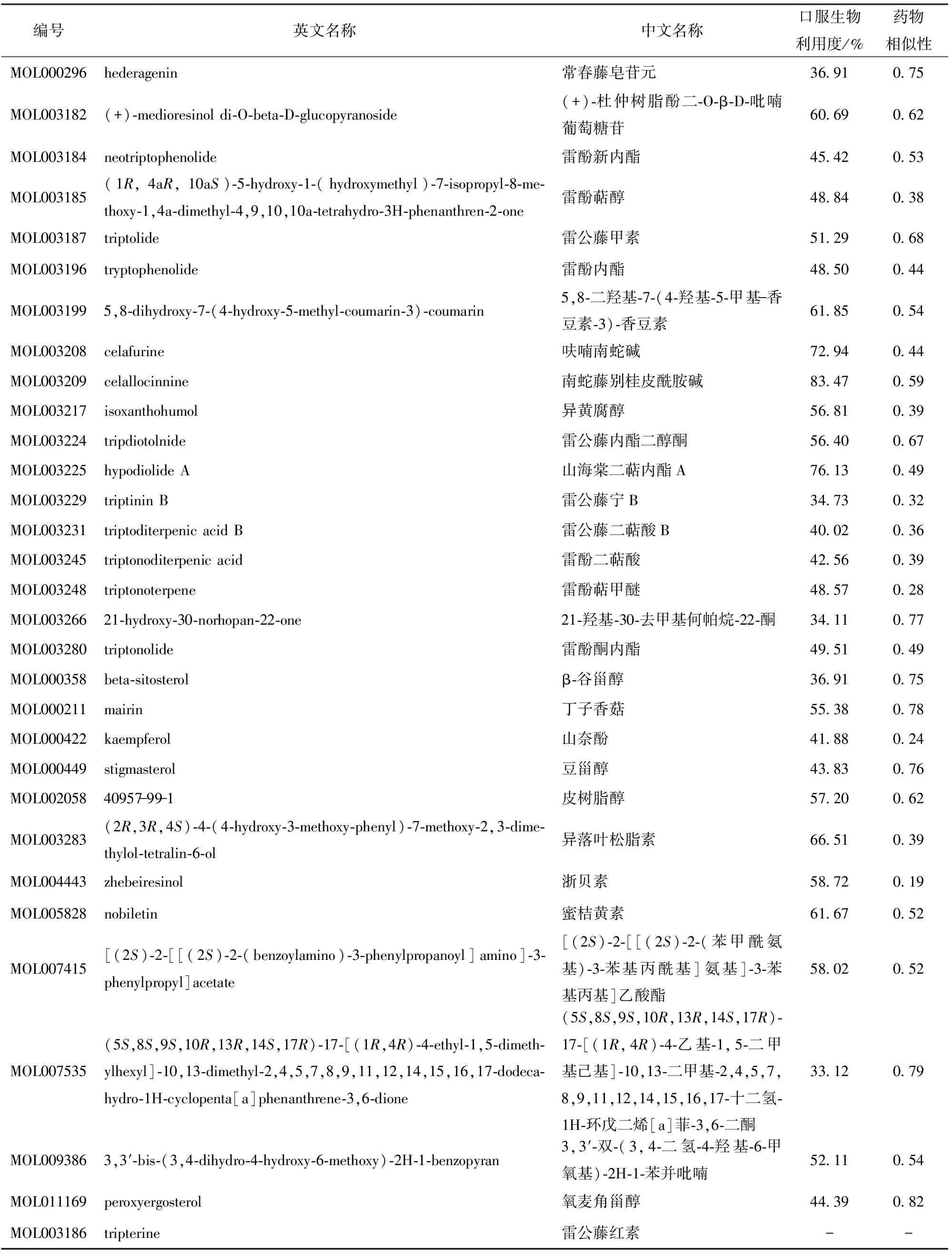
表1 筛选出的雷公藤药效成分Table 1 Screened effective ingredients of Tripterygium wilfordii
3.2 雷公藤主要成分抗癌靶点的筛选结果
根据Swiss Target Prediction平台预测药物靶点,筛选得到68个Probability>0.5的靶点,与TCMSP平台的164个基因蛋白互补,确定208个药物靶点蛋白。对照UniProt数据库将其靶蛋白标准化,并与GeneCards、OMIM、Drugbank数据库所得的人类肝癌相关基因通过Venn图进行比对剔除,结果如图1所示,其中蓝色与其他颜色的交集部分即为筛选确定的80种雷公藤抗肝癌靶点。
对GSE33006肝癌样本数据集的差异基因作火山图,如图2所示。取|log2FC|>1、P<0.05的结果,与上一步数据结果进行交集映射,得到具有上下调属性的抗癌基因31个。
3.3 C- T网络构建分析
根据3.2节的数据筛选结果,我们创建了雷公藤的药效成分与对应靶点的网络映射,如图3所示。该复合网络包含55个节点和393条边,节点包含31个雷公藤抗肝癌靶点和24个化合物,边表示它们彼此之间的联系。按度值由大到小筛选,确定核心成分为山奈酚、雷公藤甲素、β-谷甾醇、雷公藤红素。从对应靶标基因的数量来看,这几种成分可能是治疗肝癌的重要化合物。另外,从蛋白靶点的角度来看,我们选择度值大于2倍中位数的结果,其分别是PTGS2、ESR1、AR、NOS3、JUN、PRKACA、TGFB1。在网络的拓扑分析结果中,我们认为上述靶点占据相当重要的位置。
3.4 PPI分析
图4(a)为蛋白靶点相互作用网络图,将图4(a)导入Cytoscape 3.7.2统计软件进行拓扑学分析并进行可视化处理,结果如图4(b)所示。根据Network Analyzer插件对网络的拓扑学分析发现,结果中共获得31个节点和176条边,平均节点度值为11.4,聚类相关性系数(clustering coefficient)为0.689,相邻节点的平均数目为11.733,说明基因彼此之间存在相互作用,它们协同起效,关系十分密切,验证了雷公藤中的药效化合物与肝癌疾病两者的重叠基因具有密切的关联性。我们以度值大于2倍平均度值为标准筛选核心靶标蛋白,可以看出JUN、STAT3、PTGS2、ESR1、FOS、CXCL8、ICAM1、CDKN1A、AR、TGFB1在其中的作用程度较大,因此,我们认为有必要进一步探讨此类基因的分子功能和通路富集情况。
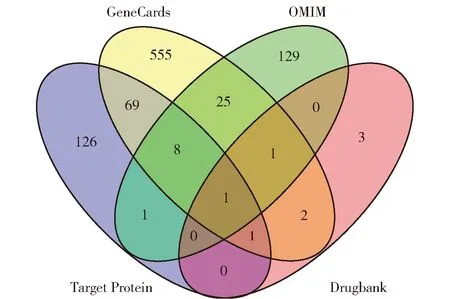
蓝色表示已确定的药物蛋白靶点,黄色、绿色、粉色分别表示GeneCards、OMIM、Drugbank数据库中的肝癌靶点,数字表示交集数据库所共有的蛋白靶点数量。图1 雷公藤的抗癌靶点Fig.1 Anti-cancer targets of Tripterygium wilfordii
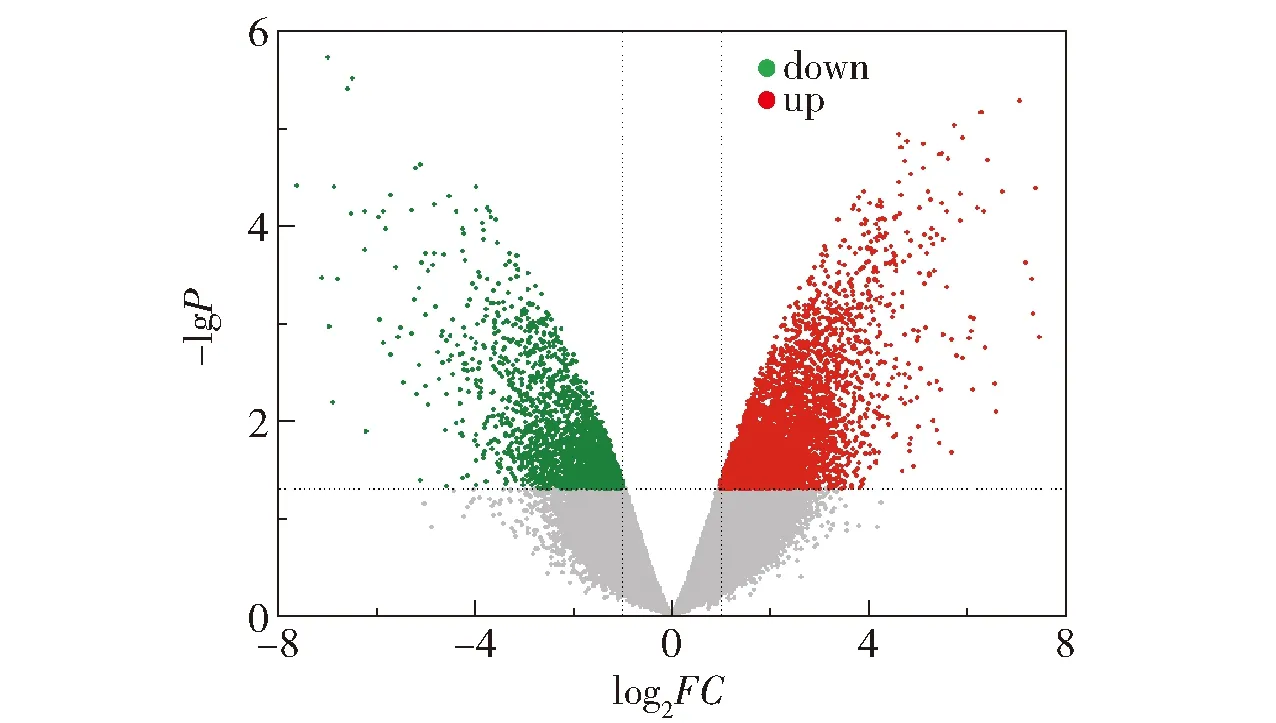
图2 GSE33006样本的火山图Fig.2 Volcano plot for sample GSE33006
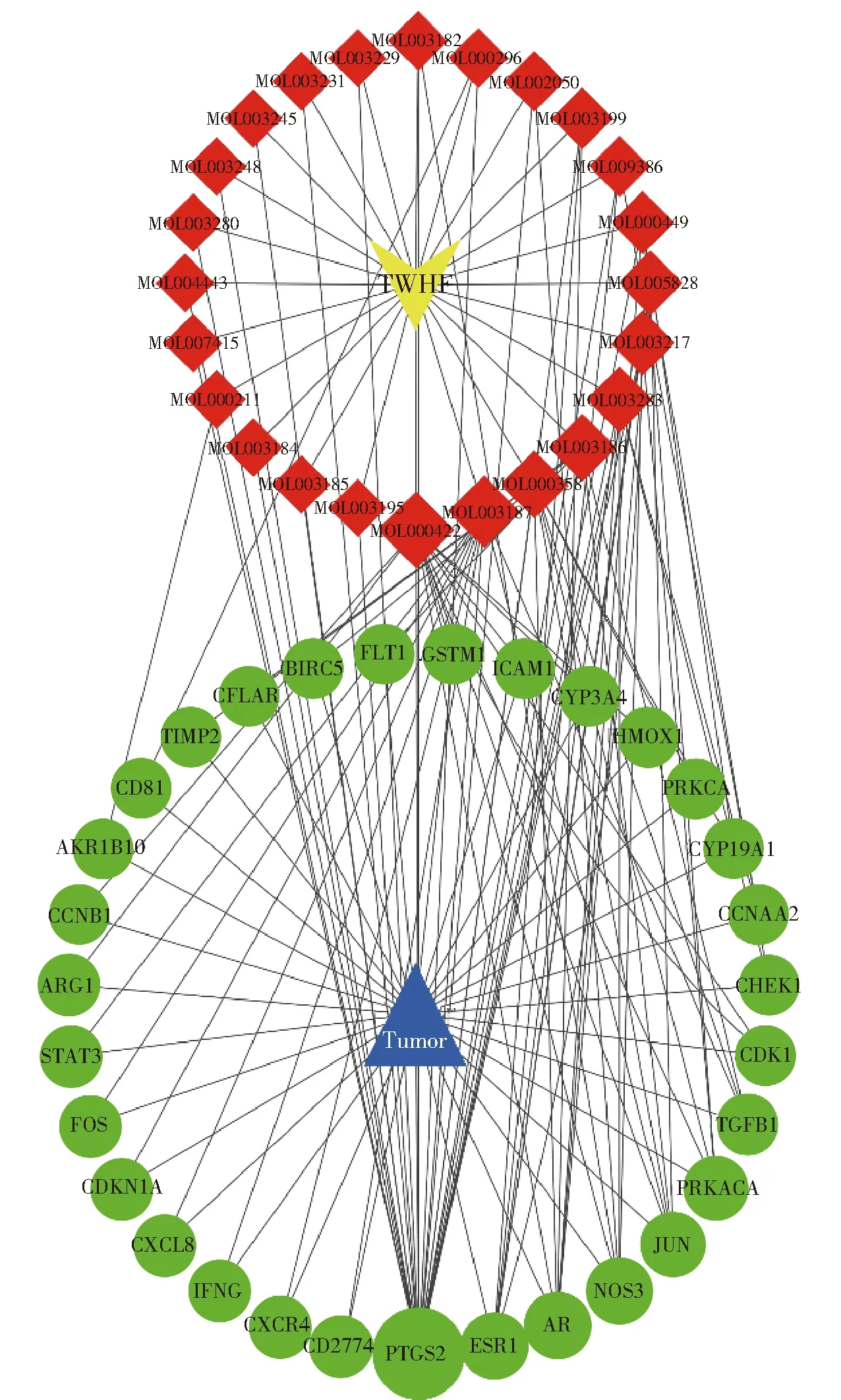
红色菱形表示药效成分;绿色圆形表示蛋白靶点,其大小代表重要程度。图3 雷公藤(TWHF)药效成分与肝癌靶点的C-T网络映射Fig.3 C-T network mapping of the active ingredients of Tripterygium wilfordii (TWHF) and liver cancer targets
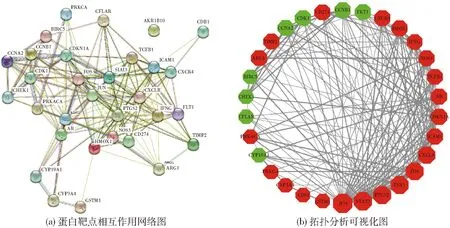
图4 蛋白互作网络分析Fig.4 Protein interaction network analysis
3.5 代谢通路富集结果分析
进一步对靶点在生物功能中的富集关系进行分析,以获得靶点在生物集群中的协同作用。我们对靶点进行了GO富集分类和分子注释,同时也获得Pathway分析,将P<0.05的结果由小到大排序,取排名前20位的结果,如图5所示,其中,气泡大小代表基因数目的多少,气泡颜色由红色至绿色表示P值由小到大。从富集结果可以看出,靶点基因主要富集在催化酶结合、血红素结合、转录激活因子结合、配体激活的序列特异性DNA结合、转录调控区DNA结合、细胞周期蛋白结合、氧化还原酶活性、蛋白质异二聚活性等分子功能上,这些基因主要参与细胞增殖的正负调控、有丝分裂细胞周期的阳性调控、血管生成的负调控、细胞的氧化应激以及基因表达的负调控等生物过程,体现出雷公藤是通过多种分子功能调控生物过程而共同实现抗肝癌效果的。图6列出了排名前20位的信号通路,包括HIF-1、TNF以及调控细胞周期、乙型肝炎等信号通路,说明雷公藤通过靶向基因对多条通路产生影响而发挥抗肝癌作用。
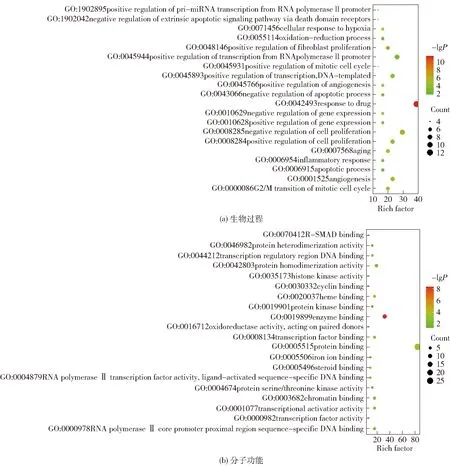
图5 GO富集分析气泡图Fig.5 Bubble diagram of GO enrichment analysis
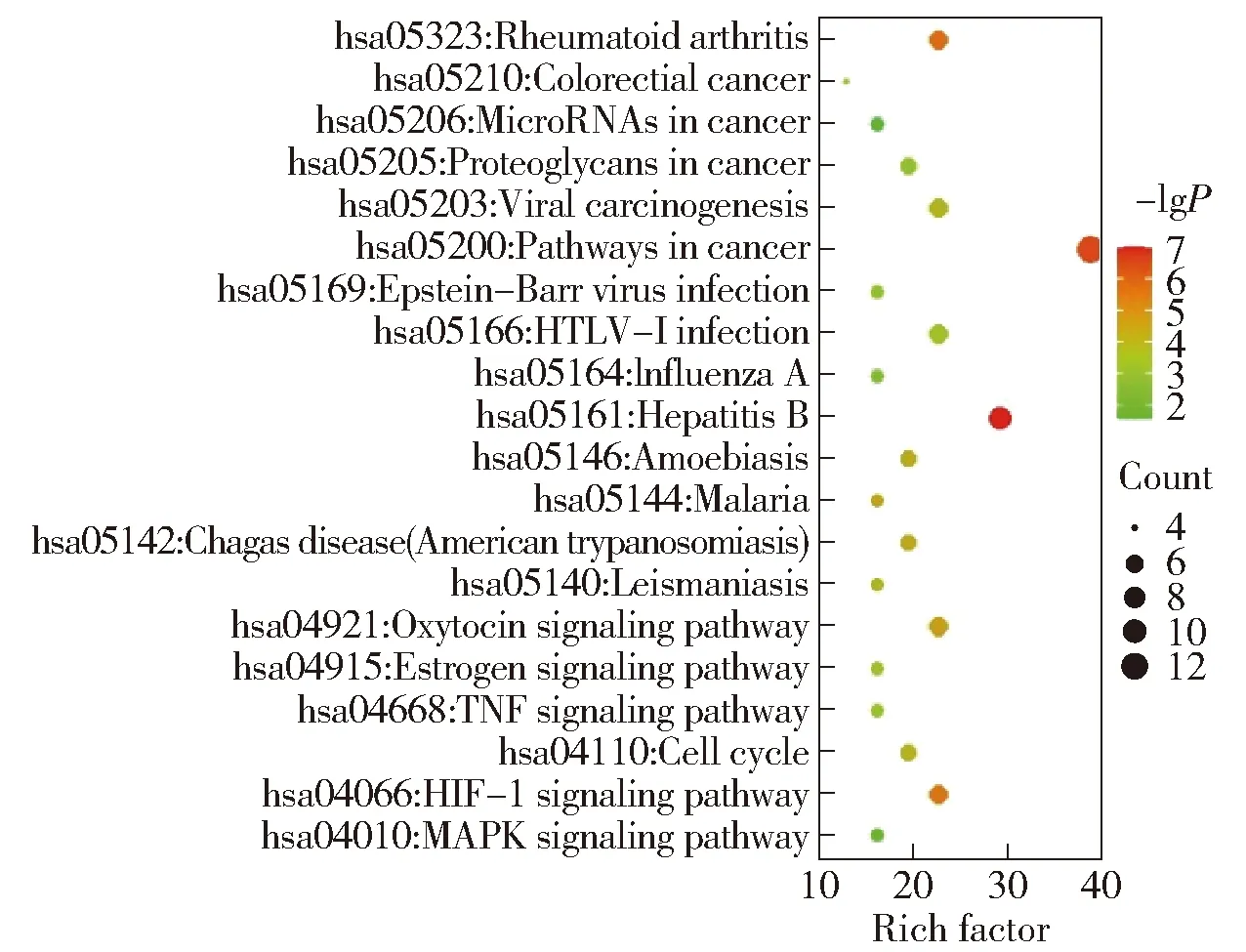
图6 KEGG富集通路分析气泡图Fig.6 Bubble diagram of KEGG enrichment pathway analysis
肝癌的发生、发展过程是一个受多基因、多途径调控的过程,癌细胞的增殖失控和凋亡机制失活,是导致肝癌发展的主要因素[12]。因此,抑制肝癌细胞生长并诱导细胞凋亡是肝癌治疗的主要目标之一。另外也有研究表明,乙型肝炎病毒是肝癌的主要危险因素[13]。这些研究结果与我们的数据分析结果不谋而合,表明本文的工作具有研究价值和借鉴意义。
3.6 分子对接验证分析
综合上述C-T网络和PPI网络中筛选出的靶点集合,选取其中富集排名在前5位的KEGG信号通路上的蛋白,确定了PTGS2、TGFB1、CXCL8、STAT3、CDKN1A、FOS、JUN这7种蛋白为核心靶点。
有研究表明,山奈酚、β-谷甾醇和槲皮素在不同的药物筛选中经常作为活性成分出现[14],因此我们认为它们在本文中没有较大的研究意义。本文最终确定对雷公藤中的特有成分雷公藤甲素和雷公藤红素这两种关键药效物质与核心抗癌靶点进行对接验证。
通常,结合能<-17.78 kJ/mol可认为配体与受体之间具有结合活性,结合能<-20.92 kJ/mol则认为结合活性较高,结合能<-29.29 kJ/mol可认为配体与受体之间具有强烈的对接活性[15]。对接结果如表2所示,由表2可知,雷公藤甲素、雷公藤红素与所选核心靶点的结合能均小于-17.78 kJ/mol,表明它们与靶点具有结合活性。雷公藤甲素与PTGS2以及雷公藤红素与PTGS2、CXCL8、STAT3的结合能均小于-29.29 kJ/mol,表明它们之间有着很强的结合活性。对其进行对接模式分析,如图7所示。由结果可知,雷公藤甲素与PTGS2在CYS-36、CYS-47和ARG-44处形成氢键。雷公藤红素与PTGS2在LYS-532、GLN-372、LYS-369和SER-121处形成氢键,与CXCL8在LYS-11和ARG-26处形成氢键,与STAT3在PRO-333和ARG-325处形成氢键。
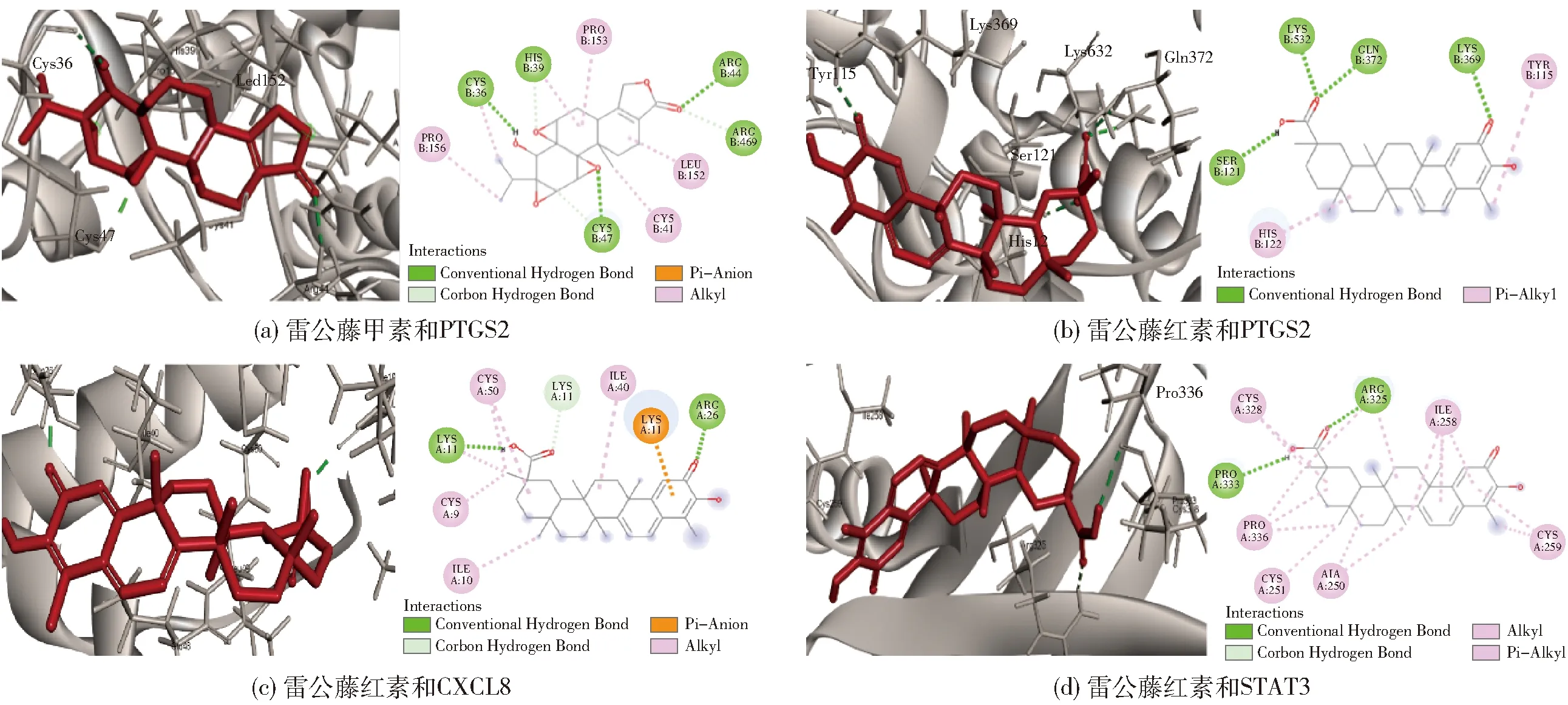
图7 雷公藤甲素、雷公藤红素与核心抗癌靶点的对接模式分析Fig.7 Analysis of the docking mode of triptolide and celastrol with core anti-cancer targets
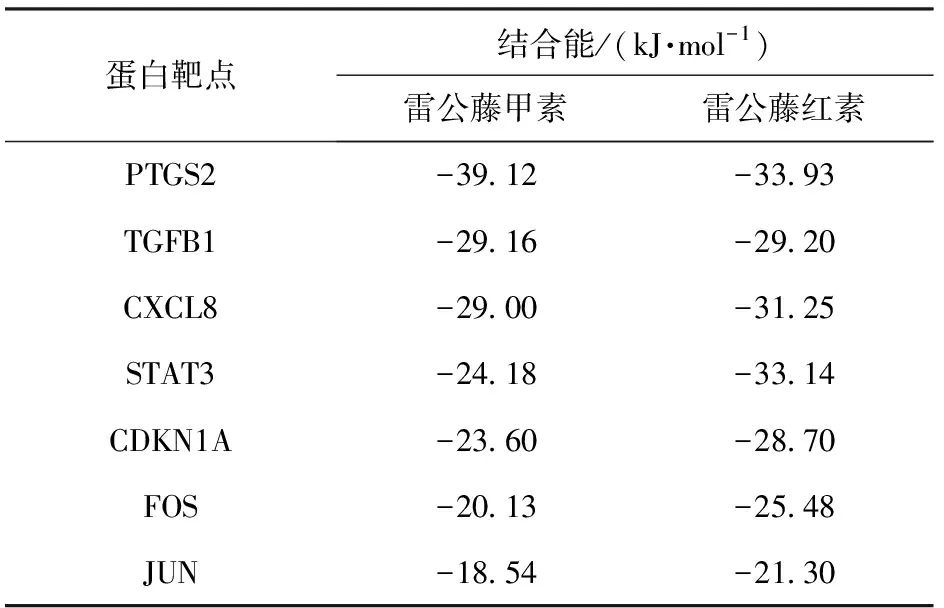
表2 雷公藤甲素、雷公藤红素与核心靶点的结合能Table 2 Binding energies of triptolide and celastrol tothe core targets
3.7 雷公藤对蛋白表达的影响
由于高浓度的雷公藤甲素和雷公藤红素表现出细胞毒性且伴随毒副作用,所以本文选择相对低的药物浓度梯度(0.5、1、1.5 μmol/L),以探究对癌细胞增殖的影响。Western Blot原始条带结果见图8,可以看出,随着雷公藤甲素和雷公藤红素浓度的升高,STAT3和PTGS2蛋白的表达量减少,说明雷公藤甲素和雷公藤红素可以抑制STAT3和PTGS2蛋白的表达,并且抑制作用具有剂量依赖性。
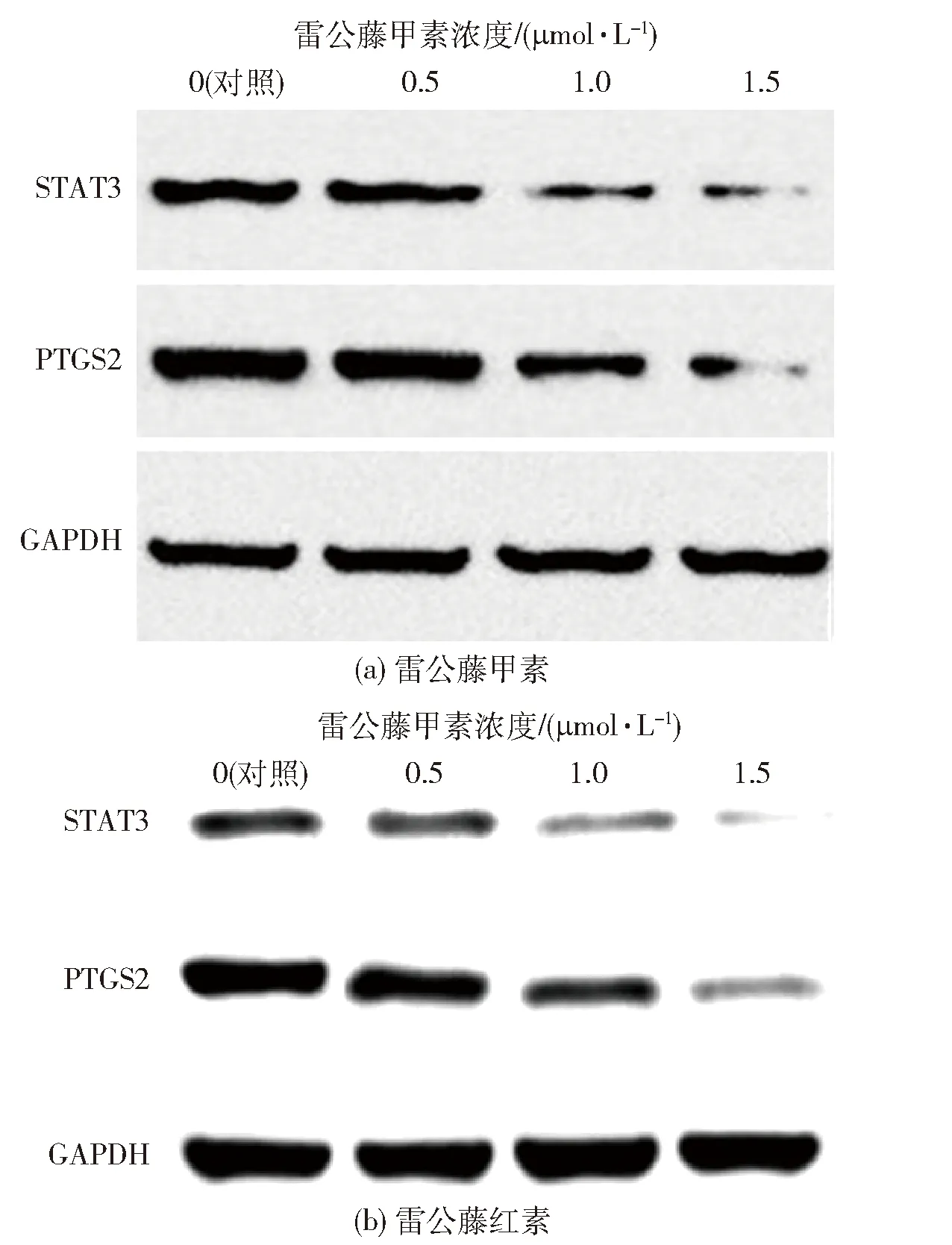
图8 雷公藤甲素和雷公藤红素对蛋白表达的影响Fig.8 Effect of triptolide and celastrol on the expression of various proteins
前列腺素(PG)是由炎症诱导的氧化应激关键酶PTGS2催化合成的重要炎症介质,具有抑制细胞凋亡、促进细胞增殖、抑制免疫监视、促进血管生成等作用,体内外研究均表明PTGS2的特异性抑制剂可以抑制肝癌[16]。STAT3是JAK2/STAT3信号通路的关键调控基因,其在信号通路中的表达与肝细胞癌的发生关系密切[17]。单独或协同其他化疗药物使用的雷公藤红素可促进肝癌细胞的凋亡,防止癌细胞的扩散和侵袭,通过STAT3信号通路[18],抑制下游基因如cyclin D1、Bcl-2、Bcl-xL、survivin、Mcl-1、VEGF等,调节肿瘤细胞的增殖、凋亡,从而抑制血管生成并促使细胞凋亡。
4 结论
本文采用网络药理学方法并结合分子对接模拟,对雷公藤抗肝癌的药效物质及其生物学机制进行探讨。通过对雷公藤成分中的多种化合物数据进行筛选和富集分析,筛选出雷公藤甲素和雷公藤红素为雷公藤抗肝癌的关键药效成分。通过对靶点的功能富集以及配体与受体之间的结合能分析,得出雷公藤作用于肝癌的核心靶点蛋白为STAT3、PTGS2、CXCL8。分子对接的结果显示,雷公藤甲素与PTGS2以及雷公藤红素与PTGS2、CXCL8、STAT3有着很强的结合活性。生物学实验结果表明,雷公藤甲素和雷公藤红素均可以抑制PTGS2和STAT3蛋白的表达。以上结果表明,雷公藤可能作用于这些靶点,通过调控细胞的增殖和凋亡,发挥抗炎症、调节免疫的作用,从而抑制肝癌的恶化。
本研究仅是依靠数据库进行的理论分析和初步的实验验证,故存在一定的局限性,后续还需其他实验(动物实验和临床试验)进一步验证才具有更为科学可靠的说服力。但是,从整体的分析层面上讲,本研究为雷公藤抗肝癌的作用机制及相关药物的开发提供了新思路。

