基于Pitzer热力学模型的高盐废水体系NaCl-Na2SO4-H 2O溶解度预测
叶菊梅,刘 微,李天涯,李 壮,刘焕阳
(1.辽宁石油化工大学 石油天然气工程学院,辽宁 抚顺113001;2.辽宁师范大学 化学化工学院,辽宁 大连116029;3.中国石油天然气股份有限公司辽宁销售仓储分公司设备工程部,辽宁沈阳110000)
高盐废水是指含有机物和至少3.5%(质量分数)的总溶解固体物的废水。作为现代工业大国和农业大国,我国在化工、农药生产、医药生产、食品加工以及矿产开采等行业产生大量的高盐废水。在生产农药双甘膦的过程中,每生产1.0 t双甘膦农药能产生1.0 t废盐;生产1.0 t某种除草剂能产生0.5 t废盐。在化工行业,有些企业采用高温熔融技术无害化处置废盐,处理后废盐中几乎不含有机物,而NaCl质量分数高达99.9%。工业高盐废水含盐种类复杂且含盐量高,同时还含有大量的有机物,直接排放会给土壤、地表水及地下水带来无法逆转的污染。据预测,2025年我国将从工业高盐废水中回收1 000.0万t的废盐[1]。因此,工业高盐废水的研究对环境的污染控制与实现废水的资源化利用有重要的作用。
高盐废水含盐种类多,通常是多种盐类及水的混合物,因此构成水盐体系。工业高盐废水本质上是一些混合三元[2-5]及二元[6-7]体系,如NaCl-Na2SO4-H2O三元体系[8-9]、Ca(NO3)2-NaNO3–KNO3三元体系[10]。F.Yuan等[11]采用等温溶解的实验方法,研究了298.15 K条件下Li2SO4+LiB5O8+H2O和LiCl+LiB5O8+H2O两种三元体系的锂盐生产过程并测定了溶解度、密度和折射率。C.Christov[12]研究了氢-光卤石在MgCl2-H2O体系中的溶解度;Y.F.Guo等[2]使用等温溶解方法测定在288.00 K和308.00 K下Na2SO4-Li2SO4-H2O三元体系热力学相平衡时的溶解度和密度;王军涛等[13-14]和陈静等[15]分别对三元体系LiNO3-NaNO3-KNO3、NaNO3-KNO3-Ca(NO3)2和二元体系KNO3-Ca(NO3)2进行了相图预测及热性能研究。刘凤菊等[16]研究了Al2(SO4)3-Na2SO4-H2O三元体系相平衡。G.R.Vaghar等[17]采用Pitzer热力学模型研究了CoCl2-Co(NO3)2-H2O三元电解质体系,结果表明Pitzer热力学模型能够很好地描述该三元系统。杨智勇等[18]和苏丽鳗等[19]分别用局部组成模型和湿固法研究了NaCl-Na2SO4-H2O体系变温情况下的相平衡,发现预测结果与实验数据基本一致。卢海娇[20]研究了40.00~100.00℃内温度间隔为10℃时NaCl-Na2SO4-H2O三元水盐体系的相平衡。结果表明,随着温度的升高,共饱点处NaCl质量分数增加,Na2SO4质量分数降低,H2O质量分数降低。对NaCl-Na2SO4-H2O三元体系,利用体系中各盐的溶解度差异,通过蒸发、结晶等一系列相分离技术,可将盐从废水中分离出来。上述过程涉及盐类的动态溶解、结晶,即固液相平衡过程。使用Pitzer模型探究水盐体系的溶解度以及相平衡,对水盐体系中盐类的分离提取具有重要的指导作用。
综上所述,针对298.15 K条件下Pitzer热力学模型中纯盐参数β(0)、β(1)和Cφ对NaCl-Na2SO4-H2O三元体系溶解度预测的影响鲜有研究。本文以工业高盐废水为研究对象,运用Pitzer热力学模型,对NaCl-Na2SO4-H2O三元体系在温度为298.15 K时的溶解度及活度系数进行计算,以期明确高含量NaCl和Na2SO4废水处理与盐分回收的影响因素,为我国工业高盐废水大型工程化治理提供一定的理论依据。
1 Pitzer模型及参数确定
1.1 数学物理模型
在Pitzer热力学模型的表述中,使用3~4个相互作用参数,描述各种电解质溶液(n-1或1-n(n为1~5的整数)型电解质MX)中各个离子间的相互作用关系。对于0-1型电解质,所用参数为β(0)、β(1)、Cφ。其中,β(0)表示离子之间不同类型的短程相互作用,β(1)表示离子之间溶剂引起的间接力的作用,Cφ为三元相互作用的系数,只在高浓度时才有重要性。对于2-2型电解质MX,所用参数为β(0)、β(1)、β(2)和Cφ,其中β(2)用于描述2-2型及更高价型电解质溶液中离子间的缔合作用,两种同号离子间作用参数用二元参数θMX来描述。如果溶液中含有一种异号离子和两种同号离子,则用三元参数ψMNX来描述。
在NaCl-Na2SO4-H2O三元体系中,当温度为298.15 K时,Cl-、SO24-之间的相互作用参数θCl-,SO24-为0.020 0,Na+、Cl-、SO24-之 间 的 相 互 作 用 参 数ψNa+,Cl-,SO24-为0.001 4,其余该三元体系的Pitzer作用参数见表1。

表1 温度为298.15 K时NaCl和Na2SO 4的Pitzer作用参数
1.2 控制方程及计算过程
Pitzer电解质溶液理论[21]对体系总过量Gibbs自由能[22]的描述如下:
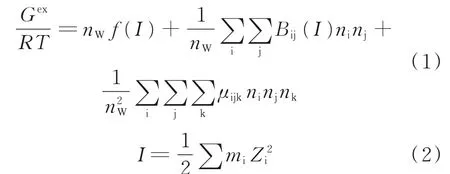
式中,Gex为剩余吉布斯自由能,J;R为气体常数,J/(mol·K);T为温度,K;nW为溶液中溶剂(水)的质量,kg;下标i、j、k为溶液中的离子;Bij(I)为第二维里系数,表示离子i、j间的短程作用系数,是离子强度I的函数;μijk为离子i、j、k间的作用系数,忽略与离子强度I的关系时称第三维里数;ni、nj、nk分别为水中离子i、j、k的物质的量,mol;f(I)为描述长程静电作用的函数;Zi为离子i的价数;mi为离子i的质量摩尔浓度,mol/kg。
C.E.Harvie等[23-24]对电解质水溶液的Pitzer热力学模型进行整核后,提出了更加便于使用的离子活度系数公式,即H-W公式:

式中,γM、ZM分别为阳离子M的活度系数、价数;Na、Nc、Nz、Nn分别为阴离子a、阳离子c、中性分子z及中性分子n的最大种类数;a、c、z、n分别为阴离子a、阳离子c、中性分子z、中性分子n的种类数;mc为阳离子c的质量摩尔浓度,mol/kg;γX、ZX分别为阴离子X的活度系数、价数;ma为阴离子a的质量摩尔浓度,mol/kg;γn为中性分子的活度系数;mn为中性分子的质量摩尔浓度,mol/kg;λnM、λnc、λnX、λna分别为中性分子n与阳离子M、c阴离子X及a的相互作用系数;ψMca为阳离子M、c及阴离子a的相互作用力系数;BMa、BcX为第二维里系数,分别表示阳离子M与阴离子a、阳离子c与阴离子X间的短程作用系数,与离子强度有关;CMa、CcX为模型中阳离子M与阴离子a、阳离子c与阴离子X间的交互参数;F为离子间的相互作用力,N;ΦMc为阳离子M与阳离子c的渗透系数;Φ为溶液的渗透系数;AΦ为渗透系数Φ的Debye-Hükel系数,由溶剂性质和温度决定。
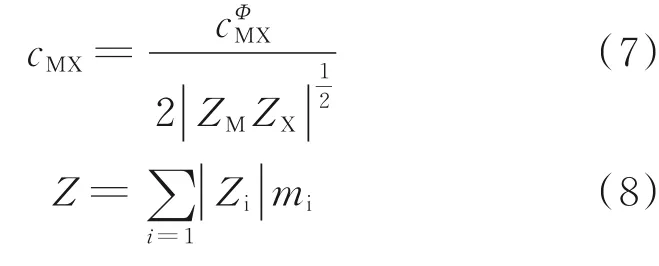

式中,Фij为静电非对称混合效应项;θij是Pitzer作用力参数,用于两个同号但不同种类的离子(两个阳离子或阴离子)之间;Eθij为不对称高阶项;J(x)为短程相互作用的离子间其位能的集团积分;J′(x)为J(x)的一阶微分。为准确计算,将J(x)拟合成以下函数:
1.3 模型验证
Pitzer热力学模型广泛应用于强电解质水盐体系热力学性质的研究。在Pitzer热力学模型中,有四个纯盐参数β(0)、β(1)、β(2)和Cϕ,八个混合盐参数Pitzer热力学模型中各项参数的意义见表2。

表2 Pitzer热力学模型中各项参数的意义
在NaCl-Na2SO4-H2O体系的Pitzer模型中,忽略β(2)和 六 个 混 合 盐 参 数系的Pitzer参数后,通过比较采用不同来源的Pitzer参数计算的NaCl和Na2SO4在水溶液中的溶解度和文献报道值,可验证本实验Pitzer参数的可靠性。本文选取的参数经过线性回归及Pitzer模型拟合,对NaCl-Na2SO4-H2O体系有良好的适用性。
2 分析与讨论
2.1 溶解平衡的判据
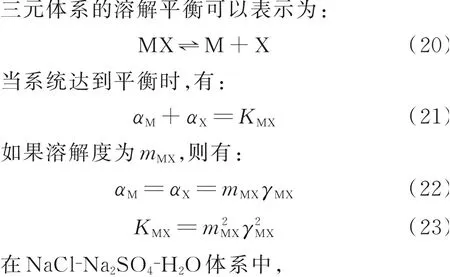

2.2 溶解度预测
由于溶液中分子、离子的活度系数和该溶液体系中的水活度与离子有效浓度成自然对数关系,并且它们之间的关系相当复杂,要解决由离子活度积与平衡常数结合起来的方程组有很大困难。因此,必须借助计算机,采用求解非线性方程组的牛顿迭代法,充分利用MATLAB中solve、subs等一些函数,按照一定的算法程序进行溶解度理论计算。经多次循环程序,最终获得多组Na+、Cl-、SO2-4的溶解度数据。经过计算,得到NaCl-Na2SO4-H2O体系298.15 K时的活度系数及溶解度,结果见表3。

表3 NaCl-Na2SO4-H 2O体系在298.15 K时的活度系数及溶解度
由表3可知,随着Na2SO4质量分数的增加,Na+和Cl-的质量摩尔浓度急剧下降,Na+的活度系数随着SO2-4质量摩尔浓度的增大呈先增大后急剧下降趋势,Cl-的活度系数呈下降趋势,但下降幅度并不大,SO2-4的活度系数先下降再升高;随着液相中Na2SO4质量分数的增加,Na+的活度系数呈先增大后减小的趋势。当液相中Na2SO4的质量分数小于6.8%时,随着液相中Na2SO4质量分数的增加,Na+的活度系数平均增加4.4%;当液相中Na2SO4的质量分数为6.8%~14.9%时,随着液相中Na2SO4质量分数的增加,Na+的活度系数减小的幅度不大,约降低4.1%,液相中Na2SO4的质量分数大于14.9%时,随着液相中Na2SO4质量分数的增加,活度系数平均降低8%。由于三元体系溶液中随着Na2SO4盐质量分数的增加,会产生中性盐Na2SO4·10H2O[25]。由其性质[26]得知,Na2SO4·10H2O使溶液中的NaCl溶解度降低,造成Na+和Cl-的质量摩尔浓度减小。
2.3 相图绘制及分析
根据表3数据所绘制的三元相图如图1所示。图1与文献[27]中293.15~303.15 K下该体系的图形大致相同,说明模型计算的正确性。但是,由于体系研究的温度不同,各物质的溶解度随温度发生变化,因此达到平衡时各物质在液相中的质量分数也不同。
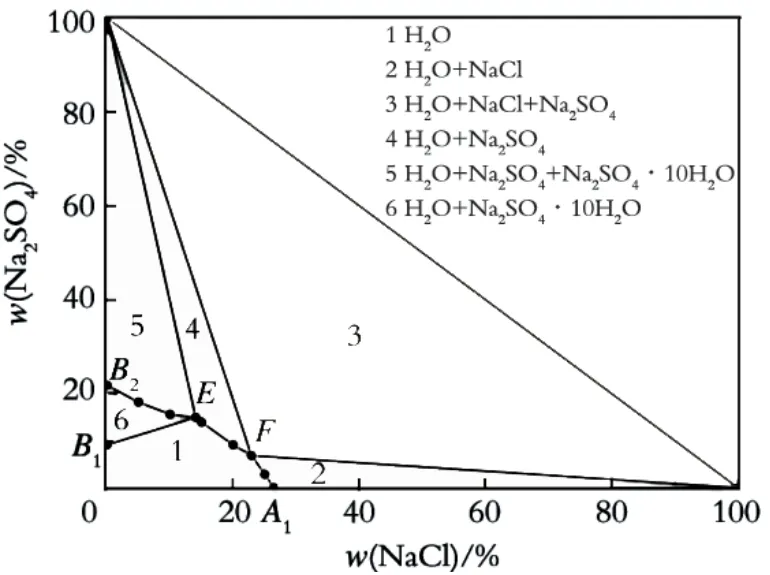
图1 温度为298.15 K时NaCl-Na2SO 4-H 2O的三元相图
由图1可见,曲线B2E、EF、FA1为饱和溶液线,根据其在图中的位置,能够看出该温度下平衡固相溶解度的大小,曲线越靠近原点,表明溶解度越小。图2中,点E、F分别为Na2SO4-Na2SO4·10H2O、NaCl-Na2SO4复盐的组成点,即两种复盐的共饱点(也称等温零变量点,其中E点存在Na2SO4、Na2SO4·10H2O固相,F点存在NaCl、Na2SO4固相),这两点分别与两种单盐的固相点(100,0)、(0,100)相连,形成三条复盐射线,将相区分成了2—5区即4个部分。相图共分为6个区域:1区水质量分数较高,为未饱和溶液区,处于该区域时,表示液相处于不饱和状态,此时NaCl和Na2SO4全溶;2区中NaCl质量分数较高,为一液一固两相区,即NaCl的单固相结晶区[28],该区域的大小反映该温度下固相结晶析出的难易程度,结晶区域越大,沉淀析出该固相越容易,此时Na2SO4全溶,存在未溶NaCl固相;3区为两固一液三相区,即NaCl和Na2SO4的结晶区,处于该区域时,存在NaCl和Na2SO4两种固相;4区Na2SO4质量分数较高,为一液一固两相区,即Na2SO4的单固相结晶区,此时NaCl全溶,存在未溶Na2SO4固相;5区同为两固一液三相区,即Na2SO4和Na2SO4·10H2O的结晶区,处于该区域时,存在Na2SO4和Na2SO4·10H2O两种固相;6区Na2SO4·10H2O质量分数较高,为一液一固两相区,即Na2SO4·10H2O的单固相结晶区。
结合表3和图1可知,当水质量分数减少时(水质量分数从原点至三角形相图斜边逐渐减少),组成比例不同的NaCl和Na2SO4两种盐的析出顺序是不同的:在2区,当液相中NaCl质量分数大于22.9%、Na2SO4质量分数小于6.8%时,随着水分的蒸发,会先析出NaCl;在4区,当液相中NaCl质量分数为14.0%~22.9%、Na2SO4质量分数为6.8%~14.9%时,随水分蒸发,会先析出Na2SO4;同理,在6区会先析出Na2SO4·10H2O,在5区会析出Na2SO4和Na2SO4·10H2O,而在3区则会同时析出NaCl和Na2SO4两种盐。溶液中的Na2SO4,其离子的水合作用比NaCl大,能够使溶液中的自由水分子减小,从而提高溶液中NaCl浓度,使NaCl结晶析出。
3 结 论
(1)不同离子的活度系数受各离子质量分数的影响程度不同。随Na2SO4质量分数的增加,Cl-和SO2-4的活度系数无明显变化。随着液相中Na2SO4质量分数增加,Na+的活度系数呈先增大后下降的趋势:当液相中Na2SO4质量分数小于6.8%时,Na+的活度系数上升的平均速率为4.4%;当液相中Na2SO4质量分数介于6.8%~14.9%时,Na+的活度系数下降的平均速率为4.1%;当液相中Na2SO4质量分数大于14.9%时,Na+的活度系数下降速率最快,平均速率为8.0%。
(2)随着水分的蒸发,盐的质量分数不同时析出顺序也不同。由于H2O的盐析作用,当液相中NaCl质量分数大于22.9%、Na2SO4的质量分数小于6.8%时,随着水分的蒸发,NaCl先析出而Na2SO4后析出;当液相中NaCl质量分数为14.0%~22.9%、Na2SO4质量分数为8.0%~14.9%时,溶液中存在Na2SO4·10H2O,因此盐析出的顺序相反。
(3)通过水盐相图不仅可以分析溶液中NaCl和Na2SO4的溶解度变化情况,还能预知该体系在外界条件改变时可能出现的系列变化限度、方向及NaCl和Na2SO4的析出顺序,能够简化NaCl和Na2SO4两种盐类的分离过程,有助于降低实验工作量。

