药用植物悬浮细胞培养技术研究进展
胡珊群 梁汝黛 李彤 王晨 刘长利

摘 要:近年来,随着我国中医药事业的持续发展,药用植物次生代谢产物的应用途径逐渐增多,药用价值和经济价值逐年上升,其市场需求量也持续增长,而药用植物野生资源蕴藏量下降、生态环境破坏等问题使得药用植物面临着严重的市场供需矛盾。药用植物人工栽培面临着栽培困难、品种退化、成本高昂等难题。采用植物悬浮细胞培养技术,可快速获得成熟的植物细胞、积累植物中的活性成分,为获得药用植物资源开辟了新途径。简要介绍了悬浮细胞的最优培养条件和方法、大规模生产悬浮细胞的研究以及悬浮细胞培养技术的前景。
关键词:药用植物;悬浮细胞;培养条件;植物生长物质;诱导子
文章编号:1005-2690(2021)18-0007-06 中国图书分类号:S567 文献标志码:B
药用植物的次生代谢产物有极高的药用价值,比如柴胡皂苷可抗病毒、甘草甜素有免疫调节作用[1]。此类化合物除药用外也可作为良好的保健品、农药及化妆品原料,需求量与日俱增。而人工栽培药用植物对种子、土壤、气候等条件要求较高,栽培过程中易感染病害、栽培时间长、管理成本高等问题都使药用植物次生代谢产物供需关系紧张。
植物悬浮细胞培养是一种快速获得成熟植物细胞及其代谢产物的新技术,运用悬浮细胞培养技术,可以大量生产药效成分[2]。目前已运用悬浮细胞技术成功获得包括人参、甘草、厚朴[3-5]等大宗药材的次生代谢产物。植物悬浮细胞不仅可用于生产药用活性物质,还能用于遗传多樣性分析、研究转基因植物和探究代谢产物生物合成路径等方面[6]。目前已有200余种植物进行悬浮细胞培养,中国、日本、德国已成功进行人参、紫草等植物的大规模生产,能够满足人参、皂苷等植物次生代谢产物的市场需求[7]。
植物悬浮细胞培养技术可在人工精确设计下获得药用植物细胞及其代谢产物,不仅能缓解药用植物资源紧缺的问题,还能减少对土地资源的占用,是获取药用活性成分、保护药用植物资源的重要手段。尽管国内外已经进行了悬浮细胞培养的初步尝试,但是此技术还需要不断优化和改进。本文将对悬浮细胞的最优培养条件和方法、大规模生产悬浮细胞的研究以及悬浮细胞培养技术的前景进行综述。
1 悬浮细胞制备
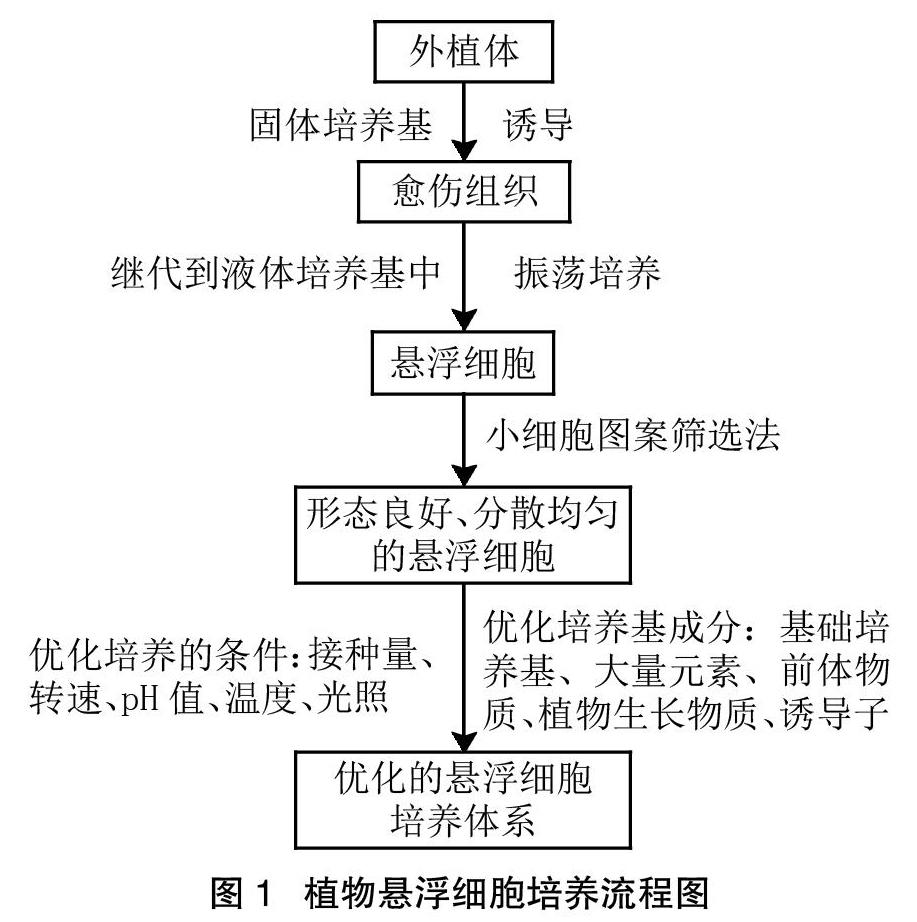
获得植物悬浮细胞的操作流程如图1所示,建立良好的悬浮细胞培养体系受多方面因素影响,确定各因素的最佳条件是成功建立及优化悬浮细胞培养体系的关键。
悬浮细胞的制备是建立良好的悬浮细胞体系的基础,制备流程主要包括选择外植体、选择最佳诱导愈伤部位、选择最佳愈伤状态、悬浮细胞的筛选和继代4个方面。
外植体的选择能够影响细胞的生长,适宜的外植体可诱导出胚性愈伤率和再生率较高的体系,更容易建立起高频再生的悬浮细胞系[8-18]。部分植物的最佳外植体诱导部位见表1,说明不同的植物对诱导部位的选择差异较大。
而同一植物的不同部位所诱导的愈伤组织状态也不同,祖恩凡等[19]研究发现金银花的嫩茎能诱导出活力最佳的愈伤组织,因此选择合适的外植体部位才能诱导出生长良好的愈伤组织,从而构建良好的悬浮细胞培养体系。
试验所得的愈伤组织通常有3种类型:Ⅰ型为质地坚硬、块状、颜色鲜黄的胚性愈伤组织;Ⅱ型为质地疏松、易分散、不分泌黏液的颗粒状胚性愈伤组织,外观往往呈现淡黄绿色;Ⅲ型为柔软、水渍、形状不规则、颜色淡白的非胚性愈伤组织。悬浮细胞系的建立通常选择Ⅱ型愈伤组织作为建立悬浮细胞系的材料。在培养朱砂根、印楝、何首乌、油棕、相思树等[20-24]植物的悬浮细胞时,均使用到质地疏松、分散、不分泌黏液的颗粒状胚性愈伤组织进行悬浮细胞的培养。愈伤组织的细胞结构随着继代次数的增加逐渐变得疏松,且细胞体积增大,畸形细胞明显增加。这表明,愈伤组织中的细胞逐渐由胚性愈伤组织转化为非胚性愈伤组织。张静等人对山西野葛悬浮细胞的研究显示,选用继代第三次的愈伤组织进行悬浮细胞培养的野葛[25-26]总黄酮含量最高。
为得到均一性、分散性良好且生长旺盛的悬浮细胞系,在继代时需对悬浮细胞进行筛选,得到均一性、良好的细胞系。目前主要操作的方法有小细胞团筛选法、直接倾倒法和移液管接种法[27]。小细胞团筛选法指用不锈钢网或尼龙网[28]筛选细胞团,收集小细胞进行继代培养。在对刺山柑[29]研究中发现,随细胞团直径增加,细胞中总黄酮含量下降[30-31]。
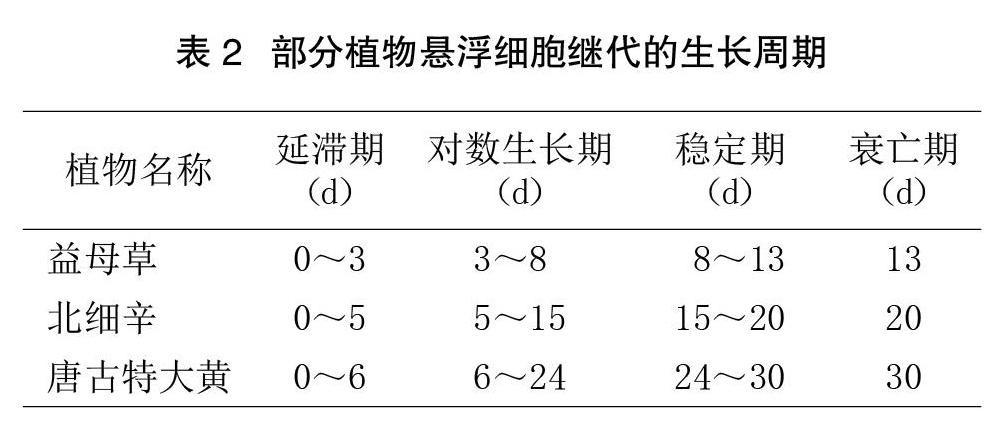
悬浮细胞的生长曲线为S型,分为延滞期、对数生长期、稳定期及衰亡期4个阶段。3种植物的生长周期见表2,对数生长期后,由于培养基中的营养物质减少,细胞开始代谢积累有害物质,使细胞生长速度减慢。不同植物的悬浮细胞生长周期不同,但继代培养都应选择在对数生长的末期或稳定期进行。
2 培养条件
对悬浮细胞中次生代谢物的产生影响较大的是悬浮细胞的培养条件,主要包括两个方面,一个是培养基的选择,另一个是外部条件的控制,包括pH值、溶氧水平等。
2.1 培养基的选择
培养基成分主要包括基础培养基、大量元素、植物生长物质、前体物质和诱导子。目前,建立或优化植物悬浮细胞培养体系时,多就植物生长物质和诱导子的种类和浓度进行研究。
常见的培养基种类有B5、MS、White、N6等,郭紫娟[32]发现,三七的悬浮细胞细胞干重增长量在B5培养基中比在MS培养基中高1.25 g/L。因此选择合适的基础培养基有助于提高次生代谢产物的含量。植物培养基中的大量元素包括碳、氮、磷等,碳源是植物细胞生长过程中主要的营养物质来源。氮源在细胞生长过程中主要用于合成蛋白质与核酸等细胞物质。磷是组成生物遗传因子与诸多代谢相关辅酶的重要元素。为更好地促进悬浮细胞的生长和代谢,应当注意大量元素的使用浓度。蔗糖不仅是培养液中碳源的主要来源,还能够维持培养基渗透压。糖的浓度过高易导致细胞失水,产生褐化反应[33]。研究发现,培养基中蔗糖的浓度在28 g/L时,三七幼叶的悬浮细胞干重增长量达到最高[34]。
常用的植物生长物质有6-苯甲基腺嘌呤(6-Benzylaminopurine,6-BA),萘乙酸(1-naphthylacetic acid,NAA),2,4-二氯苯氧乙酸(2,4-Dichlorophenoxyacetic acid,2,4-D),激动素(Kinetin,KT)等,选用不同的生长物质,对悬浮细胞影响不同。在MS培养基中添加6-BA和2,4-D时,白木香悬浮细胞的生长情况最好,而添加NAA的培养基中,白木香的悬浮细胞出现了褐化现象,细胞鲜重出现负增长[35]。此外,同一生长物质的不同浓度对悬浮细胞的生长也有影响,如紫苏悬浮细胞的干重及迷迭香酸的含量随6-BA的使用浓度先增加后减少[36]。目前研究发现,植物生长物质对悬浮细胞生长代谢的影响有以下两种情况:①低浓度促进悬浮细胞的生长代谢,高浓度抑制悬浮细胞的生长代谢。②在各个浓度下均抑制悬浮细胞的生长代谢。值得注意的是,植物生长调节剂有一定毒性。NAA能够抑制小鼠肝细胞增殖并促进肝细胞凋亡,使小鼠体重减轻[37]。2,4-D是一种常用的除草剂,能降低小鼠精子质量,引起生殖毒性损伤[38]。因此在提取悬浮细胞内代谢产物时,必须洗净悬浮细胞上的液体培养基。在筛选植物生长物质的使用浓度时,可进行正交试验,这样在降低试验成本的同时可研究各激素之间的协同或拮抗作用。
诱导子可以促使植物抗毒素信号形成,将诱导子应用于植物细胞培养可提高目标代谢产物的含量,是国内外研究的热点之一。诱导子主要分为生物诱导子和非生物诱导子。常见的非生物诱导子[39-45]有茉莉酸甲酯(Methyl Jasmonate,MeJA)、水杨酸(Salicylic acid,SA)、重金属盐、稀土元素等,目前国内外对MeJA和SA的研究比较多。段永波等研究发现蜀葵的悬浮细胞内总黄酮的含量随MeJA使用浓度的增加呈先增加后减少的趋势。MeJA和SA处理均能显著促进生物碱在半夏悬浮细胞中的累积,150 μmol/L的MeJA和50 μmol/L的SA分别处理可以使半夏生物碱含量为对照组的3.6倍和2.5倍。适当浓度的金属离子可激活一些次生代谢过程中相关酶的活性,增加植物次生代谢产物的积累。范寰等人在培养长春花的悬浮细胞时,发现加入低浓度的Ce4+可增加细胞H2O2的产生和长春质碱的合成,此作用可能是通过激活长春花中的细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)途径来实现的。生物诱导子包括真菌、细菌、病毒等,目前对植物内生真菌的研究较多。内生真菌可能是道地药材形成的原因之一,内生真菌可能通过参与细胞代谢途径调节悬浮细胞的生长。在对宜宾当地油樟悬浮细胞的研究发现,其内生真菌可通过影响H2O2通路来调节挥发油的代谢,在添加40 mg/L内生真菌后,悬浮细胞中挥发油的含量约为对照组的2.0倍。
前体物质[46-48]是合成次生代谢产物的前提条件,在植物懸浮细胞培养过程中加入不同种类、浓度的前体物质,会对目标次生代谢产物的合成产生不同的影响。紫杉醇合成的前体物质苯丙氨酸、苯甲酸钠及乙酸钠对红豆杉悬浮细胞的紫杉醇产量有显著影响。当在培养基中分别加入15 mg/L苯丙氨酸及30 mg/L苯甲酸钠时,红豆杉悬浮细胞中的紫杉醇产量分别提高了21.76%和26.14%。
2.2 外部条件的控制
制备生长状态良好的悬浮细胞,选择最适培养基是进行悬浮细胞培养的重要准备工作,而控制合适的外部条件也是悬浮细胞长期生长和次生代谢产物积累的必要条件。外部条件主要包括培养液的pH值和溶氧水平、温度及光照条件。
一般药用植物细胞生长最适pH值范围为5.8~6.0。培养基的pH值对悬浮细胞的影响很大,过酸或过碱的环境都会加剧悬浮细胞的褐化甚至引起悬浮细胞死亡,因此在配制悬浮细胞的培养液时应调节其酸碱度,使其适合悬浮细胞生长。剑麻及南方红豆杉[49-50]悬浮细胞在pH值为5.8时长势最好。也有一些细胞的最适pH值偏大,Malik等[51]研究发现,适合紫草细胞生长及紫草宁衍生物形成的pH值为7.25~9.50。除了pH值之外,培养液的溶氧量也影响悬浮细胞的生长。在培养悬浮细胞时,通常通过改变摇床转速和培养液体积调节溶氧量。液体培养基的溶氧量和细胞分散度与转速呈正相关,最适的转速在100~150 r/min范围内。徐薯[52-53]的悬浮细胞对转速敏感,当摇床转速为100 r/min时,徐薯悬浮细胞的生长速度最快。适宜的装液量有利于在离心力的作用下使悬浮细胞分散,从而促进细胞生长,能够为悬浮细胞提供足够的生长空间和溶氧量。程玉鹏等[54]在建立柴胡悬浮细胞的培养体系时发现,固定接种量(2 g)和培养瓶容积(250 mL),将培养基体积从50 mL逐步增加至100 mL时,细胞增重量明显增加,若持续增加培养基体积,细胞增重量则明显下降;当固定转速,愈伤组织接种量在2.0 g,培养液体积占容器的2/5时,细胞鲜重增至最大。
培养植物悬浮细胞时,次级代谢产物合成的最佳温度为20~28 ℃。当培养温度与植物细胞正常生长所要求的温度相差很大时,可引起某些应激效应,或对次级代谢产物积累产生激活作用。不同植物对温度的需求不同,部分植物悬浮细胞生长所需的最佳温度和悬浮细胞代谢所需的最佳温度不同,是因为温度对植物细胞生物合成途径中相关基因表达和调节物质有影响。对葡萄悬浮细胞[55]的研究表明,在38 ℃时,葡萄悬浮细胞中褪黑素生物合成的相关基因色氨酸脱羧酶(Tryptophan decarboxylase,TDC),血清素N-乙酰基转移酶(Serotonin N-acetyltransferase,SNAT)和N-乙酰基-5-羟基色胺-甲基转移酶(N-acetyl-5-hydroxytryptamine-methyl transferase,ASMT)的表达量有明显上调。牛晓娟等[56]研究不同温度对石斛悬浮细胞的影响,发现在31 ℃条件下培养的石斛悬浮细胞的增殖系数最小;而当温度为25 ℃时,随着培养天数的增加,石斛悬浮细胞的增殖系数增大。除温度外,药用植物细胞在悬浮培养时可通过调节光照时间[57]的长短、光质和光的强度来增加次生代谢产物的积累。在光照时间12 h/d、光照1 200 lx时,仙茅悬浮细胞干重和仙茅苷含量均处于较高水平,分别是黑暗组的1.85倍和2.18倍。光照对悬浮细胞的影响可能与光信号转录因子引起的基因调控有关。李汉生等[58]的研究发现,蓝光照射培养的龙眼悬浮细胞比黑暗培养的龙眼悬浮细胞生长及代谢更加旺盛,蓝光照射组干重比黑暗组多0.28 g/L,比类黄酮含量多0.77 mg/g。光照对悬浮细胞的影响也可能与植物本身的习性有关,因此在进行相关研究时可与原植物对光照的需求进行对比,以得到最适合悬浮细胞生长的光照条件。
3 大规模生产悬浮细胞
为实现植物细胞大规模培养、进行次生代谢产物工业化生产,需选用合适的生物反应器,以便于控制物理和化学条件。目前常用的生物反应器类型及其性能对比如表3所示[59-61]。工业大规模生产在选用生物反应器的类型时,需综合考虑剪切力、混合能力及溶氧能力,剪切力过大会导致细胞褐化甚至死亡;混合能力不足则营养物质不能均匀分布、悬浮细胞分散性差;溶氧能力差则细胞不能与氧气充分接触,细胞生长受限。
4 讨论与展望
植物离体培养技术除细胞悬浮培养外还有愈伤组织培养、不定芽、毛状根培养等。相较于愈伤组织,悬浮细胞培养使细胞能够与培养基充分接触,避免有毒物质在局部大量聚集而影响细胞生长,同时摇培使空气进入培养基,使细胞更容易生长。与不定芽、毛状根的培养相比,悬浮细胞的制备则更加简便。以快速、大量获取植物活性成分为目的时,悬浮细胞培养技术有较大的优势。目前这项技术为基因工程在植物细胞水平上的操作提供了理想的材料和途径。经过转化的植物细胞再经过诱导分化形成植株,即可获得携带有目标基因的个体。
悬浮细胞培养存在比较大的问题是褐化反应,褐化反应使细胞破损,次生代谢产物减少,主要发生在悬浮培养初期。王佳琦等的研究显示,甘草细胞的褐化主要由酶促反应引起,其主要机理是植物细胞从固体培养基转移到液体培养基产生机械损伤,使细胞内多酚氧化酶(polyphenol oxidase,PPO)活性增加,细胞内外酚类化合物含量增多,发生氧化反应生成棕色醌类化合物。褐化过程主要受培养体系转速及渗透压影响,细胞褐化的程度与转速正相关,当培养基中不含蔗糖时,细胞不发生褐化反应,但生长缓慢,因此在大规模生产时,可考虑梯度增加蔗糖的浓度和转速,以避免培养初期的褐化。工业大规模培养时也可适当添加防褐化剂,避免褐化反应。
工业化培养悬浮细胞时还可以用两步培养法:将悬浮细胞的培养分为两个阶段,第一阶段初期在适合细胞生长的培养基中培养悬浮细胞避免褐化反应,第二阶段将对数生长末期的悬浮细胞转移至能够促进次生代谢产物生成的培养基中生长,这样能够有效提高悬浮细胞的次生代谢产物含量[62-63]。
目前建立悬浮细胞培养体系的技术已经非常成熟,对悬浮细胞的研究可将重点放在以下3个方面。
(1)工业化生产方面,优化培养体系,提高次生代谢产物合成量,为工业化生产奠定基础,以此缓解药用植物资源紧缺的问题。
(2)代谢途径研究方面,以悬浮細胞为基础研究材料,构建转基因悬浮细胞系,再经诱导转化成植株,研究植物细胞代谢途径上相关关键酶基因和转录因子的功能。
(3)优选作物和资源保护方面,悬浮细胞可通过激素诱导培养成人工种子,进行转基因植物的研究,筛选出具有抗干旱、抗盐、可大量繁殖的植物品种,濒危植物也可以通过建立其悬浮细胞培养体系进行品种保存。
总而言之,悬浮细胞培养技术在药用植物生产研究中的应用,一方面可以缓解目前药材资源紧张的情况,另一方面也为药用植物的代谢途径研究提供了基础,最重要的是,利用悬浮细胞技术进行组织培养有利于作物优选和资源保护。
参考文献:
[ 1 ] 姜雪,孙森凤,王悦,等.甘草药理作用研究进展[J].化工时刊,2017,31(7):25-28.
[ 2 ] 董燕,刁玲武,周联.药用植物细胞悬浮培养的影响因素[J].中医药信息,2011,28(3):36-40.
[ 3 ] 黄景嘉,罗眺,汤钦,等.药用植物人参愈伤组织的诱导培养与悬浮细胞体系建立[J].生命科学研究,2014,18(2):121-123.
[ 4 ] 李雅丽,孟婷婷,王毛毛,等.甘草细胞在搅拌式生物反应器中的放大培养[J].植物生理学报,2015,51(3):302-306.
[ 5 ] 陈慧丽. 厚朴细胞培养与超低温保存的研究[D].福州:福建农林大学,2012.
[ 6 ] 王娟,李金鑫,李建丽,等.植物组织培养技术在中药资源中的应用[J].中国中药杂志,2017,42(12):2236-2246.
[ 7 ] 王沐兰,杨生超,郁步竹,等.红豆杉高产悬浮细胞系建立及其紫杉醇诱导的研究进展[J].广西植物,2016,36(9):1137-1146.
[ 8 ] 李鑫,李炎林,李清明,等.块根块茎类植物细胞悬浮培养技术与应用[J].现代园艺,2017(19):70-73.
[ 9 ] 王超,姚晨辉,朱林琳,等.桑树愈伤组织诱导及悬浮细胞系的建立[J].蚕业科学,2016,42(1):23-29.
[ 10 ] 龙炎杏,张学文,罗莎,等.黄花蒿悬浮培养细胞系的建立及遗传转化[J].湖南农业大学学报(自然科学版),2018,44(6):607-612.
[ 11 ] 刘薇,栗茂腾,朱玉梅,等.药用植物刺山柑悬浮培养细胞聚集体理化性质研究[J].中国医药导报,2008(21):19-22.
[ 12 ] 李金亭,郭晓双,王召阳,等.怀牛膝悬浮细胞培养的动力学研究[J].北方园艺,2016(5):132-136.
[ 13 ] 马丽娜. 新塔花的快速繁殖与细胞悬浮培养体系的建立[D].乌鲁木齐:新疆大学,2019.
[ 14 ] 郭佳祺. 蒺藜悬浮培养体系建立及不同因子对黄酮醇含量影响[D].长春:吉林农业大学,2017.
[ 15 ] 方芳,戴传超,张波,等.茅苍术悬浮细胞系建立及内生真菌诱导子对其挥发油积累的影响[J].中草药,2009,40(3):452-455.
[ 16 ] 姚喜红,魏臻武,耿小丽.苜蓿花药悬浮培养体系的建立及其影响因素[J].草地学报,2010,18(3):358-364.
[ 17 ] 张玉琼,陈娜,周建辉,等.石蒜悬浮细胞系的建立及其生物碱累积的研究[J].中草药,2013,44(24):3540-3545.
[ 18 ] 戴传超,余伯阳,薛菲,等.药用植物大戟悬浮细胞的培养[J].南京林业大学学报(自然科学版),2005(2):57-60.
[ 19 ] 祖恩凡,赵晨晨,张凌霄,等.金银花細胞悬浮培养体系的建立研究[J].现代园艺,2019(6):5-6.
[ 20 ] 邓素芳,杨旸,赖钟雄.朱砂根愈伤组织培养及悬浮细胞系建立[J].热带亚热带植物学报,2012,20(1):33-38.
[ 21 ] 韩广建,李兴林,别振宇,等.氮素对印楝愈伤组织和悬浮细胞培养的影响[J].天津科技大学学报,2015,30(4):25-29.
[ 22 ] 邵利. 何首乌悬浮细胞系的建立和稳定同位素示踪研究二苯乙烯苷合成路径[D].广州:华南理工大学,2012.
[ 23 ] 潘登浪,邹积鑫,曾宪海,等. 油棕细胞悬浮培养及植株再生技术[J].广东农业科学,2019,46(2):59-65,173.
[ 24 ] 林秀莲,叶玲娟,林玉玲,等.相思树悬浮细胞培养及其细胞形态学观察[J].热带作物学报,2018,39(9):1786-1793.
[ 25 ] 都晓龙,孙春玉,张美萍,等.继代次数对吉粳88愈伤组织生理生化指标及细胞形态的影响[J].安徽农业科学,2016,44(5):155-158.
[ 26 ] 张静. 山西野葛主要成分含量测定与细胞悬浮培养研究[D].太原:山西大学,2015.
[ 27 ] 胡尚连,尹静. 植物细胞工程[M].北京:科学出版社,2018.
[ 28 ] 罗月芳,唐婕妤,彭菲,等.益母草悬浮细胞系的建立及转化外源氢醌生成熊果苷研究[J].中国中医药信息杂志,2019,26(2):80-83.
[ 29 ] 王艳婷,甘露,刘薇,等.药用植物刺山柑愈伤组织诱导及细胞生长代谢特征研究[J].现代生物医学进展,2007(12):1779-1783.
[ 30 ] 刘思妤,杨悦,王鹰,等.北细辛悬浮培养体系的建立及优化[J].草业科学,2017,34(11):2254-2260.
[ 31 ] 舒孝和,陈志.唐古特大黄细胞悬浮培养中的生理生化特性[J].青海师范大学学报(自然科学版),2009(3):84-88.
[ 32 ] 郭紫娟.白背三七悬浮细胞培养体系的建立[J].农技服务,2015,32(10):90-92.
[ 33 ] 王佳琦,牛雯倩,李雅丽,等.甘草细胞悬浮培养初期褐化发生的机理研究[J].河南师范大学学报(自然科学版),2020,48(1):96-100,108.
[ 34 ] 李涛,李小清,张智慧,等.蔗糖浓度和外源2,4-D与KT浓度对三七幼叶细胞悬浮培养影响的研究[J].西北民族大学学报(自然科学版),2015,36(4):61-63.
[ 35 ] 吴燕燕,李明,马婷玉,等.白木香悬浮细胞培养的研究[J].中药材,2018,41(5):1044-1047.
[ 36 ] 李会珍,李娜,谭永兰,等.紫苏细胞悬浮培养生产迷迭香酸的条件优化[J].中国农学通报,2019,35(28):32-37.
[ 37 ] 崔静.萘乙酸对小鼠肝细胞增殖与凋亡的影响研究[D].青岛:青岛大学,2010.
[ 38 ] 苏芳菲,胡梦青,梅天资,等.2,4-D对小鼠精子毒性作用的研究[J].南昌大学学报(医学版),2013,53(1):13-15,37.
[ 39 ] 别振宇,李兴林,汪珊英.诱导子对蜀葵悬浮细胞、不定根培养的影响[J].天津科技大学学报,2017,32(3):23-28.
[ 40 ] 段永波,鲁放,崔婷婷,等.非生物诱导子茉莉酸甲酯和水杨酸对半夏悬浮细胞中生物碱代谢的影响[J].中国中医药信息杂志,2017,24(1):87-90.
[ 41 ] 范寰.Ce4+对悬浮培养长春花细胞次生代谢产物诱导作用的研究[D].天津:天津大学,2007.
[ 42 ] 曹蓉蓉,党小琳,行冰玉,等.胞内、外Ca2+在水杨酸诱导丹参幼苗迷迭香酸生物合成过程中的作用[J].中国中药杂志,2013,38(20):3424-3431.
[ 43 ] 李玉平,李惟雄.微量元素对大花金挖耳悬浮细胞生长与黄酮含量的影响及其化感作用[J].福建农业学报,2019,34(1):1-8.
[ 44 ] YAN K,ZHENG Y,HU L.Effect of H2O2-Mediated endophytic fungal elicitors on essential oil accumulation in suspension Cells of Cinnamomum longepaniculatum[J].Open Access Library Journal,2020,7(1):1-10.
[ 45 ] Man Yu,Jing-Chao Chen,Jin-Zhuo Qu,et al.Exposure to endophytic fungi quantitatively and compositionally alters anthocyanins in grape cells[J].Plant Physiology and Biochemistry,2020(149):144-152.
[ 46 ] 罗月芳,江灵敏,谭朝阳.药用植物离体培养研究进展[J].中南药学,2018,16(6):787-793.
[ 47 ] O.Parra,A.M.Gallego,A.Urrea,et al.Biochemical precursor effects on the fatty acid production in cell suspension cultures of Theobroma cacao L.[J].Plant Physiology and Biochemistry,2017(111):59-66.
[ 48 ] 苟莉.前体及诱导子和发酵条件对TMS-26产紫杉醇发酵体系优化[D].杨凌:西北农林科技大学,2014.
[ 49 ] 吴良,张世清,陈河龙,等.剑麻悬浮细胞体系的建立[J].分子植物育种,2019,17(6):1978-1983.
[ 50 ] 徐志荣,王婷,娄佳兰,等.南方红豆杉细胞悬浮培养体系优化及动力学研究[J].林业科学研究,2019,32(1):8-14.
[ 51 ] Malik Sonia, Bhushan Shashi, Sharma Madhu, et al. Physico-chemical factors influencing the shikonin derivatives pro-duction in cell suspension cultures of Arnebia euchroma (Royle) Johnston,a medicinally important plant species[J].Cell biology international,2011,35(2):153-158.
[ 52 ] 王欣,闫会,顾向华,等.徐薯55-2的胚性细胞悬浮培养[J].西北农业学报,2014,23(1):132-137.
[ 53 ] 李雅丽,孟婷婷,张小利,等.甘草细胞放大培养中搅拌式反应器操作策略优化[J].植物科学学报,2015,33(6):867-872.
[ 54 ] 程玉鹏,林进华,高宁,等.不同因素对狭叶柴胡悬浮细胞生长的影响[J].山西农业大学学报(自然科学版),2016,36(5):305-309.
[ 55 ] Li-hua Wang,Meng-jiao An,Wei-dong Huang,et al. Melatonin and phenolics biosynthesis-related genes in Vitis viniferacell suspension cultures are regulated by temperature and copper stress[J].Plant Cell,Tissue and Organ Culture (PCTOC),2019(3):475-488.
[ 56 ] 牛晓娟,林梦莹,杨德彩,等.不同培养条件对金钗石斛悬浮培养细胞生长的影响[J].贵州师范大学学报(自然科学版),2016,34(5):33-35.
[ 57 ] 鐘春水,赖钟雄,赖瑞联,等.金花茶松散型愈伤组织诱导与悬浮细胞系建立[J].热带作物学报,2016,37(3):476-481.
[ 58 ] 李汉生,姚德恒,陈晓慧,等.蓝光对龙眼细胞培养及类黄酮代谢的影响[J].热带作物学报,2018,39(4):694-701.
[ 59 ] 邹东恢,梁敏.生物反应器的选型原则与设备选型及新发展[J].食品工业,2019,40(4):244-248.
[ 60 ] 陈永伟,张乐晶.植物细胞培养生物反应器的种类特点及展望[J].种子科技,2017,35(11):28,30.
[ 61 ] 刘连,王义,史植元,等.植物干细胞培养研究进展[J].生物工程学报,2018,34(11):1734-1741.
[ 62 ] 李琰,公冶,祥旭,等.雷公藤不定根两相培养初步研究[J].植物科学学报,2016,34(3):469-474.
[ 63 ] 胡燕花,张本厚,贾明良,等.间歇浸没式生物反应器培养铁皮石斛组培苗[J].中国农业科技导报,2016,18(3):190-194.

