高产酯菌株的筛选及其在酱香型白酒堆积发酵中的应用
李景辉,郭 莹,,张 颖,李霄霄,卢 君,孟天毅,张翠英,肖冬光
(1.天津科技大学 生物工程学院 天津市工业微生物重点实验室 工业发酵微生物教育部重点实验室,天津 300457;2.贵州国台酒业股份有限公司,贵州 仁怀 564501)
酱香型白酒的发酵环境具有高温、高酸、开放式和复杂微生物区系等特点[1]。在酿造过程中,严苛的发酵环境对网罗自空气、生产工具、原料和高温大曲等来源的微生物进行了不断地驯化和富集,并形成了酱香型酒醅特殊的微生物群落结构及其演化过程[2-4]。不同阶段的微生物有序地对酒醅基质进行分解、利用并产生丰富的酿酒酶系和代谢产物[5],最终促使白酒中多种风味成分产生。其中,酵母菌是酒精和风味成分的主要贡献者[1,6],产物包括高级醇、有机酸和酯类物质等。20世纪60年代,东方伊萨酵母菌(Issatchenkia orientalis)首次在文献中被报道[7],其是一种具有较强耐受性和产酒精、酯类物质能力的酵母菌[8];彭俊等[9]研究发现,来自酒醅的东方伊萨酵母菌能够在高温42 ℃、乙醇体积分数8%的环境中存活,且在液态发酵中的乙醇和乙酸乙酯产量可达8.2%和385.5 mg/L。
筛选较高耐受性同时高产酒精或风味物质的酵母菌对于提高白酒的产量、质量有重要意义[10],东方伊萨酵母菌具有这些特质。熊小毛等[8]将低产高级醇的东方伊萨酵母菌制成强化曲并用于生产实验,使得兼香型白酒三轮次原酒中正丙醇的含量下降了27.4%,出酒率提高了22.9%。目前,关于东方伊萨酵母菌在酱香型白酒堆积培菌中的应用还未见报道。
本研究从酱香型酒醅中分离筛选产酒生香能力较强且适合酱香型白酒发酵环境的优良菌株,通过形态观察及分子生物学技术对其进行鉴定,并利用该菌株进行酱香型白酒的强化堆积培菌试验,探究其对风味物质和微生物菌群结构的影响,为其在酱香型白酒中的应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和试剂
玉米:市售;酱香型白酒一轮次堆积酒醅、成品大曲粉、酱香型白酒第四轮次糟醅(酸度为2.56 mmol/10 g,淀粉含量为19.64%):茅台镇某酒厂;2-辛醇(色谱纯):上海阿拉丁生化科技股份有限公司;乙醇(色谱纯):天津市江天化工技术有限公司;乳酸(色谱纯)、乙酸(色谱纯):天津市津科精细化工研究所。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基[11]:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,pH自然,121 ℃高压蒸汽灭菌20 min。
种子液培养基[11]:将玉米水解液的糖度调节至12°Bx,添加硫酸铵6 g/L,硫酸镁1.2 g/L,磷酸氢二钾2.4 g/L,pH自然,115 ℃高压蒸汽灭菌20 min。
高粱汁培养基[11]:将高粱水解液的糖度调节至18°Bx,pH自然,115 ℃高压蒸汽灭菌20 min。
堆积酒醅:质量分数为7%的成品大曲粉与酱香型白酒第四轮次糟醅混匀。
1.2 仪器与设备
789013型气相色谱(gas chromatography,GC)仪、MSD-5977B型气质联用(gas chromatography-mass spectrometry,GC-MS)仪:美国安捷伦科技有限公司;固相微萃取手柄、50 μm CAR/DVB/PDMS纤维萃取头:美国Supelco公司。
1.3 实验方法
1.3.1 酵母菌的分离筛选
酵母菌的分离和纯化:取酱香型白酒一轮次堆积酒醅10 g,与90 mL无菌蒸馏水混合并充分振荡30 min,按10倍梯度稀释至10-7,吸取梯度稀释液涂布于YPD培养基,30 ℃下恒温培养24~72 h,挑取单菌落进行划线纯化,保藏于YPD斜面。
种子液的制备:从斜面上挑取1环酵母菌接种到5 mL种子培养基中,30 ℃恒温静置培养24 h后转接于45 mL种子培养基中,相同条件继续培养16 h。
液态发酵:吸取15 mL酵母种子液接种于135 mL高粱汁培养基中,30 ℃恒温静置培养7 d,设置3组平行实验。发酵结束后测定发酵液的酒精度和乙酸乙酯含量。
1.3.2 菌株的鉴定
形态观察:参照《伯杰士手册》对纯化后的菌株进行菌落和细胞形态观察。
分子生物学鉴定:提取分离菌株的脱氧核糖核酸(deoxyribonucleic acid,DNA),以其为模板对菌株的26S rDNA基因序列进行聚合酶链式反应(polymerase chain reaction,PCR)扩增[12],将PCR扩增产物委托天津金唯智生物科技有限公司进行测序。将测序结果提交到美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中采用基本局部比对搜索工具(basic local alignment search tool,Blast)进行搜索比对分析,选取同源性较高的模式菌株的26S rDNA基因序列,使用MEGA5.1软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.3 菌株的耐受性试验
采用杜氏管法[13]测定酵母菌株对乙醇(体积分数8%~14%)、乙酸(0.1%~0.7%)和乳酸(2%~5%)的耐受能力;采用点平板法[14]测定其耐高温能力(30~45 ℃)。
1.3.4 堆积培菌试验
按照0、3%、5%、7%的接种量将酵母种子液分别接种于100 g堆积酒醅中,将加水量补至7%并充分混匀。按接种量从小到大依次将上述酒醅分别命名为酒醅1~4。之后分装酒醅于三角瓶中,用6层纱布封口,30 ℃静置培养48 h,设置3组平行实验。发酵结束后测定酒醅中挥发性物质(乙酸乙酯和乳酸乙酯、其他挥发性成分)的含量及细菌菌群结构。
1.3.5 分析方法
酒精度:使用比重法测定[15]。
乙酸乙酯和乳酸乙酯:取50 g酒醅与5 mL无水乙醇、200 mL蒸馏水混匀,蒸馏并收集100 mL馏出液。使用0.22 μm滤膜过滤馏出液并装入气相小瓶中,利用气相色谱法测定乙酸乙酯和乳酸乙酯含量[10]。
风味物质:采用气相色谱-质谱法[16]测定馏出液中的风味成分,通过质荷比在质谱库中的匹配度对被测物质进行定性分析,以2-辛醇(840 mg/L)作为内标对其进行半定量分析。
细菌群落组成分析:将磷酸盐缓冲液(phosphate buffer saline,PBS)(pH=8.0)和酒醅样品充分混合,使用布氏漏斗反复过滤混合液体,重复3~5次。在7 000 r/min、4 ℃条件下离心10 min,收集底部菌泥,委托上海派诺森生物科技有限公司进行高通量测序和操作分类单元(operational taxonomic unit,OTU)聚类分析,使用云平台分析细菌多样性指数及群落组成变化情况。
2 结果与分析
2.1 酵母菌的分离与筛选
采用传统培养分离方法共分离、纯化得到20株酵母菌株,对分离、纯化后的酵母菌进行液态发酵实验,最终筛选得到7株有较高产酒精和乙酸乙酯能力的酵母菌,结果见表1。由表1可知,菌株GTY-837产乙酸乙酯能力最高,为361.30 mg/L,产酒能力为8.97%vol均显著高于其他菌株(P<0.05)。
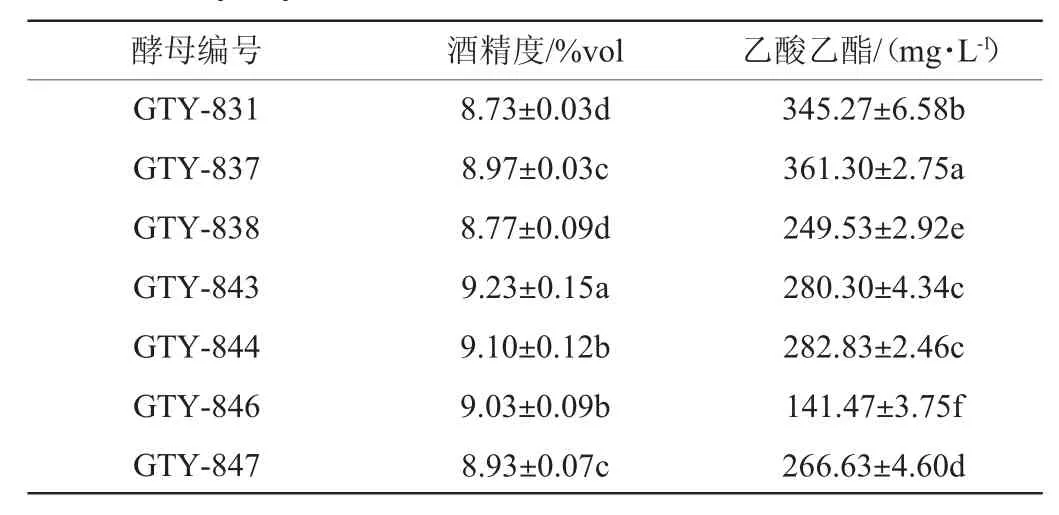
表1 酵母菌产酒及乙酸乙酯能力测定结果Table 1 Determination results of the liquor and ethyl acetate producing ability of yeast
2.2 菌株GTY-837的鉴定
2.2.1 形态学鉴定
菌株GTY-837的菌落及细胞形态见图1。由图1可知,菌株GTY-837的菌落呈不规则圆形,乳白色,隆起,质地柔软,表面覆有绒毛、略有光泽;细胞形态为短棒形或长卵形,营出芽生殖。参照《伯杰士手册》初步鉴定该菌株为毕赤酵母属(Pichiasp.)或伊萨酵母属(Issatchenkiasp.)。

图1 菌株GTY-837的菌落(a)及细胞(b)形态Fig.1 Colony (a) and cell (b) morphology of strain GTY-837
2.2.2 分子生物学鉴定
基于26S rDNA基因序列构建菌株GTY-837的系统发育树,结果见图2。

图2 基于26S rDNA基因序列菌株GTY-837的系统发育树Fig.2 Phylogenetic tree of strain GTY-837 based on 26S rDNA gene sequences
由图2可知,菌株GTY-837与东方伊萨酵母菌(Issatchenkia orientalis)YZ4(EU394711.1:20-581)聚于一支,亲缘关系最近,结合形态观察结果,将该菌株鉴定为东方伊萨酵母菌(Issatchenkia orientalis)。
2.3 菌株GTY-837的耐受性试验
菌株GTY-837对乙醇、乙酸、乳酸及高温的耐受性见表2。由表2可知,菌株GTY-837能够耐受乙醇体积分数10%、乙酸0.5%、乳酸4.0%,且在40 ℃高温下仍能生长。在酱香型白酒的生产过程中,第五轮次堆醅的酒精含量为1%vol~3%vol,发酵结束后酸度为2.4~2.6 mmol/10 g(以乙酸计),温度为32~47 ℃[17]。耐受性试验结果说明菌株GTY-837能够适应五轮次堆醅的发酵环境,而该菌株同时还具有较强的产酒生香能力,因此能够用于酸性环境下的堆积培菌试验。

表2 菌株GTY-837的耐受性试验结果Table 2 Results of tolerance test of strain GTY-837
2.4 堆积培菌实验
2.4.1 酒醅中乙酸乙酯和乳酸乙酯含量的测定
采用菌株GTY-837进行堆积培菌实验,酒醅中乙酸乙酯和乳酸乙酯含量的测定结果见图3。由图3可知,酒醅2中乙酸乙酯和乳酸乙酯的含量最高,分别为1 080.21 mg/L和187.42 mg/L,与酒醅1相比提高了4 059.45%和70.99%;酒醅3中,2种酯类的含量明显降低,酒醅4中2种酯类的含量大幅增加,这可能是由于接种量的改变对酒醅微生物菌群组成产生了不同的影响,如一些产酸菌丰度的增加可能会减弱菌株GTY-837的产酯性能[18],具体原因有待进一步研究。

图3 酒醅中乙酸乙酯和乳酸乙酯含量测定结果Fig.3 Determination results of ethyl acetate and ethyl lactate contents in fermented grains
2.4.2 酒醅中风味成分分析
酒醅1和酒醅2中的挥发性成分测定结果见表3。

表3 酒醅中挥发性物质检测结果Table 3 Determination results of volatile components in fermented grains
由表3可知,在酒醅1中共检测到23种挥发性物质,其中酯类9种,醇类9种,芳香族3种,呋喃类1种,吡嗪类1种;而酒醅2中共检测到22种挥发性物质,其中酯类12种,醇类5种,芳香族1种,呋喃类3种,吡嗪类1种。
酯类:酯类物质具有典型的水果香、花香味,是中国白酒的主要呈香成分。与酒醅1相比,酒醅2中乙酸乙酯(苹果香气、清香)、L(-)-乳酸乙酯、乙酸苯乙酯和丙酸乙酯的含量大幅增加,其中乙酸乙酯广泛、大量存在于白酒中,是构成酒体风味的“第一大酯”。乳酸乙酯、月桂酸乙酯和肉豆蔻酸乙酯的含量明显减少。总体上,酒醅中酯类物质的种类和含量显著增加。
醇类:醇类物质是白酒中一类重要的呈香呈味物质。与酒醅1相比,酒醅2中异丁醇(青草气味)、正丁醇、异戊醇(割青草味)和正己醇等杂醇油的含量显著减少。同时,酒醅2中乙醇含量也明显减少,分析原因可能主要是菌株GTY-837利用乙醇生成了大量的乙酯类物质[20]。
芳香族:酒醅2中苯乙醇(玫瑰香气)的含量大幅增加且苯甲醛和苯乙醛的含量明显减少。其中,苯乙醇是白酒中主要的芳香族物质之一[21]。
呋喃类:酒醅2中呋喃类物质的含量和种类均有增加,这类物质属于羰基化合物,在酱香型白酒中的含量较高。
吡嗪类:在酒醅1、2中均检测到了2,3,5,6-四甲基吡嗪(tetramethylpyrazine,TTMP)(坚果味),酒醅2的TTMP含量较酒醅1有所下降,这可能是菌株GTY-837抑制了芽孢杆菌属微生物的生长并导致吡嗪类物质的含量降低[22],实际原因需要深入探究。
2.5 堆积培菌对酒醅细菌群落组成的影响
堆积发酵结束时,入窖酒醅中的微生物主要为酵母菌和细菌。接种菌株GTY-837后酒醅中绝对优势真菌为酵母菌,而细菌群落的变化未知;另外,由2.4.1可知各酒醅中乙酸乙酯和乳酸乙酯的含量差异显著。因此,为了进一步探究主要风味成分含量发生变化的原因,对堆积过程细菌群落组成及其变化进行了测序并分析。
2.5.1 细菌群落测序数据分析
酒醅中细菌菌群的α-多样性指数见表4。由表4可知,酒醅样品中细菌的有效测序数为96 459~130 057条,细菌属为217~334,Coverage指数为0.986~0.991,Chao1指数为1 660~2 586,Shannon指数为5.96~7.18。酒醅样品的Coverage指数接近1,说明测序结果能反映绝大多数样品细菌群落的信息;酒醅3中细菌属最多且Chao1指数最大,说明细菌丰富度较高,酒醅2的Shannon指数最大,说明细菌多样性较高。
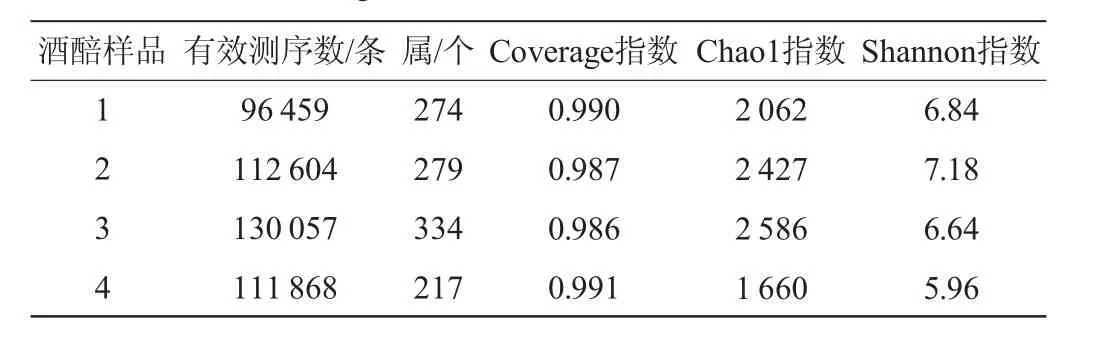
表4 酒醅样品中细菌群落α-多样性分析结果Table 4 Results of α-diversity analysis of bacterial community in fermented grains
2.5.2 细菌群落结构分析
基于属水平酒醅样品中细菌群落结构组成分析结果见图4。由图4可知,堆积酒醅中有14个细菌属的相对丰度>1%,包括克罗彭斯特菌属(Kroppenstedtia)、鞘氨醇单胞菌属(Sphingomonas)、芽孢杆菌属(Bacillus)、枝芽孢菌属(Virgibacillus)、海洋芽孢杆菌属(Oceanobacillus)、Tepidimicrobium、Georgenia、葡萄球菌属(Staphylococcus)、嗜热放线菌属(Thermoactinomyces)、中国芽孢杆菌属(Sinibacillus)、Caldicoprobacter、蔗糖多孢菌属(Saccharopolyspora)、乳酸杆菌属(Lactobacillus)和喜热裂孢菌属(Thermobifida)。

图4 基于属水平酒醅样品中细菌群落结构组成分析结果Fig.4 Analysis result of bacterial community composition in fermented grains based on genus level
由图4可知,酒醅样品中5个共有细菌属的相对丰度较高,分别为克罗彭斯特菌属(Kroppenstedtia)、鞘氨醇单胞菌属(Sphingomonas)、芽孢杆菌属(Bacillus)、枝芽孢菌属(Virgibacillus)和海洋芽孢杆菌属(Oceanobacillus)。其中,克罗彭斯特菌属(Kroppenstedtia)的相对丰度为11.18%~32.94%,分别在酒醅1、2和4中的相对丰度最大;鞘氨醇单胞菌属(Sphingomonas)的相对丰度为10.38%~29.45%,是酒醅3中的绝对优势菌属;另外,芽孢杆菌属(Bacillus)的相对丰度为8.72%~13.82%,枝芽孢菌属(Virgibacillus)的相对丰度为8.26%~17.24%,海洋芽孢杆菌属(Oceanobacillus)的相对丰度为5.54%~10.95%。
克罗彭斯特菌属(Kroppenstedtia)是一种嗜热菌属[23],主要存在于高温大曲和堆积发酵酒醅[24]中,有报道称克罗彭斯特菌属在入窖发酵阶段处于高丰度但低活性或休眠状态[25]。
鞘氨醇单胞菌属(Sphingomonas)是一类环境功能微生物,有一定耐高温性[26]和较强的代谢糖类并生成有机酸类的能力[27-28]。鞘氨醇单胞菌属在酒醅3中相对丰度最高,过高的酸度可能是抑制菌株GTY-837产酯并导致酒醅中酯类物质含量剧减的主要原因。
芽孢杆菌属(Bacillus)微生物普遍存在于大曲和堆积酒醅中,是“酱味”的主要贡献菌属,在产酶、糖化和生香的过程中扮演着重要的角色[29],且能代谢产生乙偶姻并通过一系列化学反应最终生成吡嗪类物质[30],酒醅2中四甲基吡嗪含量减少可能是由芽孢杆菌属丰度降低造成的。
枝芽孢菌属(Virgibacillus)在酒醅4中相对丰度最高,这是一类嗜盐微生物且多分布在盐场,能够代谢产生植物素[31];海洋芽孢杆菌属(Oceanobacillu)分布在珊瑚礁[32]、含盐土壤[33]和生产设备表面[34]等环境中,可以产生多种蛋白酶类[35]。
3 结论
本研究从酱香型酒醅中筛选得到了一株有较高产酒、生香能力的菌株GTY-837,经过形态学和分子生物学鉴定为东方伊萨酵母菌(Issatchenkia orientalis);通过耐受性试验发现该菌株可以耐受乙醇体积分数10%、乙酸0.5%、乳酸4.0%,并能在40 ℃的高温下生长,能适应酱香型白酒五轮次堆积发酵环境;接种菌株GTY-837进行堆积培菌实验,发现菌株GTY-837接种量为3%时,酒醅中乙酸乙酯和乳酸乙酯的含量与空白相比分别提高了4 059.45%和70.99%,同时,其他酯类、芳香族和呋喃类物质的含量也明显增加,但TTMP含量降低,分析原因可能是菌株GTY-837抑制了芽孢杆菌属(Bacillus)的生长所致。当菌株GTY-837接种量为5%时,酒醅中高产酸菌属-鞘氨醇单胞菌属(Sphingomonas)的相对丰度明显提高,这可能是抑制菌株GTY-837代谢产乳酸乙酯和乙酸乙酯的主要原因。综上,菌株GTY-837具有优良的发酵性能,在堆积培菌过程中能够显著提升酒醅中酯类物质的种类和含量,在实际生产中是否能达到理想的效果还需进行发酵验证。此外,接种菌株GTY-837会减少酒醅的TTMP含量,可考虑同时接种东方伊萨酵母菌和功能性芽孢杆菌以强化堆积培菌过程,实现酱香型酒醅风味成分的平衡。

