正向夹层再入真腔技术在冠状动脉慢性完全闭塞病变介入治疗中应用中国专家共识
葛均波 霍勇 汝磊 生 代表共识专家组
冠状动脉慢性完全闭塞(chronic total occlusion,CTO)病变目前被称为经皮冠状动脉介入治疗最后的堡垒。随着技术进步、器械改进和经验积累,CTO病变介入治疗的成功率和手术效率都有了明显提高。目前开通CTO病变的常用介入治疗技术包括正向导丝开通(antegrade wiring,AW)、正向夹层再入真腔(antegrade dissection reentry,ADR)、逆向导丝开通(retrograde wiring,RW)和逆向夹层再入真腔(retrograde dissection reentry,RDR)技术[1-2]。
近年来,Stingray球囊辅助下ADR因其安全高效受到广泛关注。为进一步提高ADR的成功率和效率,减少ADR相关并发症,国内冠状动脉介入治疗专家共同撰写《正向夹层再入真腔技术在冠状动脉慢性完全闭塞病变介入治疗中应用中国专家共识》,以进一步提升国内CTO病变介入治疗水平,规范ADR的临床应用,造福广大 CTO病变患者。
1 ADR 的发展和演变
广义的ADR包含多种正向导丝经假腔重新回到远端血管真腔的操作技术。内膜下循径再入真腔(subintimal tracking and re-entry,STAR)技术是ADR技术的早期雏形[3]。该技术特点为正向弯曲导丝在不可控状态下在血管远端由内膜下重新回到真腔,可控性差、假腔长且存在丢失分支等风险。此后,在STAR技术基础上出现了很多衍生技术。2008年Carlino等[4]提出了对比剂引导的STAR技术(Carlino技术)。基于STAR技术改良的Mini-STAR技术意图尽可能缩短重入真腔前血管内膜下长度[5],但同样存在导丝重回真腔不可控的缺点。有报道显示STAR和Mini-STAR技术的远期预后并不理想[6-7]。
限制性正向内膜下循径(limited antegrade subintimal tracking,LAST)再入真腔技术是将弯曲导丝由内膜下通过CTO病变段,在远端纤维帽附近,改换穿刺型导丝重新回到远端血管真腔。该技术的优势为能够缩短导丝在内膜下的走行长度,降低边支丢失风险[8-9],但技术成功率低。采用专用器械(Stingray球囊)辅助导丝靶向性由假腔重新回到远端真腔的技术,即器械辅助的导丝再入真腔技术,因其可重复性高、易于掌握且成功率高,已得到广泛认可与使用。本共识所指的ADR,专指使用Stingray球囊辅助的导丝再入真腔技术。
2 ADR的适应证及启用时机
CTO病变的介入治疗策略应根据近端纤维帽形态、CTO病变段特点、CTO病变远端血管及侧支循环情况而制订,是否适于实施ADR主要取决于闭塞段远端血管情况。与欧美术者不同,国内术者主要将其用于CTO病变出口登陆区条件理想,无重要分支血管,根据病变特点预期正向导丝技术通过困难,逆向介入治疗成功率低或风险较大者。
根据CTO病变介入治疗过程中ADR的启用时机,可分为直接ADR和补救性ADR。直接ADR是指正向导丝进入内膜下时,不再进行平行导丝技术等其他正向导丝操作,而将ADR作为开通CTO病变首选策略。补救性ADR是指采用各种正向或逆向技术后导丝仍无法进入远端血管真腔时再启动ADR。不同地区的术者对于ADR的启用时机有很大不同[10-14]。欧美术者使用ADR相对积极,而包括中国在内的亚洲术者,ADR使用相对谨慎,通常用于正向和逆向尝试很困难或失败的CTO病变患者。特别需要指出的是,正向导丝技术失败后仍反复在内膜下操控导丝易造成大的夹层血肿,会降低后续ADR成功率,故此时不应过多尝试,应及时进行策略转换,启动ADR。
3 ADR器械(图1)

图1 ADR器械
3. 1 CrossBoss导管(图2)

图2 CrossBoss导管示意图
CrossBoss导管是一种OTW型金属微导管,头端1 mm为钝性无创圆头设计,外覆亲水涂层,轴杆由多股导丝缠绕而成,可提供1︰1扭矩力传导,可兼容0.014 in(1 in=2.54 cm)的导引导丝,并可在6 F指引导管内兼容使用。快速旋转尾端的Fast-Spin扭控器可使CrossBoss导管在进入冠状动脉内膜下后对冠状动脉进行钝性分离,沿斑块内或内膜下安全快速通过CTO病变节段,为Stingray球囊通过建立通道。
3. 2 Stingray球囊导管和Stingray导丝(图3)
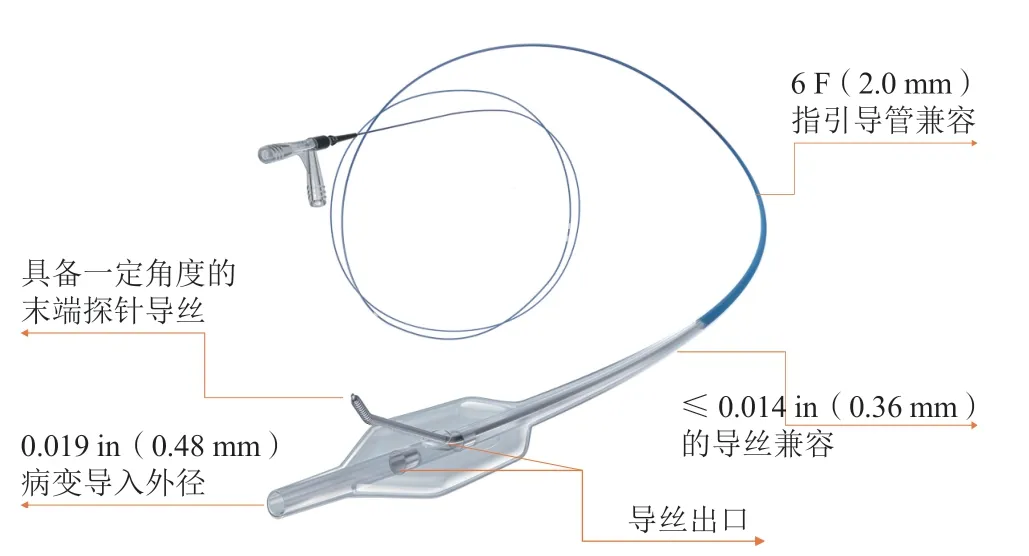
图3 Stingray LP球囊导管及Stingray导丝结构示意图
Stingray球囊是专为CTO病变ADR设计的OTW球囊,外观呈扁平状,规格为2.5 mm×10 mm,除前端导丝出口外,两个相反方向呈180°的导丝出口位于球囊正反两面。两个不透光标记带用于精确定位导丝出口位置。球囊在内膜下膨胀时,两翼自动环抱血管腔,且必有一个出口朝向血管真腔,导丝可以由此出口有选择性地重入真腔。目前国内临床使用的Stingray球囊是外径为3.2 F的Stingray LP球囊。Stingray球囊导丝腔还可以用于血肿抽吸。Stingray导丝为头端预塑形的硬导丝,头端预塑形角度为28°,具备一个0.18 mm长的探针结构,可为该导丝重入血管真腔提供强大穿透力[15]。
4 ADR操作流程
在判定CTO病变适合启动ADR操作后,术者可参考以下操作步骤[15-18]。
4. 1 建立内膜下通道
主要方法有:单纯导丝或Knuckle导丝联合使用Corsair微导管、CrossBoss导管技术[19],或联合使用以上技术如Knuckle-Boss技术等。
Knuckle导丝技术使用聚合物涂层导丝,通常用导引针将导丝头端塑形为“伞柄”状,适当用力向前推送导丝,使导丝前端保持小的“怼环”直接从内膜下通过CTO病变段,确认导丝抵近登陆区后推送微导管抵近导丝弯曲处。Knuckle导丝目前常用Fielder XT系列导丝、Fighter或Pilot系列等聚合物涂层导丝。Fielder XT/Fighter导丝头端较软,前行力量较弱,有时不能通过闭塞段,而Pilot 200导丝虽然前向力量较大,但不好控制“怼环”的直径,往往导致较大血肿。根据不同病变选用适合的Knuckle导丝有利于控制血肿形成。
与Knuckle导丝技术相比,Corsair/CrossBoss导管技术制造的内膜下假腔较小且可控,后续导丝再入真腔的可控性及成功率更高。CrossBoss导管建立内膜下通道时,首先用导引导丝将CrossBoss导管送至CTO病变近端纤维帽,将扭控器固定在距“Y”型止血阀2~3 cm位置并旋紧,防止CrossBoss导管在旋转操作过程出现导管跳跃现象。透视下,顺时针或逆时针高速旋转CrossBoss导管尾端扭控器(透明部分),以旋转为主,推进为辅。采用对侧造影(不应再行正向造影,避免夹层扩大)、相互垂直体位投照(有助于判断是否进入边支)观察CrossBoss导管头端所在位置。当CrossBoss导管通过闭塞段行进至远端纤维帽以远内膜下理想登陆区后,停止行进,退出CrossBoss导管,送入Stingray球囊辅助导丝完成重入真腔操作。此外,在10%~20%的病例中,CrossBoss导管可直接通过CTO病变体部进入远端血管真腔,此时可经CrossBoss导管送入普通工作导丝至远端血管真腔内,撤出CrossBoss导管(推荐采用锚定球囊技术以防止导丝移位),行球囊扩张和支架置入。随着国内外专家对ADR技术的认识以及对CTO病变理解的深入,使用CrossBoss导管也有了更多的经验和认识。虽然CrossBoss导管建立的内膜下通道更规整、血肿较小,但CrossBoss导管使用中容易进入分支,引起穿孔,通过性并不优于Corsair微导管[18]。因此,与国外使用情况不同,国内专家较少使用CrossBoss导管,而更多选择Corsair导管建立内膜下通道。
4. 2 准备Stingray球囊(图4)
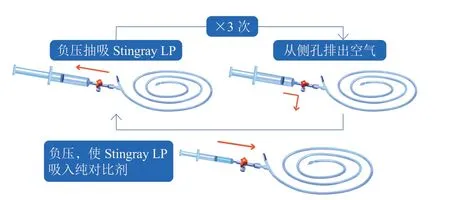
图4 Stingray LP球囊导管预准备示意图
(1)在Stingray LP球囊尾端连接一个全新、干燥的三通阀;(2)用20 ml以上的干燥螺口注射器或压力泵将Stingray LP球囊负压抽吸2~3次并关闭三通阀,保证球囊内呈真空负压状态;(3)移除大注射器或压力泵,换用一个充满纯对比剂的3 ml螺口注射器(如无螺口注射器,可连接短延长管后再连接充满纯对比剂的普通注射器)充盈三通阀;(4)打开三通阀使Stingray球囊与注射器相通,螺口注射器活塞会自动前移2~3 mm,提示纯对比剂被负压吸入Stingray球囊及杆腔内部,可确认球囊为理想排空状态;(5)肝素盐水冲洗球囊导丝腔后,Stingray球囊准备完毕。上述准备过程可以在Stingray球囊到位后进行,可能有利于球囊顺利通过和控制血肿。
4. 3 Stingray球囊送入登陆区
将Stingray球囊沿强支撑力导丝(常用Miracle 12,其支撑力强,便于球囊顺利到位并能保持系统稳定性)送至CTO病变远端的登陆区。当然,如果通道建立充分,也可以沿建立通道的任何导丝送至登陆区。
4. 4 寻找球囊“单轨征”
Stingray球囊尾端充盈口连接压力泵,将压力泵加压至4~6 atm(1 atm=101.325 kPa),待球囊充盈后,在对侧造影的指导下,多体位投照寻找球囊与血管的切线位,也就是“单轨征”(球囊呈一条线,图5~6)。

图5 双轨征及单轨征示意图
4. 5 抽吸血肿
一般通过Stingray球囊中心腔负压抽吸血肿(STRAW操作,图 7),也可送入微导管、OTW球囊或延长导管进行血肿抽吸。

图6 Stingray LP球囊由双轨征调整为单轨征的造影图

图7 STRAW的三种方法操作示意图
4. 6 穿刺
血肿抽吸后,将穿刺型导丝(如Stingray导丝、Conquest Pro系列导丝、Gaia Third导丝、Hornet系列导丝等)送至球囊的导丝出口进行穿刺(Stick操作)。穿刺成功后,谨慎操作穿刺导丝(Stick &Drive操作)旋转约180º后送入远端血管真腔,或换用聚合物涂层导丝如Pilot 200导丝(Stick & Swap操作)沿同一导丝出口和通道进入真腔并送至血管远端(图 8)。

图8 Stick & Swap操作
4. 7 导丝交换
确认导丝在血管远端真腔后,在微导管辅助下交换为工作导丝,进行常规球囊扩张和下一步操作。
4. 8 血管内超声(intravascular ultrasound,IVUS)检查
IVUS检查可用于验证导丝重入真腔位置、观察导丝轨迹、寻找支架着陆点、协助选择大小合适的支架及修正最后治疗策略等。
5 ADR操作难点及对策
ADR操作独有的技术难点包括:Stingray球囊到位困难、Stingray球囊显影不充分、巨大血肿及穿刺不成功等。
5. 1 Stingray球囊到位困难
Stingray球囊到位困难的原因主要有:入径迂曲、指引导管与血管同轴性差及内膜下通道阻力大等。可尝试使用长鞘(如45 cm)和(或)8 F指引导管、延长导管(如Expressman、Guidezilla等)、边支锚定等增加支撑力或使用螺旋微导管、小球囊扩张内膜下通道的方法解决。
5. 2 Stingray球囊显影不充分
Stingray球囊显影不充分通常是球囊准备不规范的结果。在准备Stingray球囊时应用大容量螺口注射器或压力泵多次负压抽吸,以保证球囊充分排气。Stingray球囊已达穿刺位置可重新进行球囊准备操作。如球囊显影段超过1/4球囊长度,可通过多体位透视寻找切线位进行穿刺操作。如球囊显影仍不充分,可尝试双面盲穿(Double-blind-stick)。
5. 3 内膜下巨大血肿
预防内膜下血肿形成对于ADR成功至关重要。根据不同正向通道建立方法,ADR操作过程中的血肿大致可分为导丝特别是Knuckle导丝及反复平行导丝引起的血肿,Corsair微导管引起的血肿及CrossBoss引起的血肿等。不同操作形成的血肿特点不同:受导丝硬度限制,单纯导丝操作引起的血肿通常较小且不规则;Knuckle导丝技术引起的血肿较大且不规则;Corsair或CrossBoss微导管引起的血肿相似,较小且相对规则。
为尽量避免内膜下血肿形成,术中可采用导丝加Corsair微导管或Knuckle+Corsair/Knuckle+CrossBoss导管的方式进行内膜下通道准备。预防血肿形成的技术要点包括:减少正向导丝操作,尤其避免反复正向平行导丝的使用;导丝进入CTO病变体部、启动ADR操作时,建议断开正向环柄注射器与三联三通板的连接,避免无意中正向注射对比剂造成内膜下血肿扩大;遇到同侧逆向侧支时,可经微导管超选侧支造影,有时需要使用“乒乓”指引导管技术造影或经“乒乓”指引导管与微导管联合造影(图 9)。

图9 “乒乓”指引导管造影
血肿形成后的处理方法主要包括封堵入口和Stingray球囊中心腔抽吸,其中封堵入口操作尤为重要。封堵入口的工具主要为球囊或延长导管,球囊的封堵可在分支内或近端主支血管内(图10),而延长导管的封堵位置主要在CTO病变体部(图 11)。血肿入口被封堵后,可利用Stingray球囊中心腔抽吸。封堵和抽吸的联合操作可能取得良好的效果[20]。有时导丝成功再入真腔及支架置入后仍可见内膜下血肿压迫远端血管真腔,此时可用普通球囊或切割球囊于血肿压迫部位扩张,有时可以恢复正向血流。但需谨记,预防血肿形成比处理血肿更重要。

图10 球囊封堵
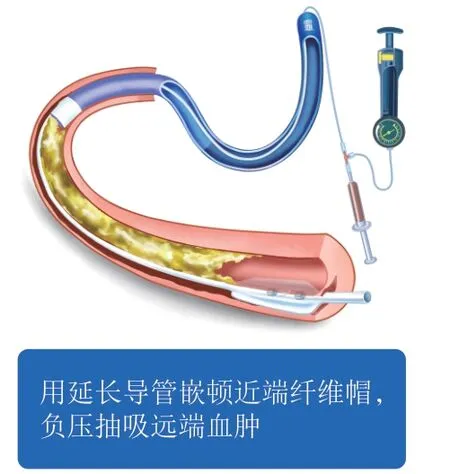
图11 延长导管嵌顿
5. 4 穿刺不成功
穿刺不成功的主要原因包括:巨大血肿、血管远端登陆区严重病变或钙化,登陆区血管迂曲或成角等。如出现巨大血肿,可在处理血肿后再尝试穿刺,如血肿处理欠佳,可更换位置尝试穿刺(回撤或前移)。如登陆区存在严重病变或迂曲,重新寻找相对平直段作为登陆区进行穿刺,同时内膜与真腔之间距离远或组织坚韧者,宜升级穿刺力更强的导丝(如Conquest 8-20导丝)进行穿刺。穿刺导丝头端可根据Stingray球囊与血管真腔的距离进行不同长度的头端塑形,但塑形角度不宜过大,以避免进入侧孔失败或球囊损伤。如内膜下通道距血管真腔较远,可在双腔微导管辅助下重新建立内膜下通道,然后再次启动ADR操作。此外,还可以通过改变穿刺技巧增加穿刺成功率,如穿刺导丝头端越过导丝出口后可采用回撤后快速向前冲刺的方法穿刺(冲击穿刺法)或反复多次穿刺(蜂窝穿刺法)的方式,然后进行导丝交换操作[21]。
5. 5 ADR失败
如果最终ADR失败,术者可以继续进行正向或者逆向的操作。如果这些转换后导丝仍不能进入远端真腔,术者在认真权衡利弊及风险后,可以进行INVESTMENT(或者称为SPM)的操作,期待部分病例6~8周后更简单、更高效开通[22]。
6 ADR的并发症
国内ADR围术期不良事件的整体发生率约为3.4%,与国际报道2.9%~3.4%的结果相似[23-28]。CTO病变介入治疗过程中可能出现的并发症均可在ADR过程中发生,但严重并发症的发生率低于逆向技术。此外,ADR因其夹层再进入的操作可能一定程度增加边支丢失的风险。
6. 1 边支丢失
边支丢失主要是由于内膜下通道过长,重入真腔时跨过较大分支所致,可能引起心肌梗死。RECHARGE研究[25]报道,边支丢失发生率为6.2%,其中16.7%导致心肌梗死。陈根锐等[28]报道87例ADR病例,边支丢失发生率为4.6%。因此,避免在远端登陆区有较大分支的CTO病变中启用ADR技术,将内膜下通道局限于CTO病变体部可降低边支丢失风险。
6. 2 冠状动脉穿孔
目前研究显示ADR术中冠状动脉穿孔发生率为0.8%~9.3%[23-28]。Ellis 1型通常不需要特殊处理,必要时可应用球囊小压力封堵。Ellis 2型及3型风险较高,可尝试球囊封堵、局部栓塞、带膜支架,必要时行心包穿刺、球囊封堵下行心外科修补或冠状动脉旁路移植术[29-30]。
6. 3 围术期心肌梗死
围术期心肌梗死的可能原因包括急性血栓形成、重要边支丢失、血肿压迫或靶血管远端夹层等,必要时需要再次接受血运重建。FAST-CTO研究[23]中围术期非ST段抬高型急性心肌梗死发生率为4.1%。RECHARGE研究[25]中急性心肌梗死发生率为3.4%。PROGRESS研究[24]中急性心肌梗死发生率为1.2%,高于AW术式,0.52%患者接受了再次血运重建。国内陈根锐等[28]与赵林等[31]的研究报道心肌梗死发生率分别为1.1%及2.9%,与国际上同类研究报道相似。
6. 4 其他
其他并发症包括死亡、卒中、心力衰竭、心律失常及器械断裂等。ADR围术期的死亡率较低,2018年PROGRESS研究[24]报道仅0.87%,2020年国内陈根锐等[28]与赵林等[31]的研究报道围术期死亡率分别为1.1%及0.4%,与国外发生率相似。
7 ADR的预后
A DR 预后受病变长度、病变复杂程度、技术选择、启用时机及术者熟练程度等多因素影响[32-33]。2012年FAST-CTO研究[23]中前75例受试者ADR操作成功率67%,后75例操作成功率提高至87%,介入治疗术后造影显示靶病变残余狭窄<50%、心肌梗死溶栓治疗试验(thrombolysis in myocardial infarction,TIMI)前向血流分级Ⅱ~Ⅲ级的患者占比达75%。2017年RECHARGE研究[25]中直接ADR操作成功率为67%,与直接AW的成功率相似,其中Stingray球囊辅助的ADR成功率较高,可达81%。2016年美国多中心登记研究数据显示,ADR总体操作成功率高达86.9%,其中直接ADR组达91.7%[26]。2018年PROGRESS研究[24]中,采用ADR技术的介入治疗术后造影靶病变残余狭窄<30%、TIMI前向血流分级Ⅲ级的患者达89.7%。2020年陈根锐等[28]报道的BridgePoint系统辅助的ADR研究中,ADR(93.1%为补救性ADR)操作成功率达78.2%,部分ADR失败患者可通过正向/逆向技术补救,总体术后TIMI血流分级Ⅲ级患者达88.5%。同年,赵林等[31]采用Stingray LP球囊辅助的ADR研究数据显示,总体ADR成功率达83.5%,其中直接ADR成功率为89%,显著高于补救性ADR的成功率(77.6%),直接ADR和补救性ADR组介入治疗术后造影靶病变残余狭窄≤30%、TIMI前向血流Ⅲ级的患者比例分别为93.7%和91.4%,与国际ADR成功率类似。
英国多中心观察性研究显示,接受“联合(Hybrid)”流程开通的CTO病变患者术后1年主要不良心血管事件(major adverse cardiac events, MACE;包括死亡、心肌梗死、血运重建)发生率为8.6%,其中ADR组与AW组间发生率差异无统计学意义;多因素相关分析显示,唯一与远期预后相关的因素为病变长度[33]。国际多中心的观察性研究显示,ADR术后2年MACE发生率为4.3%~17.5%,其中,血运重建发生率为3.1%~7.7%[7,32],与基于导丝的ADR术式相比,Stingray球囊辅助的ADR术后的远期预后较佳[32]。陈根锐等[28]对ADR术后患者随访17个月的数据显示MACE发生率为17.4%。
8 总结与展望
欧美、亚太及中国的CTO病变介入治疗推荐流程均包括正向、逆向和ADR三大支柱技术[1,2,10-14]。在合适的病例中、适合的时机启用ADR技术可提高CTO病变介入治疗成功率和效率。目前,国内ADR技术应用受限的主要原因在于术者低估了ADR的实用性,顾忌内膜下长度过长和边支闭塞风险,往往将其视为常规正向和逆向技术失败后的补救方法。相信随着国内术者理念的进步、专用器械的引入、技术的推广及改进,在融合了欧美高效快速及日本精细操控导丝的特点后,中国必将积累自己独特的操作经验,并逐步形成高效快速、简易可重复的ADR操作流程。未来,中国心血管介入医师将面临越来越多的复杂病变,掌握ADR技术将是处理复杂CTO病变的必备技能。期望本共识可帮助国内冠状动脉介入医师尽快掌握ADR技术,丰富开通CTO病变的手段,提高CTO病变介入治疗成功率和效率,改善CTO病变患者的临床预后。
写作组成员(按姓名汉语拼音排序):葛雷(复旦大学附属中山医院),贺勇(四川大学华西医院),金泽宁(首都医科大学附属北京天坛医院),李成祥(空军军医大学第一附属医院),李妍(解放军空军军医大学第二附属医院),李悦(哈尔滨医科大学第一附属医院),罗建方(广东省人民医院),马剑英(复旦大学附属中山医院),赵林(首都医科大学附属北京安贞医院)
专家组成员(按姓名汉语拼音排序):陈纪言(广东省人民医院),陈晓敏(宁波市第一医院),陈勇(四川大学华西医院),陈竹君(广东省人民医院),窦克非(中国医学科学院阜外医院),傅国胜(浙江大学医学院附属邵逸夫医院),葛均波(复旦大学附属中山医院),谷国强(河北医科大学第二医院),郭军(解放军总医院心血管病医学部),韩雅玲(解放军北部战区总医院),贺玉泉(吉林大学中日联谊医院),霍勇(北京大学第一医院),蒋峻(浙江大学医学院附属第二医院),荆全民(解放军北部战区总医院),李留东(烟台毓璜顶医院),李宇(首都医科大学附属北京安贞医院),柳景华(首都医科大学附属北京安贞医院),陆浩(复旦大学附属中山医院),陆阳(海军军医大学第一附属医院),马根山(东南大学附属中大医院),牛铁生(中国医科大学附属盛京医院),庞文跃(中国医科大学附属盛京医院),彭红玉(首都医科大学附属北京安贞医院),邱春光(郑州大学第一附属医院),仇兴标(上海胸科医院),仇玉民(宁夏医科大学总医院心脑血管病医院),汝磊生(解放军联勤保障部队九八〇医院),宋雷(中国医学科学院阜外医院),唐熠达(北京大学第三医院),汪奇(解放军总医院心血管病医学部),王耿(解放军北部战区总医院),王勉(四川大学华西医院),吴永健(中国医学科学院阜外医院),吴铮(首都医科大学附属北京安贞医院),修建成(南方医科大学南方医院),杨海波(郑州大学第一附属医院),姚康(复旦大学附属中山医院),张必利(海军军医大学第一附属医院),张斌(广东省人民医院),张力(上海交通大学医学院附属新华医院),张勇(陕西省人民医院),赵杰(中国医学科学院阜外医院),赵玉英(解放军联勤保障部队九八〇医院),郑金刚(中日友好医院),周斌全(浙江大学医学院附属邵逸夫医院)
利益冲突 所有作者均声明不存在利益冲突

