烟草单萜合酶基因NtTPS2的克隆及功能鉴定
刘少华 赵希胜,2 杨晴 杨长青 潘旭浩 张建会 杨爱国 李依婷
(1. 中国农业科学院烟草研究所,青岛 266100;2. 四川农业大学农学院,成都 611130;3. 四川省烟草科学研究所,成都 610041)
在植物体内,萜类物质主要通过两条相对独立的代谢途径合成,即位于细胞质中的甲羟戊酸(mevalonate pathway,MVA)途径和位于质体中的甲基赤藓醇4-磷酸(methylerythritol-4-phosphate pathway,MEP)途径。萜烯合酶(terpene synthase,TPS)是催化形成萜类骨架的关键酶[7]。根据催化机理和形成产物的不同,萜烯合酶被分为Ⅰ类(ClassⅠ)和Ⅱ类(ClassⅡ)[8-9]。其中单萜合酶属于Ⅰ类萜类合酶,包含保守的DDxxD和NSE/DTE结构域,其中的氨基酸残基通过结合二价金属离子来促进异戊二烯焦磷酸基团的电离[10-11]。拟南芥中有多个萜类合酶参与单萜和倍半萜类化合物的生物合成[12-14],其产物对吸引昆虫授粉及在植物抵御病原体的入侵中有重要作用[15]。葡萄中已有多个单萜合酶和倍半萜合酶被克隆和功能鉴定,其中包括α-松油醇合成酶,对葡萄繁殖和品种改良具有重要意义[16]。除此之外,萜烯合酶还参与植物对各种生物胁迫和非生物胁迫的响应,如庞强强等[17]对大白菜高温胁迫前后不同组织和持续高温胁迫下叶片的表达分析,发现大部分BrTPS可对高温胁迫产生响应;水稻松油烯合酶OsTPS24参与水稻茉莉酸诱导引发对白叶枯病菌的抗性[18];OsTPS18参与合成的橙花叔醇可明显抑制白叶枯病菌的生长[19]等。
茄科植物烟草的次生代谢产物丰富,遗传转化和表达体系完善,是研究植物次生代谢的理想植物。目前,烟草萜类物质生物合成途径上游MVA和MEP途径中的关键合成酶基因已被相继报道,如1-脱氧木糖-5-磷酸合酶(1-deoxy-D-xylulose 5-phosphate synthase,DXS)、3-羟基-3-甲基戊二酸单酰辅酶A还原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMGR)、牻牛儿基牻牛儿基焦磷酸合酶(geranylgeranyl pyrophosphatesynthase,GGPPS)、法尼基焦磷酸合酶(farnesyl diphosphate synthase,FPPS)等,但是对合成途径下游的关键萜烯合酶基因的研究鲜有报道。在普通栽培烟草中,共有68个TPS基因家族成员[20],但目前已鉴定并明确功能的寥寥无几。对烟草萜烯合酶基因的分离鉴定不仅可以完善烟草萜类物质生物合成途径,还能够为异源合成烟草萜类天然产物提供基础元件。
本研究从烟草中克隆了一个定位在质体中的萜烯合酶基因NtTPS2,利用qRT-PCR分析其时空表达模式和对逆境胁迫的响应,并通过大肠杆菌代谢工程鉴定NtTPS2的生化功能,为烟草萜类天然产物的生物合成机理研究提供理论基础。
1 材料与方法
1.1 材料
试验所用材料普通栽培烟草品种K326(Nicotiana tabacum L.)由国家烟草种质资源中期库提供。载体质粒pYJM26与pYJM14由中国科学院青岛生物能源与过程研究所馈赠;Plant Total RNA Kit购自北京庄盟国际生物基因科技有限公司;Transcript Green One-Step qRT-PCR Supermix、2×Phanta Max Master Mix和2×ChamQ SYBR Color qPCR Master Mix购自南京诺唯赞生物科技股份有 限 公 司;pEASY-Blunt Zero Cloning kit、DH5α Chemically Competent Cell、BL21(DE3)Chemically Competent Cell、EasyPure Quick Gel Extraction kit、DNA凝胶试剂盒,购自北京全式金生物技术有限公司;试验所用内切酶与连接酶均购自NEB(北京)有限公司。
LB培养基(g/L):10.0 g蛋白胨、5.0 g酵母粉、10.0 g NaCl,pH 7.0,用于大肠杆菌的培养。
发 酵 培 养 基(g/L):5.0 g酵 母 浸 粉,1.0 g NH4Cl、15.2 g Na2HPO4·12H2O、3.0 g KH2PO4、0.5 g NaCl、0.48 g MgSO4·7H2O、20 g 葡萄糖,用于大肠杆菌的发酵。
1.2 方法
1.2.1 NtTPS2的克隆及序列分析 萜烯合酶在植物抗逆境胁迫过程中发挥着重要作用。通过对干旱和低温胁迫处理的烟草转录组测序数据的分析筛选,获得NtTPS2转录本序列并设计特异性引物NtTPS2-F和NtTPS2-R(表1)。使 用Plant Total RNA Kit提取烟草叶片总RNA,用超微量分光光度计测定RNA的浓度和纯度,利用Transcript Green One-Step qRT-PCR Supermix试剂盒反转录,合成cDNA作为基因克隆的模板。使用引物NtTPS2-F和NtTPS2-R,以烟草cDNA为模板进行PCR扩增,反应体系为cDNA 2 μL、2×Phanta Max Master Mix 25 μL、NtTPS2-F和NtTPS2-R引 物 各2.5 μL,补充ddH2O 18 μL。反应程序为94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,35个 循 环;72℃ 5 min。PCR产物用1%琼脂糖凝胶电泳检测、纯化后,连入pEASY-Blunt Zero Cloning kit载体,转入大肠杆菌DH5α感受态细胞,转化子用含有卡那霉素(50 mg/L)的LB固体培养基进行筛选培养12 h,挑取单克隆进行菌液PCR验证,阳性克隆进行双向测序,获得含有NtTPS2序列的阳性质粒Blunt-NtTPS2。
对照组患者单独采用胺碘酮进行治疗,首次剂量为150 mg,溶于20 mL0.9%氯化钠溶液中,10 min内静脉滴注完成,间隔15 min后可重复用药。根据患者病情变化,可适当减少给药剂量。静脉给药停止后,改口服胺碘酮,每天600 mg,联用7d后,改药量为每天400 mg,同样服药7 d;观察组患者在此基础上,联合服用倍他乐克缓释片,口服,每次11.875 mg,每天服药1次,观察无明显不良反应后,则每2周增加药量,达到目标剂量后可长期口服。
利 用ORF finder(http://www.bioinformatics.org/sms2/orf_find.html)软件分析NtTPS2开放阅读框及氨基酸序列;利用在线程序PSORT II Prediction(https://www.genscript.com/psort.html)预 测NtTPS2蛋白的亚细胞定位;使用InterProScan(https://www.ebi.ac.uk/interpro/search/sequence/)软件对NtTPS2蛋白保守结构域进行预测,利用MEGA7软件邻接(NJ)法构建系统发育进化树,Bootstrap值设定为1 000。1.2.2 NtTPS2的组织与时空表达模式 分别提取盛花期烟草根、茎、上部叶、中部叶、下部叶、花瓣、雄蕊和雌蕊的总RNA,反转录后,进行qRT-PCR分析。根据NtTPS2序列设计特异性引物NtTPS2-qF和NtTPS2-qR(表1),以烟草Actin为内参,利用2×ChamQ SYBR Color qPCR Master Mix进行PCR反应。试验设置3次生物学重复,2次技术重复。采用2-△△CT方法计算NtTPS2的相对表达量。
1.2.3 不同非生物胁迫处理下NtTPS2的表达分析 将K326种子用75%酒精消毒20-30 s,灭菌ddH2O清洗1遍,用15%过氧化氢溶液浸泡8-10 min,灭菌ddH2O清洗3遍后,播种于1/2 MS固体培养基中。在光照培养箱(16 h光照/8 h黑暗)中培养至两叶一心,移至1/2 MS液体培养基中培养4周后,分别移入200 mmol/L NaCl、1.0% PEG、4℃、10 μmol/L ABA进行处理。其中,NaCl处理分别在0、1、3、6、12和24 h取样;4℃处理分别在0、3、6和12 h以及1、3和7 d取样;PEG和ABA处理分别在为0、6、12、24、48和72 h取样,每个处理3个生物学重复。每个样品取样完成后液氮速冻,-80℃保存备用。
1.2.4 NtTPS2的亚细胞定位 根据NtTPS2的全长CDS序列(去掉终止密码子)设计带有Bsa I酶切位点的引物NtTPS2∷gfp-F和NtTPS2∷gfp-R(表1),以Blunt-NtTPS2为模板进行PCR扩增、回收。利用Bsa I对pBWA(V)HS-GLosgfp表达载体和NtTPS2回收片段进行酶切,用T4 DNA连接酶进行连接反应。连接产物转化大肠杆菌DH5α感受态细胞,单克隆经PCR及测序验证,获得NtTPS2融合GFP的重组质粒pBWA(V)HS-TPS2-GLosgfp。将重组质粒和对照空载质粒pBWA(V)HS-Glosgfp分别转化农杆菌GV3101。阳性农杆菌菌株经活化和扩大培养后,收集菌体重悬于烟草注射缓冲液(0.2 mmol/L乙酰丁香酮、10 mmol/L MES和10 mmol/L MgCl2)中,调整OD600值为0.7-1.0。重悬液于室温静置2-4 h后,用1 mL注射器在本氏烟(Nicotiana bentamiana)中部叶片背面注射。注射后的烟草置于28℃温室中培养2 d后,在LEICA TCS SP8激光共聚焦显微镜下观察侵染的叶片,确定荧光融合蛋白的定位。

表1 NtTPS2基因克隆、载体构建及qPCR引物Table 1 Primers for NtTPS2 gene cloning,vector construction and qPCR
1.2.5 NtTPS2工程大肠杆菌构建和发酵 将NtTPS2连接到pYJM26质粒的BglII和XhoI双酶切位点之间,得到重组质粒NtTPS2-pYJM26。pYJM26质粒,即pACY-mvaE-mvaS-GPPS2质粒,携带来源于粪肠球菌(Enterococcus faecalis)的乙酰辅酶A酰基转移酶基因/羟甲基戊二酰辅酶A还原酶基因(mvaE,GenBank No. AAG02438)、3-羟基-3-甲基戊二酰辅酶A合酶基因(mvaS,GenBank No. AAG02439),以及来源于北美冷杉(Abies grandis)的牻牛儿基焦磷酸合成酶基因(GPPS2,GenBank No. AF513112.1)的pACYCDuet-1。参 考Yang等[21]的 方 法 构 建pYJM26质粒载体。以含有NtTPS2 CDS序列的Blunt-NtTPS2质粒为模板,采用NtTPS2-pYJM26-F和NtTPS2-pYJM26-R进行PCR扩增和基因片段回收。将所得NtTPS2片段与pYJM26质粒分别用Bgl II和Xho I进行双酶切,将载体与外源片段进行连接,得到重组质粒NtTPS2-pYJM26。
将质粒NtTPS2-pYJM26和质粒pYJM14共同转化E.coli BL21(DE3)感受态细胞,37℃过夜培养后,得到合成香叶醇的大肠杆菌工程菌。pYJM14质粒,即pTrc-low质粒,携带来源于酿酒酵母(Saccharomyces cerevisiae)的甲羟戊酸激酶基因(ERG12,GenBank No. NM_001182715.1)、甲羟戊酸-5-磷酸激酶基因(ERG8,GenBank NO. NM_001182727.1)、甲羟戊酸-5-二磷酸脱羧酶基因(ERG19,GenBank NO. X97557.1)、异戊烯焦磷酸异构酶基因(IDI1,GenBank NO. NM_001183931.1)的pTrcHis2B。参考Yang等[22]的方法构建pYJM14质粒载体。
挑取平板上的单克隆接种于LB液体培养基中,37℃培养8 h后,将一级种子液按1∶50接种到发酵培养基中,37℃培养至OD600为0.6时添加终浓度为0.3 mmol/L的IPTG,30℃诱导表达继续发酵48 h。
1.2.6 分析检测 取发酵液2 mL,12 000 r/min离心1 min,取上清1 mL加入等体积乙酸乙酯于涡旋振荡器上混匀5 min,然后静置10 min,取上层有机相进行过滤后,使用气相色谱-质谱联用仪(GC-MS,岛津TQ8050)检测发酵产物中天然成分的含量。色谱柱为HP-INNOWAX毛细管柱(30 m × 0.25 mm× 0.25 μm),柱室温度50℃起步以10℃/min的速度升温至250℃,保温5 min,气化室和检测室温度均为250℃。
1.2.7 数据分析 试验数据采用SPSS 17.0软件进行单因素方差分析,由新复极差法分析均值差异的显著性。
2 结果
2.1 NtTPS2的克隆及生物信息学分析
以烟草叶片总RNA反转录获得的cDNA为模板,利用NtTPS2-F和NtTPS2-R为引物进行PCR扩增,获得全长为1 854 bp片段,命名为NtTPS2(图1)。NtTPS2编码617个氨基酸,其中强酸性氨基酸81个,碱性氨基酸75个,pI为6.35,蛋白分子量为71.73 kD。利用InterProScan在线软件对其氨基酸序列进行分析,结果表明,NtTPS2具有2个萜烯合成酶基因家族的保守结构域。其中第68-255位氨基酸为萜类合酶N末端区域;第282-606为萜类合酶金属离子结合结构域(图2)。
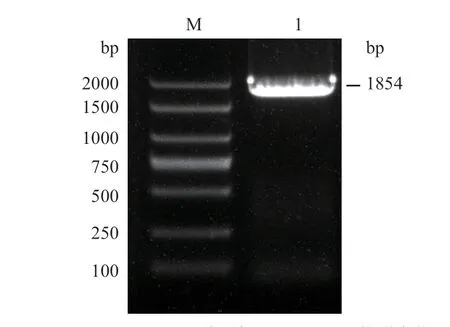
图1 NtTPS2的PCR扩增Fig.1 PCR amplification of NtTPS2
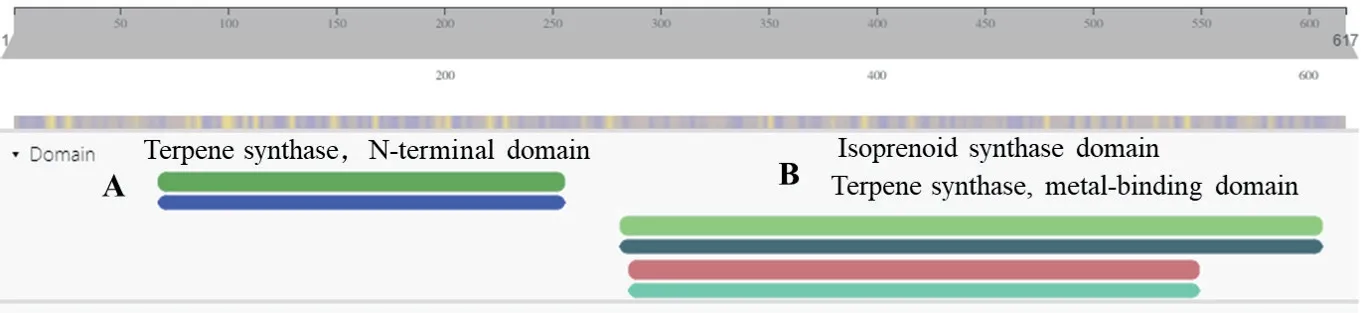
图2 NtTPS2蛋白的保守结构域预测Fig.2 Prediction of the conserved domain of NtTPS2 protein
通过在线程序PSORT II Prediction对NtTPS2蛋白进行亚细胞定位预测,结果显示NtTPS2在叶绿体、线粒体和质体中定位的概率分别为57.14%、28.57%和14.29%,因此,该蛋白可能是位于叶绿体中。
利用GenBank数据库蛋白比对程序BLASTP对NtTPS2进行比对分析,选择与NtTPS2相似度高的萜烯合酶基因,利用DNAMAN软件进行多序列比对分析,结果(图3)表明,NtTPS2与已知的萜烯合酶基因蛋白序列具有较高的相似性,且含有萜类合酶催化活性位点“DDxxD”以及NSE/DTE功能域(N,D)D(L,I,V)X(S,T)XXXE。

图3 NtTPS2与其他植物萜烯合酶基因的多序列比对Fig.3 Multiple sequence alignment of NtTPS2 and other plant terpene synthase genes
为分析NtTPS2与其他物种萜烯合酶基因间亲缘关系,通过MEGA7等软件对NtTPS2进行系统发育进化树分析。结果(图4)表明,NtTPS2与矮牵牛、柠檬及柑橘等物种中的单萜合酶基因聚为同一簇,其中与矮牵牛的亲缘关系最近,同源性为69.57%,与倍半萜和二萜合酶基因的遗传距离较远,推测其可能为一个单萜合成酶。
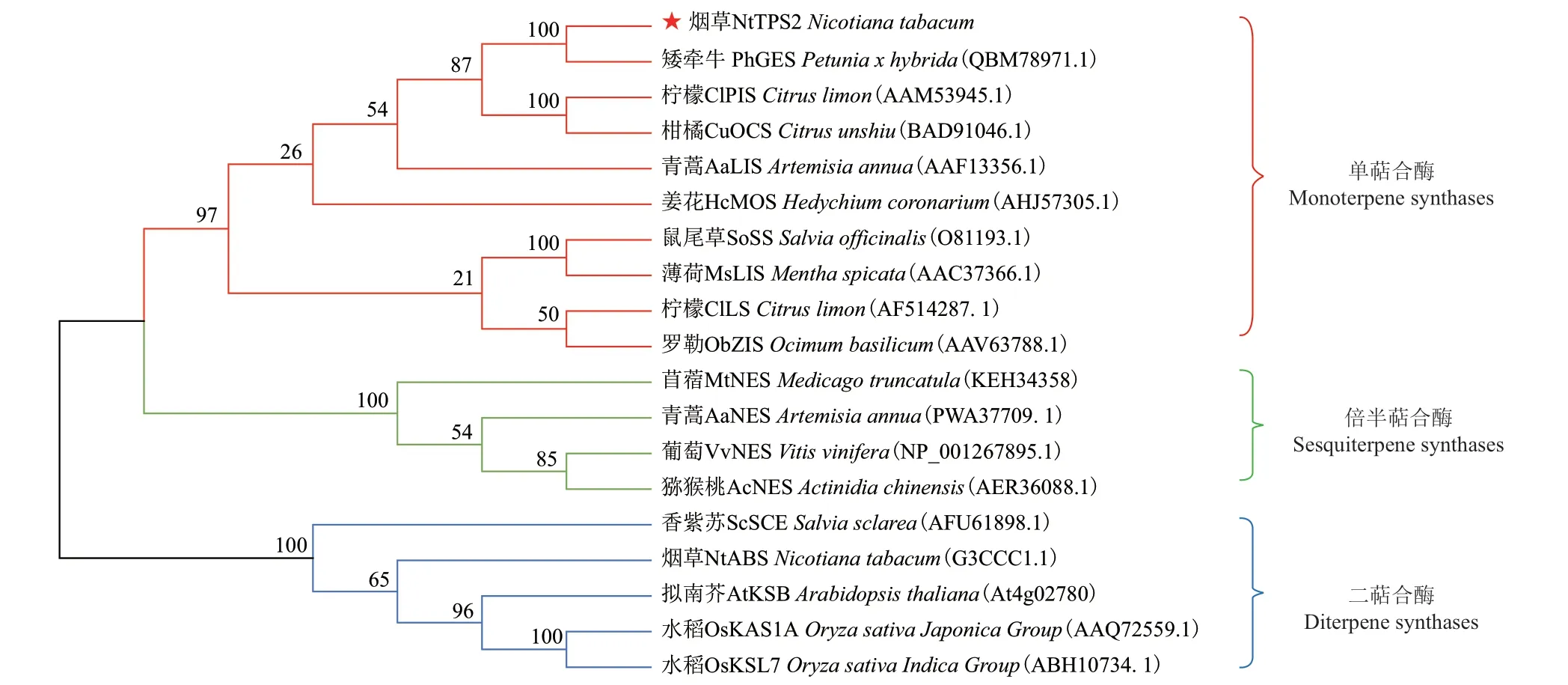
图4 NtTPS2与其他物种萜烯合酶系统发育进化树分析Fig.4 Phylogenetic tree analysis of NtTPS2 and terpene synthase of other species
2.2 NtTPS2亚细胞定位
基因的亚细胞定位对研究该基因编码的蛋白及行使功能的场所至关重要。将含有NtTPS2融合GFP的植物表达载体和仅表达GFP的对照载体分别在本式烟叶片中瞬时表达,通过激光共聚焦显微镜观察发现NtTPS2编码的蛋白产物定位在叶绿体中(图5),这一结果与NtTPS2蛋白的亚细胞定位预测结果一致。
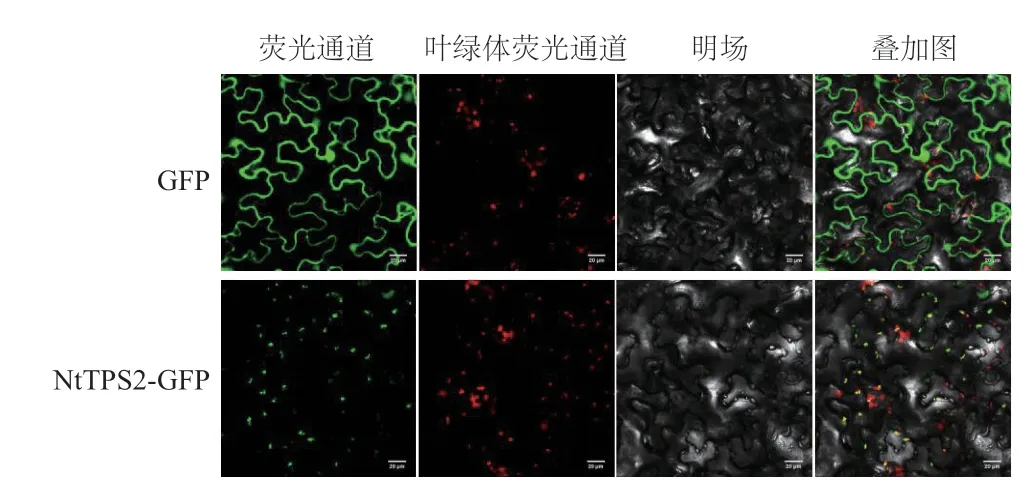
图5 NtTPS2的亚细胞定位Fig.5 Subcellular localization of NtTPS2
2.3 NtTPS2的组织表达分析
利用qRT-PCR技术分析NtTPS2在烟草盛花期各个组织中的相对表达量。结果表明,NtTPS2在烟草各个组织部位均有表达,在根部和雌蕊中的表达量显著高于茎、叶、花瓣和雄蕊(图6)。

图6 NtTPS2的组织表达模式分析Fig.6 Tissue expression pattern analysis of NtTPS2
2.4 NtTPS2对逆境胁迫的响应
萜类化合物在植物抗逆胁迫中发挥着重要的作用。为明确NtTPS2是否参与了烟草抗逆胁迫过程,对普通烟草K326进行了不同逆境胁迫处理,通过qRT-PCR技术对NtTPS2的表达模式进行分析(图7),发现在200 mmol/L NaCl处理下,NtTPS2表达量在6 h内迅速上调,随后降低,但12 h时表达量仍显著高于对照(0 h);4℃低温处理下,NtTPS2表达量在6和12 h被快速诱导,随后急剧下降,7 d后已显著低于对照(0 h);10 μmol/L ABA处理下,NtTPS2表达量在6 h内逐渐下调,随后表达丰度上升,整个处理过程中表达量始终显著低于对照;用1% PEG模拟干旱胁迫,NtTPS2表达量在48 h内逐渐上调,48 h时出现峰值,随后下调,到72 h时表达丰度与对照相比没有显著性差异。
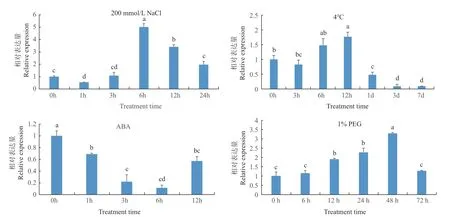
图7 不同逆境胁迫下NtTPS2的表达模式分析Fig.7 Expression analysis of NtTPS2 under different stresses
2.5 NtTPS2的生化功能鉴定
以大肠杆菌BL21(DE3)为宿主菌,通过代谢产物分析,鉴定NtTPS2的生化功能。工程菌株经摇瓶发酵培养后,用等体积乙酸乙酯萃取、离心,取上层有机相过滤后用GC-MS检测发酵产物。对GC-MS总离子色谱图的分析结果表明,与对照菌株相比,表达了NtTPS2的工程菌株在5.5和5.8 min产生了2种新化合物,谱库检索表明可能是香叶醇和橙花醇。进一步利用香叶醇、橙花醇的标准品进行比对,二者的保留时间和质谱数据均一致,表明NtTPS2能够以GPP为底物生成香叶醇和橙花醇(图8)。
3 讨论
植物单萜合酶催化底物GPP释放焦磷酸基团,并形成结构不同的单萜类化合物。本研究从烟草中克隆获得了一个萜烯合酶基因NtTPS2,其包含一个完整的ORF,长度为1 854 bp,编码617个氨基酸的蛋白质。序列分析表明,NtTPS2与其他植物的萜类合酶蛋白具有较高的保守性,都含有保守的DDxxD和NSE/DTE结构域,该区域能与金属离子结合,催化萜类化合物的生物合成,属于典型的I类萜烯合酶[23]。对NtTPS2亚细胞定位的预测和试验均表明,NtTPS2定位于叶绿体中,与大部分单萜合酶的亚细胞定位相一致。进化分析结果显示NtTPS2与单萜合酶聚为一类,推测其可能参与烟草中单萜类化合物的生物合成。通过以大肠杆菌为底盘的微生物代谢工程对NtTPS2生化功能的鉴定,进一步证实了NtTPS2是一个单萜合酶,能够以GPP为底物合成单萜类化合物香叶醇及其异构体橙花醇,是一个香叶醇合成酶(geraniol synthase,GES)。目前编码GES的基因已在多个物种中被分离和鉴定,如长春花、罗勒、紫苏、藿香和甜舌草等。但是不同GES基因的表达模式和酶活性却不尽相同,暗示GES基因在不同物种间的生物学功能存在特异性。
已有的研究表明,萜类化合物在植物抵御逆境胁迫、吸引昆虫授粉和趋避害虫等过程中发挥着重要作用。如大豆TPS家族基因可能参与花与根的生长发育[24];过表达水稻TPS1基因能提高水稻对干旱、高盐及低温等逆境的胁迫[25];冬小麦TPS基因参与其低温信号转导过程等[26]。对NtTPS2表达模式的分析发现,NtTPS2的表达具有一定的组织特异性,在根部和雌蕊中的表达量相对较高,且强烈响应低温、干旱和高盐等逆境胁迫和ABA信号,暗示着其可能负责烟草根部和雌蕊中香叶醇和橙花醇类挥发性单萜物质的生物合成,在烟草抵御非生物逆境胁迫和授粉生殖等生理过程中发挥着重要作用。
近年来,人们对萜类代谢途径及其调控机理研究的不断深入,使得代谢工程成为研究萜类合酶基因及萜类化合物生物合成的有效手段[27]。王诗语等[28]以大肠杆菌为底盘细胞,利用合成生物学手段导入外源杂合蒎烯合成途径,构建了合成蒎烯的微生物工程菌株;袁雪峰等[29]研究表明,通过构建虾青素合成相关基因工程菌的发酵试验,明确了虾青素的生物合成路径,并进一步提高了虾青素的产量和纯度;李瑜等[30]利用发酵罐高密度培养番茄红素生物合成工程菌,并通过优化培养条件及工艺,获得产量大幅提高的番茄红素。本研究通过在大肠杆菌中优化萜类物质生物合成途径,并表达烟草单萜合成酶基因NtTPS2,利用基因工程手段构建了以葡萄糖为原料合成香叶醇和橙花醇的工程菌株代谢途径,为进一步研究烟草单萜类化合物的生物合成提供理论依据和基础元件。
4 结论
烟草NtTPS2是一个单萜合成酶基因,包含1 854 bp的ORF,编码617个氨基酸。该蛋白具有萜烯合酶典型的保守结构域及催化活性功能域。NtTPS2定位于叶绿体中,具有组织表达特异性,受非生物胁迫和植物激素ABA信号诱导。NtTPS2能够以GPP为底物催化合成香叶醇和橙花醇。

