CRISPR-Cas系统在核酸检测中的应用研究
胡秀文 刘华 王宇 唐雪明,5 王金斌 曾海娟 蒋玮 李红
(1. 上海海洋大学食品学院,上海 201306;2. 上海农业科学院生物技术研究所,上海 201106;3. 兰州理工大学生命科学与工程学院,兰州730050;4. 上海市农业遗传育种重点实验室,上海 201106;5. 上海交通大学农业与生物学院,200240;6. 上海市农业科学院畜牧兽医研究所,上海 201106)
核酸检测技术在诊断感染、遗传疾病和癌症方面具有至关重要的作用,因此核酸检测技术得到了快速发展[1]。其中几种主要以PCR为基础的核酸检测技术已被用于病原体检测[2],但需要昂贵的试剂和设备,以及熟练的人员。恒温扩增方法也被应用到核酸检测方面[3],由于设备和应用技术的制约等因素,阻碍了核酸检测的现场速测应用[4]。因此开发灵敏、快速和特定的传感工具对于诊断检测至关重要。而目前发现的CRISPR-Cas(clustered regularly interspaced short palindromic repeats)系统基于其准确识别和切割特定DNA和RNA序列的能力,已被用于基因组编辑[5-6],展示了其强大的分子检测潜在能力,成为了开发新的检测平台的热点。
CRISPR系统是细菌及古细菌利用Cas效应蛋白在crRNA引导下抵御外源核酸入侵的一种获得性免疫防御系统。研究人员在大肠杆菌基因组中发现具有重复DNA序列的的遗传结构,该结构是由CRISPR基因座,DNA靶向间隔序列以及编码crRNA(crispr RNA)组分和Cas蛋白操纵子的组分构成,称之为CRISPR-Cas系统[7]。它能将入侵的噬菌体、质粒和转座子的移动遗传元件(MGES)作为自己的间隔区序列,构成了细菌和古细菌适应性和遗传免疫的基础[8]。在自然条件下的CRISPR-Cas系统中,包括Cas12[9]、Cas13[10]和Cas14[11]及其同源物,会表现出间接的非特异性催化活性,可用于核酸检测,例如通过降解标记的核酸产生荧光信号[12]。检测灵敏度高,达到10-18mol/L[13]的aM级别。这些系统借助体外扩增技术以及横向流动测试条系统,实现低价、高灵敏度、现场可检测的诊断方法,在人类健康到农业都有着广泛的应用,为更加方便、快捷的检测各种疾病提供了技术支撑。本文主要介绍了CRISPR-Cas的相关机制,以及在核酸检测的应用状况,旨为开发新型检测平台提供理论依据。
1 CRISPR-Cas系统的多样性与分类
CRISPR系统是基因编辑技术中编辑核苷酸的有效工具,与编码Cas蛋白的相关基因组合形成CRISPR-Cas系统。根据所结合的Cas蛋白不同,其发挥的功能不同,主要可以将CRISPR-Cas系统分为两类[14],其中第一类是多种Cas蛋白复合体,主要分为I型、III型和IV型。第二类为单一蛋白效应模块,主要包括II、V、VI。II型[15]系统的主要特征蛋白Cas9作为核酸酶行使切割能力修饰靶序列,现已广泛用于许多领域,包括基础研究方向、食品作物开发、药物开发和人类基因组工程等。V型[16]CRISPR-Cas系统的主要特征蛋白包括Cas12和Cas14。Cas12能够诱导双链DNA(dsDNA)切割位点的细胞发生遗传变化,而且可以用于哺乳动物的基因编辑。Cas14是从古细菌中发现的新的核酸酶,它仅存在古细菌中,与Cas9、Cas12具有相似的结构域,但功能有所差异[17]。VI型CRISPR-Cas系统使用Cas13核酸酶,该酶具有特征性的较高的真核和原核核苷酸(HEPN)结合结构域[18],特异性的作用于RNA靶序列,发挥特异性识别和非特异切割的功能。除此之外,CRISPR系统都可以利用靶向切割与体外扩增相结合,从而用于快速检测DNA和RNA,达到快速检测的目的[19],具有良好的应用前景。
2 CRISPR-Cas核酸检测工具
2.1 CRISPR-Cas9技术概述
CRISPR-Cas9属 于CRISPR II型 系 统,含 有HNH和RuvC结构域,是由Cas9蛋白、tracrRNA与crRNA一起组合对目的基因进行编辑。Cas9能够识别质粒和噬菌体的原型间隔序列毗邻基序(PAM)[20]NGG序 列,然 后crRNA-tracrRNA复 合体与cDNA配对,从而导致Cas9对目标DNA进行双链切割。其中crRNA-tracrRNA复合物可以合成向导RNA(sgRNA)来直接引导该系统识别目标序列。CRISPR-Cas9可以与光学DNA定位结合起来以鉴定细菌抗生素抗性基因[21];另外,将CRISPR-Cas9与DNA荧光原位杂交(FISH)结合以检测耐甲氧西林的金黄色葡萄球菌(MRSA)[22]。
Cas9核酸酶的两个结构域发生突变后会没有活性即为dCas9(dead Cas9),可用于调节基因转录,可以结合DNA而不将其裂解,基于此特点开发了一种dCas9的体外DNA检测系统。该系统以高特异性和高灵敏度检测结核分枝杆菌DNA[23]。目前的研究显示,使用Cas9来切割DNA也存在一些问题。如在切割过程中目标序列识别不准确容易导致突变,而且双链断裂引起的大片段碱基缺失,并因此导致临床应用的严重后果等。另外,该系统需要crRNAtracrRNA复合物来识别靶核酸,比其他类别识别复杂一些。
2.2 CRISPR-Cas12技术概述
CRISPR相 关 蛋 白Cas12a,是 第 二 类V型CRISPR系统RNA引导的一种核酸内切酶、具有附带的裂解活性,也含有RuvC结构域,并在crRNA引导下切割PAM(TTTN)序列下游18-25 nt的靶DNA。Casl2a在crRNA的介导下靶向结合dsDNA,形成了三元复合物,激活了非特异性ssDNA反式裂解活性[24]。基于Cas12a 这一特殊性质,将Casl2a反式切割活性与等温扩增相结合的方法,开发了一种新DNA检测方法—DETECTR(DNA endonuclease targeted CRISPR trans reporter)[25-26]。该 系 统 结 合重组聚合酶扩增(RPA)技术与荧光报告系统,对靶DNA进行恒温扩增,然后Cas12a在crRNA引导下作用于扩增的靶DNA,裂解淬灭的ssDNA报告基因,产生荧光信号。现已将该系统应用到转基因检测中[27],实现了对转基因产品及其制品快速灵敏的检测,其DNA检测的灵敏度能达到aM级;在医疗诊断检测上可以对人乳头瘤病毒(HPV)患者的样本检测分析[28]。赵国屏团队利用Cas12a以及荧光报告系统,成功开发了高灵敏核酸检测方法HOLMES[25](an one-hour low-cost multipurpose highly efficient system),用于目标DNA和RNA的快速检测,该方法实现检测SNP位点,以及对DNA病毒(伪狂犬病病毒)以及RNA(乙型脑炎)病毒检测,暗示着Cas12a在核酸检测领域的应用前景。但是,该方法也存在一些缺点,如反应温度高、SNP检测序列受限、灵敏度可能降低等。为了检测更加方便,基于Cas12a切割机制,开发了一种新型的一体式工具箱,具有精确和超灵敏性(OCTOPUS)平台[29],成功应用于食源性病原体检测,为食品安全提供了保障。通过研制的CRISPR-Cas12a生物传感器实现对乌拉西-DNA糖酶(UDG)和T4多核苷酸激酶(T4 PNK)的超敏感检测[30],而且可作为确定包括单细胞解氧和人体血浆在内的真实样品的强大工具箱[31],证明良好的实际应用能力。
随着对Cas不断深入的探究,Cas12的另一个常用核酸蛋白Cas12b被发掘出来,它含有单个的RuvC结构域,脱靶效率低,能在哺乳动物和人类中进行有效的基因的编辑[32]。同时也显示出相同的DNA 反式切割活性,根据此特性,创建了HOLMES的改进版本(称为HOLMESv2)[33]。在HOLMESv2系统中,Cas12b可以和各种恒温扩增相结合,并将扩增与Cas12b检测两个独立的步骤整合到一个系统中特异性区分单核苷酸多态性(SNP),避免了交叉污染,用最少的设备提供超灵敏和特异的DNA检测的潜力。为了更加快速准确的检测,将Cas12a 与Cas12b效应器与LAMP整合在一起,以开发一种超灵敏的特异性侧向流生物传感器(LFB),用于检测铜绿假单胞菌(P. aeruginosa)[34]。但是目前该系统无法直接检测RNA分子,需要对RNA进行逆转录,增加了检测的复杂程度,会影响检测结果。
2.3 CRISPR-Cas13技术概述
Cas13[35]是VI型CRISPR系统相关的蛋白,是RNA引导和RNA靶向的核糖核酸酶(RNase)蛋白家族[36],Cas13含有2个发散的HEPN结构域[37],可以在具有Protospacer侧翼位点(PFS)的靶标RNA的单链区域中产生多个切割位点。且Cas13[38]还表现出靶标依赖性的混合RNase活性,导致非靶标RNA分子的反式切割。Cas13可以实现RNA编辑,如RNA碱基编辑技术(REPAIR)[39]。另外该系统在核酸检测和疾病诊断中也显示出独特而广泛的用途,是开发快速检测工具的研究热点之一。
目前研究人员对于Cas13a核酸蛋白研究较多,基于其附属切割的特点建立了SHERLOCK[40](特定的高灵敏度酶报告解锁)平台,并将恒温扩增与Cas13a相结合来检测RNA分子。SHERLOCK程序在运行的过程中主要分为4个阶段,分别为试剂制备、样品提取、核酸恒温预扩增和CRISPR-Cas13核酸检测[41]。该系统依赖于RNA荧光报告探针对信号的级别放大,再借助T7转录结合重组聚合酶扩增[42]实现了对信号的二次放大,提高了该方法的灵敏度,对病毒核酸实现了单分子灵敏度和单碱基特异性检测。为此通过结合CRISPR-Cas13a系统和催化组件(CHA),建立了非编码小RNA分子(miRNA)的超敏电化学生物致敏平台[43]。
通过Cas13a与荧光报告基团或横向流动试纸条结合,形成了Cas13a系统,并成功在现场检测到犬细小病毒2型(CPV-2)[44];能够检测血浆EB病毒(epstein-barr virus)DNA,进而有助于筛查和监测鼻咽癌及其他EBV相关疾病[45]。Gootenberg等[46]将SHERLOCK方法修改,开发了SHERLOCKv2平台,该平台结合Cas13a与辅助CRISPR-III型相关核酸酶Csm6[47]使信号灵敏度提高了3.5倍。在多功能、快速、便携和经济高效的核酸检测上,具有全分子敏感性和单碱基检测特异性,为基础设施欠发达地区的流行病监测和病原体检测提供了技术支持。为了避免污染,引入未提取的诊断样品加热以消除核酸酶(HUDSON)[41]方案,可以直接从临床样品中检测病毒核酸,达到以极高的灵敏度检测全血、血清和唾液中的病毒。根据CRISPR-Cas13系统的反式切割活性而建立的检测平台成功应用多个领域,但在哺乳动物细胞中对宿主转录组的非靶点影响很小,这可能导致非预期突变。另外,分子量较小的分子也给CRISPR-Cas13多重检测带来了挑战。因为Sherlock的RNA报告程序容易被环境中存在的RNA酶降解,而ssDNA报告程序则不易激活,因此由于取消了体外转录过程,DETECTR更便于DNA检测。
2.4 CRISPR-Cas14技术概述
Cas14属 于V型CRISPR-Cas系统 由RNA引导的核酸酶家族,大小只有400到700个氨基酸,迄今为止被证明是最小的第二类CRISPR效应器。它是一种靶向ssDNA的CRISPR内切酶,与CRISPRCas12a不同,它不需要PAM就可以激活,识别之后进行靶向切割时表现出与Cas12a不同的保真度机制[17],即靶向识别后所释放的非特异性催化活性,这种机制类似于ssRNA靶向Cas13a酶的机制,例如通过降解标记的核酸以产生荧光信号,因此可以根据Cas12与Cas13的作用机制来理解Cas14的切割特性。各种CRISPR检测系统比较如表1。
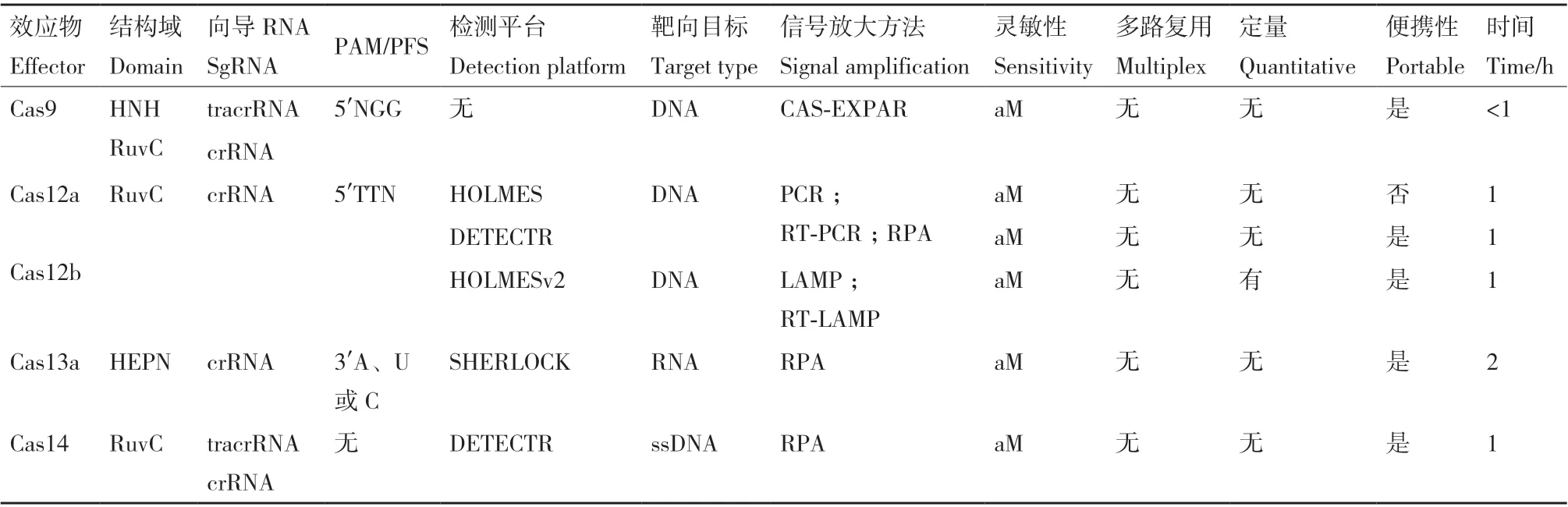
表1 CRISPR检测系统比较Table 1 Comparison of CRISPR detection system
基于Cas14的这种非特异性DNase活性,开发了ssDNA检测平台DETECTR-Cas14[48]。但在诊断用途上,与Cas12a相关的检测平台DETECTR[25]相比,其在区分ssDNA底物方面表现出较高的保真度,可用于DNA单核苷酸多态性基因分型、ssDNA病原体的检测与诊断。CRISPR-Cas14系统还可以与HUDSON[42]方法结合使用,不涉及复杂的样本提取和运输,达到快速检测病毒的目的,并已成功应用于细小病毒检测人类博卡病毒(HBoV1)[11]。这项新的诊断技术的精准性在检测人类E3泛素蛋白连接酶(HERC2)基因方面已经得到证明。CRISPRCas14是高通量病原突变筛查的一种有效且经济高效的方法,而目前在检测之前,需要额外的步骤从dsDNA靶标生成ssDNA。Cas14的这一特殊性质可能会增加其应用的复杂性;因此,到目前为止,它在诊断应用中的优势还没有清楚地展示出来。
2.5 CRISPR核酸扩增检测技术
许多已发表的CRISPR检测方法需要进行核酸扩增,但标准的扩增方法PCR需要热循环仪,不方便携带且反应时间较长,并不适用。目前研究较多的是与等温扩增放大的多种技术,最常用的等温放大方法是RPA和LAMP,它们的工作温度分别在37-42℃、65℃,利用CRISPR与RPA结合建立了DETECTR、SHERLOCK等一系列检测平台。并结合动态水相反应(DAMR)系统和蔗糖浓度的密度差异建立两相一体式反应进行核酸检测[49]。HOLMESv2系统与LAMP扩增结合,在恒温条件下,Cas12b检测结合LAMP扩增并经过亚硫酸氢盐处理可以准确定量目标DNA甲基化程度[33]。滚环扩增(RCA)是一种高度特异的等温基因扩增方法,可以在室温下进行,辅助CRISPR-Cas9检测多个胞外囊泡小RNA[50]。核酸序列扩增(NASBA)是一种用来扩增RNA的方法,需要一个初始加热步骤(65℃),然后在41℃下进行等温扩增,与CRISPR-Cas9结合与可准确区分密切相关的寨卡病毒株[51]。
2.6 CRISPR比色读出检测系统
在CRISPR检测中,色度传感器的使用很受欢迎,因为它可以直接将结果可视化。其中包含侧向流动分析(LFA),CRISPR-Cas9结合侧向流动核酸测定[52](CASLFA)用于鉴定单核细胞增生李斯特菌、转基因产品和非洲猪瘟病毒(ASFV)。有研究人员采用了一种基于胶体金纳米颗粒(AuNP)[53]的比色分析方法,以及铂纳米颗粒(PtNPs),再加入Cas12a和Cas13a效应蛋白来检测目标序列,通过他们的体积条形图芯片,可以识别和检测血清中的多种癌症基因突变。
2.7 CRISPR识别输出检测系统
研究人员通过将CRISPR切割与电子信号输出系统结合,能够准确的观察到结果的变化,而且不需要目标放大就可以在非常低的浓度下进行测量。CRISPR-dCas9借助基于石墨烯的场效应晶体管(GFET)和纳米孔传感器[54],通过识别目标序列来影响电子信号的输出,利用Cas12a的反式切割检测报告DNA片段,有效解决了低浓度目标DNA的检测时间问题。电化学传感系统[55]利用Cas12a的反式切割活性获得高传导信号,而不需要进行DNA扩增,通过电流差异表明目标DNA的存在。
3 CRISPR系统在新冠病毒检测的应用
新型冠状病毒SARS-CoV-2引起新冠肺炎,并已导致国际公共卫生紧急情况,截止到2021年3月已传播到200多个国家,全球已感染1亿2 040万人,死亡近200多万人。研究表明,感染SARS-CoV-2的个体在无症状或有症状前可能具有高度感染性,并且感染者平均可感染5.6个体[56],这种情况亟需快速、灵敏的SARS-CoV-2诊断分析方法。检测病毒的存在性对于降低病毒的基本繁殖率和最佳临床时间窗口都是至关重要的。目前采用RT-qPCR诊断COVID-19是主要的手段,但此方法需要专业的技术人员,且试剂和设备的获取不足减缓了疾病检测的速度。为了进一步提高新冠肺炎的诊断水平,基于CRISPR系统的检测新冠肺炎的方法,因其准确、快速的诊断检测而成为热点。而目前报道出的在新冠病毒方面应用的主要是基于Cas12与Cas13的检测技术,故基于CRISPR的平台目前是准确检测和治疗SARS-CoV-2的一种合理的新方法。
3.1 基于CRISPR-Cas12a的诊断工具
研究者们在CRISPR系统的基础上设计了各种新的诊断方法,其中利用CRISPR-Cas12a[57]系统DETECR的检测平台,通过将CRISPR-Cas12a与RT-PCR结合将从鼻拭子中提取的病毒RNA中进行扩增,后将扩增产物转移至CRISPR-Cas12a的系统中进行荧光检测,利用简易的设备即可进行远程检测,并在短时间内观察到结果。其结果也可通过侧向流动检测方法进行观察[58],用于检测呼吸道提取物中的SARS-CoV-2。为了更能方便操作者,研究人员开发了一种快速、灵敏的肉眼可视的检测方法(CRISPR-Cas12a-NER)[59],具有肉眼读数,无需特殊仪器即可在45 min 内检测到,从而提供了一种简单可靠的现场诊断方法。目前还将等温扩增与CRISPR-Cas12技术相结合,开发了一种快速检测临床标本中SARS-CoV-2的方法[60]。该方法使用环介导扩增(RT-LAMP)对从鼻咽或口咽拭子中提取的RNA执行同时的逆转录和等温扩增,随后对冠状病毒序列进行Cas12检测,利用其附属切割确认了病毒的存在,极大的缩短了检测时间,提供了快速而又准确的检测方法。
3.2 基于CRISPR-Cas13a的诊断工具
随着新冠疫情的发展,张峰团队提出了基于CRISPR的SHERLOCK技 术 来 检 测SARS-CoV-2的新方法[61]。该方法分为3个步骤,从核酸提取开始,在1 h内即可完成,用于定量逆转录聚合酶链反应检测。首先使用重组酶聚合酶扩增(RPA)试剂盒对提取的核酸样本进行等温扩增;再使用Cas13检测预扩增的病毒RNA序列;最后借助仪器可以使用肉眼读出检测结果检测[62]。Arizti-Sanz团队开发的SHINE方法[63],则将SHERLOCK可以与HUDSON搭配使用,这是一种灵敏而特异的集成诊断工具,可以从未提取的样本中检测SARS-CoV-2 RNA。它通过使用加热和化学还原来破坏降解RNA的核酸酶和裂解病毒颗粒,消除提取核酸的步骤,用于免提取、快速和灵敏地检测SARS-CoV-2 RNA。这是一种简单的方法,可以用最少的设备从未提取的患者样本中检测病毒RNA,降低了样本污染的风险。此方法显示出了其在新冠肺炎大流行期间大量的诊断需求,这些研究进展可以极大地提高诊断检测的能力,为抗击传染病提供必要的工具。
4 小结
CRISPR-Cas系统具有高效性、特异性等特征,因此被科学家们广泛推崇,随着对这些系统的组成和功能的不断开发,CRISPR核酸检测应用将继续扩大。本文中列举了CRISPR-Cas系统用于识别和检测不同目的的特定核酸,包括基因组DNA、非基因组DNA、RNA和病原微生物的检测。开发出的新型检测平台DETECTR与SHERLOCK也具有良好的临床检验倾向,使得检测变得快捷、灵敏。并且可以集成到基于比色或荧光的便携式设备中,从而可以在现场实施。当特定的报告核酸被不同的荧光分子标记时,它们也可以被多重化。然而,多种酶的使用、反应时间和步骤使方法变得复杂,此外,基于荧光的技术会产生荧光本底,因此需要严格的优化。该系统目前在病毒检测快速应用上也表现出了的巨大潜力,会对疫情的防控提供有力的技术支撑。总之,对系统的优化和进一步认识,有望给核酸检测、基础研究、传染病和单碱基突变的遗传病、肿瘤的诊断和治疗等带来革命性影响。之后研究重点可以主要放在高通量检测和多重序列方向上进行检测。

