葡萄糖调节蛋白78上调MMP-2和MMP-9促进鼻咽癌细胞CNE1的增殖与侵袭
白晶,曹威,刘安廷,潘惠萍,刘美华,马新苗,唐隽
(1.佛山市第一人民医院 耳鼻咽喉科,广东 佛山 528000; 2.佛山市三水区人民医院 体检中心,广东 佛山 528000; 3.佛山市第一人民医院禅城医院 耳鼻咽喉科,广东 佛山 528000)
鼻咽癌是一种源于黏膜上皮的恶性肿瘤,遗传、环境以及特异性病毒感染均可导致该病的发生,在我国华南地区较为常见。由于该病的发病部位较为隐匿,没有典型的早期症状,并且病情进展迅速,大多数患者确诊时已错过最佳手术切除治疗期,主要借助于放化疗来缓解患者的症状,但鼻咽癌细胞具有恶性增殖以及高侵袭性的特点,患者在术后极易复发,并且伴随颈部淋巴结等部位转移,严重影响患者的预后以及生命质量的提高[1]。因此在临床上急需寻找有效的特异性分子标志物用于鼻咽癌的诊断和靶向治疗。已有的研究证实[2]肝激酶b1(liver kinaseB1,LKB1)、腺苷酸激活蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)、速激肽受体神经激肽-1(neurokinin receptor 1,NK-1R)等多种基因和蛋白的表达参与调控鼻咽癌的发生、发展以及免疫浸润、恶性侵袭等病理过程。葡萄糖调节蛋白 78(glucose-regulated protein 78 kDa,GRP78)是热休克蛋白70家族中重要的成员之一,是肿瘤细胞中内质网分子伴侣[3]。研究显示[4]肺癌、胃癌、黑色素瘤等肿瘤细胞的异常增殖需要依靠大量的蛋白分子得以延续,而GRP78蛋白的表达上调能够在该过程中帮助肿瘤细胞在最短的时间内恢复内质网稳态,启动肿瘤细胞的血管新生[5],使肿瘤细胞免于淋巴细胞的捕杀,实现肿瘤逃逸。Yao等[6]研究显示在乳腺癌中,GRP78的高表达能够增强肿瘤细胞的适应力,以抵抗化疗药物5-氟尿嘧啶诱导的凋亡。Gopal等[7]研究报道肿瘤细胞表面的GRP78能增强胰腺癌细胞相关巨噬细胞的活化,促进肿瘤的生存与增殖。但是有关GRP78在鼻咽癌中的报道较少。本研究通过对临床鼻咽癌组织样本以及鼻咽癌细胞的研究,构建上调GRP78表达的CNE1细胞株,来探讨GRP78在鼻咽癌中的作用机制,为临床上鼻咽癌的治疗提供新的基础实验数据支撑。
1 材料和方法
1.1 在线生物信息网站研究
从公共基因芯片数据库(gene expression omnibus,GEO)提取GSE32960芯片中的数据,该芯片中包含312例鼻咽癌标本,18例正常鼻咽组织,采用BRB-Array Tools软件进行统计分析GRP78的mRNA的表达情况,利用生存分析网站(http:// kmplot.com/analysis/)分析GRP78的表达对鼻咽癌患者预后的影响。
1.2 组织标本
收集2018年6月—2019年6月手术切除病灶的56例经病理确诊鼻咽癌患者的肿瘤组织作为鼻咽癌组织的研究对象,男40例,女16例;年龄25~73岁,中位年龄48岁;所有患者均经专业医师检查排除其他器官的恶性肿瘤史,并且是初次确诊鼻咽癌,并且尚未经过放/化疗干预[8]。另取同期选取进行治疗的50例慢性鼻咽炎组织作为对照,男38例,女12例;年龄22~70岁,中位年龄45岁。经统计学分析,两组患者的性别、年龄差异无统计学意义(P>0.05),具有可比性。本研究的目的以及研究均已告知患者或其家属,并获得同意书。所有组织样本生理盐水清洗,置于液氮中冷冻10 min,然后转至深冷冰箱中备用待测。本研究经医院伦理委员审批,审批号:2020-07-35AW。
1.3 细胞及主要试剂和仪器
人鼻咽癌细胞株CNE1购自美国典型培养物保藏中心(American type culture collection,ATCC),过表达LvGFP-Puro-GRP78以及LvGFP-Puro-GRP78-NC阴性对照由中国上海Gene Pharma生物有限公司构建。
Trizol 试剂盒(日本TaKaRa公司);GRP78抗体(ab21685)、鼠抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(ab125247)、兔抗基质金属蛋白酶2(matrix metalloproteinase-2, MMP-2)(ab92536)和MMP9(ab76003)抗体(美国abcam公司);Brdu试剂盒、Western blot试剂盒(美国Invitrogen公司);Transwell小室(美国的Sigma-Aldrich公司);苏净Airtech超净工作台(美国Thermo Fisher公司),恒温恒压细胞培养箱(美国Thermo公司); IXplore Standard倒置显微镜(日本Olympus公司)。
1.4 免疫组化法检测样本组织中GRP78的表达
将各组织标本经5%多聚甲醛固定,石蜡包埋,切片,脱蜡,修复,封闭,分别加稀释好的一抗(1∶100),4℃过夜孵育,次日室温下,加入适量生物素标记的二抗(1∶500),适量二氨基联苯胺(DAB)显色,复染,经脱水,透明,干燥后,以中性树胶封片,显微镜下观察结果。每张切片随机选取5个视野经两位专业医师根据染色强度(0~3分,无色为0分,浅黄色为1分,棕黄色为2分,黄褐色为3分)和阳性细胞比例(0~3分,<5%为0分,在5%~10%范围内记为1分,在11%~50%范围内记为2分,>50%为3分)进行评分,总评分在0~3分记为阴性表达,在4~6分记为阳性表达。同时将GRP78的表达与鼻咽癌患者临床病理参数进行统计分析。
1.5 细胞培养以及转染
将人鼻咽癌细胞株CNE1复苏后,接种于含有灭活的10%胎牛血清的DMEM培养基中,置于恒温恒压生化培养箱中培养,条件37℃,5%CO2,当细胞生长密度达85%时进行细胞转染,CNE1细胞实验分为对照组(CNE1鼻咽癌细胞常规培养,不进行外界干预)、NC组(CNE1鼻咽癌细胞转染LvGFP-Puro-GRP78-NC后,常规培养)、Sh-GRP78组(CNE1鼻咽癌细胞转染LvGFP-Puro-GRP78后,常规培养),转染完成48 h后,可在荧光显微镜下观察到各组细胞内的绿色荧光蛋白(green fluorescent protein,GFP),PCR检测各组细胞中GRP78的mRNA的表达,当转染效率超过90%以上时,用于后续实验。
1.6 Brdu标记实验检测各组细胞的增殖能力
调整细胞浓度,以5×104个/孔接种于6孔培养板中,分组处理同上,轻轻混匀后,置入37℃,5%CO2培养箱常规培养,细胞培养24 h后,10%甲醛固定并进行Brdu实验,实验操作严格按照试剂盒操作要求进行。
1.7 Transwell小室实验检测各组细胞的侵袭能力
在Transwell小室上室中加入200 μL预先稀释的不含血清的Matrigel胶,无菌干燥箱中过夜。调整各组细胞浓度至2×105个接种在上室,下室中加入700 μL含血清的常规培养基,每组设3个孔,于37℃、5% CO2条件下中继续培养24 h, PBS轻柔洗涤1次,4%多聚甲醛固定10 min,结晶紫染色10 min,显微镜下拍照、计数,采用图像处理软件Image-Pro Plus 6.0对视野中穿过滤膜的细胞进行统计分析。
1.8 小管形成实验检测各组细胞的血管生成能力
在96孔培养板上平铺一层新鲜Matrigel溶胶,迅速转移进无菌培养箱设定37℃,待Matrigel溶胶凝固后,将细胞以1×104个/mL接种在96孔板中,然后分组同上,分别加入含CNE1细胞的培养上清液,继续培养48 h,倒置光学显微镜下观察血管生成情况并拍照记录。
1.9 双荧光素酶实验
构建基质金属蛋白(MMP)-2-3’UTR WT以及MMP-2-3’UTR MUT质粒,按双荧光素酶试剂盒要求将293T细胞接种在24孔板上,采用转染试剂Lipofectamine2000将MMP-2-3’UTR WT以及MMP-2-3’UTR MUT与miRNA以及过表达载体进行共转染,Promega双荧光素酶检测系统在48 h后检测荧光酶活性。同样方法构建MMP-9-3’UTR WT以及MMP-9-3’UTR MUT质粒,按双荧光素酶试剂盒要求将293T细胞接种在24孔板上,采用转染试剂Lipofectamine2000将MMP-9-3’UTR WT以及MMP-9-3’UTR MUT与miRNA以及过表达载体进行共转染,Promega双荧光素酶检测系统在48 h后检测荧光酶活性。
1.10 Western blot检测各组细胞中GRP78、MMP-2和MMP-9的表达水平
胰酶消化细胞,离心稀释成细胞悬液,分组处理同上,按1×105个/孔接种至6孔板中;置入5%CO2、37℃培养箱24 h,加入蛋白裂解液,常规提取总蛋白,测定浓度,置于沸水中变性,进行电泳分离,转模,清洗后,在封闭液中孵育30 min,加入一抗(1∶500),孵育过夜,加入二抗(1∶1 000),二氨基联苯胺(diaminobenzidine,DAB)显色,以GAPDH作为内参,Image J图像分析软件统计分析各条带的灰度值。
1.11 统计学分析
数据统计采用SPSS 19.0软件,作图工具采用Graphpad 5.01,两组间比较采用t检验,多组间比较采用单因素方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 GRP78基因在鼻咽癌组织中的表达
在线生物信息分析显示,与慢性鼻咽炎组织相比,鼻咽癌组织中GRP78基因的mRNA的表达明显升高(P<0.05);生存分析结果显示,与GRP78低表达的患者相比,GRP78高表达的患者的生存期较低(P<0.05);说明GRP78基因的表达与鼻咽癌患者的预后关系密切,GRP78基因的表达对于鼻咽癌具有潜在的研究价值,见图1。
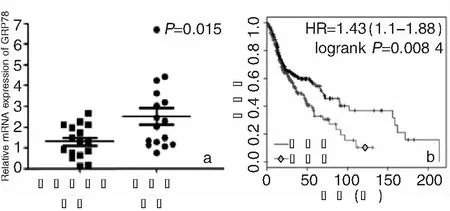
图1 在线分析GRP78基因的表达 a:GRP78基因的mRNA相对表达; b:GRP78基因的表达与鼻咽癌患者生存期的关系
2.2 免疫组化检测GRP78蛋白的表达
免疫组化检测GRP78蛋白在各组组织中的表达,结果如图2所示,GRP78在鼻黏膜细胞的细胞质中,与慢性鼻咽炎组织中相比,GRP78在鼻咽癌组织中的表达明显升高(t=67.985,P<0.05),见图2。

图2 两种组织中GRP78蛋白的表达情况 a:免疫组化检测 (免疫组化 ×400); b:柱状图对比
2.3 GRP78蛋白的表达与鼻咽癌患者的临床数据的关系
统计分析显示,GRP78蛋白的表达与远处转移和T分期相关,与患者的年龄、性别和临床分期无关(P>0.05),具体数据见表1。
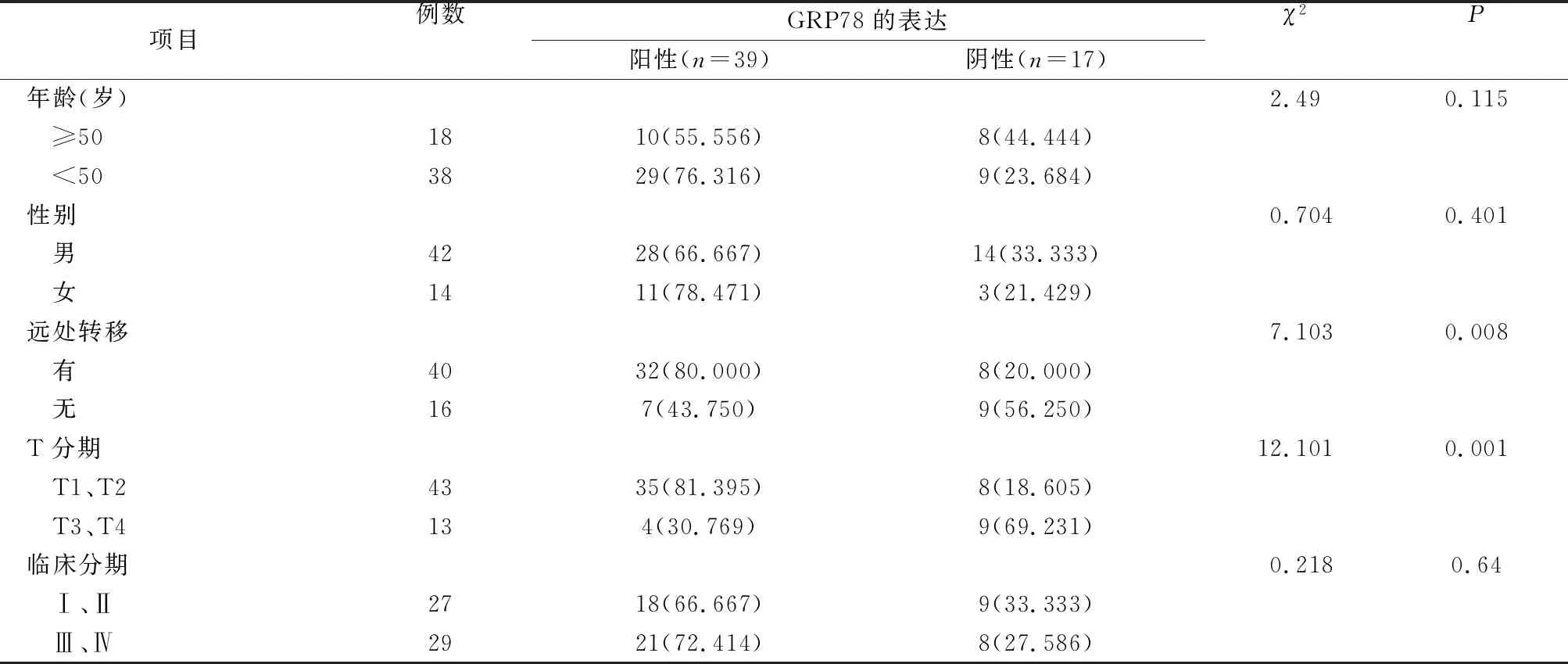
表1 GRP78蛋白的表达与鼻咽癌患者的临床数据的关系 (例,%)
2.4 荧光显微镜观察转染操作后的细胞
转染完成48 h后,与对照组相比,NC组和Sh-GRP78组细胞在荧光显微镜下观察到的绿色荧光细胞强度明显增强,而PCR结果显示,与对照组和NC组相比,Sh-GRP78组细胞中GRP78的mRNA的表达明显升高(F=18.951,P<0.05),NC组和对照组相比,差异不具有统计学意义(P>0.05),见图3。

图3 观察转染操作后细胞情况 a:荧光显微镜观察 (绿色荧光 ×400); b:柱状图对比
2.5 Brdu标记实验对各组细胞的增殖能力
Brdu标记实验结果显示,与对照组和NC组相比,过表达GRP78后,Sh-GRP78组CNE1细胞的Brdu阳性比例明显升高(F=87.364,P<0.05),NC组和对照组相比,差异不具有统计意义(P>0.05),见图4。
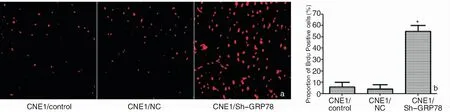
图4 观察各组细胞的增殖能力 a:Brdu标记实验结果 (Brdu ×400); b:柱状图对比
2.6 Transwell小室检测各组细胞的侵袭能力
Transwell小室结果显示,与对照组和NC组相比,过表达GRP78后,Sh-GRP78组CNE1细胞侵袭的数量明显增多(F=108.316,P<0.05),NC组和对照组相比,差异不具有统计学意义(P>0.05),见图5。
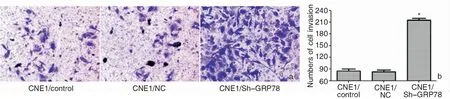
图5 观察各组细胞的侵袭能力 a:Transwell小室结果 (结晶紫 ×400); b:柱状图对比
2.7 小管形成实验检测各组细胞的血管生成能力
小管形成实验结果显示,与对照组和NC组相比,过表达GRP78后,Sh-GRP78组细胞生成管状结构数量明显升高(F=96.851,P<0.05),NC组和对照组相比,差异不具有统计学意义(P>0.05),见图6。
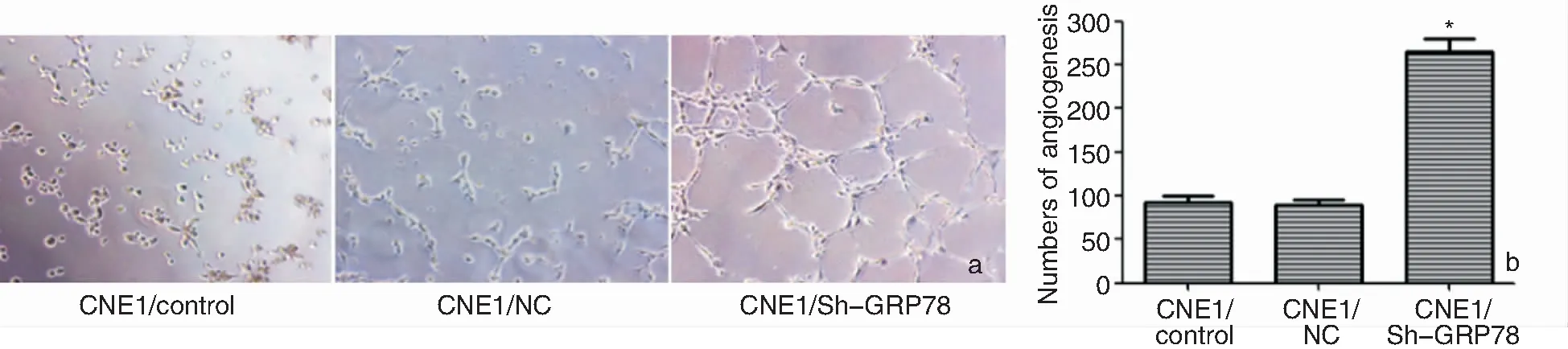
图6 显微镜下观察各组细胞的血管生成能力 a:小管形成实验结果 (×400); b:柱状图对比
2.8 双荧光素酶实验结果
双荧光素酶实验结果显示,过表达GRP78后,野生型MMP-2和MMP-9的荧光素酶活性被激活(t=17.587,15.693,P<0.05),突变型MMP-2和MMP-9荧光素酶活性无明显变化(P>0.05),说明GRP78、MMP-2和MMP-9具有靶向调控关系,见图7。
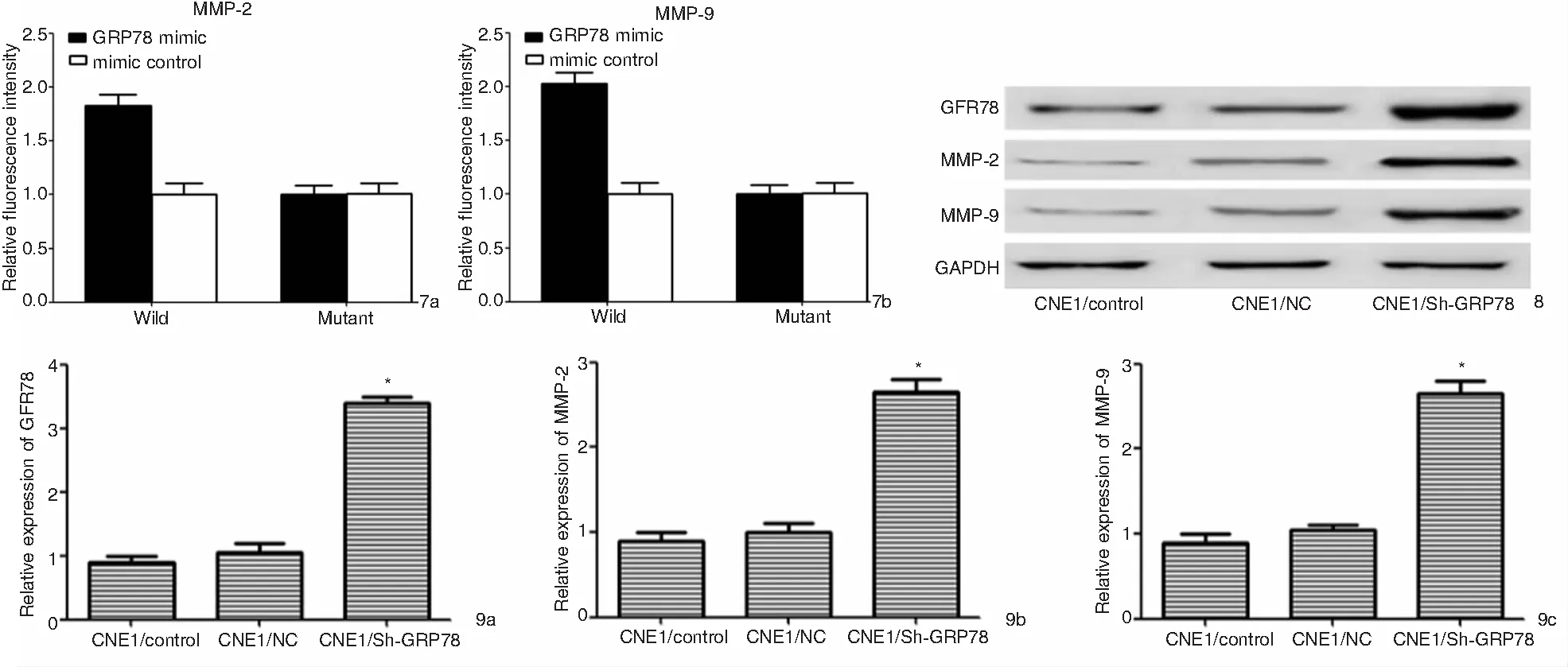
图7 双荧光素酶实验结果 7a:MMP-2; 7b:MMP-9 图8 Western blot检测各组细胞中GRP78、MMP-2和MMP-9表达水平 图9 各组细胞中GRP78(9a)、MMP-2(9b)和MMP-9(9c)表达水平柱状图
2.9 Western blot检测各组细胞中GRP78、MMP-2和MMP-9的表达水平
采用Western blot检测各组细胞中GRP78、MMP-2和MMP-9表达水平,结果显示,与慢性鼻咽炎组织和NC组相比,Sh-GRP78组CNE1细胞中GRP78、MMP-2和MMP-9的表达水平明显上升(F=96.851,87.597,90.005,P<0.05),NC组和对照组相比,差异无统计学意义(P>0.05),见图8、9。
3 讨论
鼻咽癌是严重危害我国居民身体健康的恶性肿瘤之一。尽管众多研究学者在鼻咽癌的病理发展,病情进展的研究中取得的较为明显的进步,但是关于该病的具体发病机制尚未完全阐明,鼻咽癌患者的整体预后较差,5年的生存率尚不尽如人意,并且该病极易复发以及发生远处转移,使得鼻咽癌患者难以摆脱疾病困扰[9-10]。因此寻找鼻咽癌的特异性生物标志物,深入揭示疾病的分子发展机制,筛选出新的高效的药物作用靶点,在鼻咽癌的临床治疗中具有重大意义。
研究显示[11-12]鼻咽癌的起病以及病情进展是一个多种基因和蛋白共同参与调控的多阶段的复杂的病理生理过程。肿瘤细胞完成快速增殖的过程离不开细胞内蛋白质的合成过程。蛋白质合成后经内质网的的折叠、装配才能发挥其生物学功能,而GRP78作为内质网的重要的分子伴侣,参与调控并协助内质网完成这一细胞生理过程[13-14]。Ahmadi等[15]研究证实GRP78能够促进肿瘤细胞内生长因子的释放,增强肺癌细胞的增殖信号的传导。Qiu等[16]研究表明宫颈癌细胞通过增强GRP78的表达促进肿瘤细胞的血管新生。Yang等[17]研究证实肿瘤组织中GRP78高表达的三阴性乳腺癌患者的预后不佳。徐婷等[18]研究显示在人鼻咽癌CNE-2Z细胞中,抑制GRP78的表达能诱导肿瘤细胞的凋亡。本研究对临床鼻咽癌组织标本进行免疫组化,结果显示与正常鼻黏膜组织相比,鼻咽癌患者的鼻黏膜内GRP78的表达明显增强,说明GRP78在鼻咽癌中具有深入研究的价值。构建LvGFP-Puro-GRP78转染CNE1后,结果显示,实验组CNE1细胞的增殖、侵袭以及血管新生的能力明显增强。
肿瘤微环境中的血管新生是癌细胞增殖与侵袭的共同基础;而细胞外基质降解是肿瘤细胞进行恶性增殖与侵袭、靶器官转移开始的主要途径[19]。鼻咽癌细胞的这一生理过程是在众多细胞黏附分子、细胞移动分子以及大量的调控酶的相互协调下共同完成的。其中MMPs因其几乎可降解细胞外基质中的非多糖成分,成为参与细胞侵袭过程中重要的效应分子。Dong等[20]研究表明MMP-2和MMP-9的活性直接影响胃癌细胞的增殖与侵袭能力。Zhang等[21]研究显示抑制MMP-2和MMP-9的表达后能明显抑制胰腺癌细胞的血管形成能力。Song等[22]研究表明MMP-2和MMP-9的表达与肺癌、前列腺癌、结肠癌、食管癌、上皮性卵巢癌等多种肿瘤的预后关系密切。本研究双荧光素酶实验结果显示,过表达GRP78的靶基因为MMP-2和MMP-9。Western blot结果显示,与正常组相比,实验组CNE1细胞中MMP-2和MMP-9蛋白的表达随GRP78的表达水平升高而明显上升(P<0.05)。
综合上述,GRP78在鼻咽癌中存在高表达的现象,并且GRP78靶向调控MMP-2和MMP-9的表达增强CNE1细胞的增殖、侵袭与血管新生的能力。但是如何将GRP78的靶向作用应用到临床上对鼻咽癌的治疗和诊断中,还待更深入、系统的探索。

