基于SSR 标记的紫溪山华山松种子园无性系遗传多样性分析*
辛 静,高丽云,徐 剑,赵文植,王正德,李卫英,王 飞,辛培尧
(1.西南林业大学 国家林业局西南风景园林工程技术研究中心,云南 昆明 650224;2.西南林业大学 西南地区生物多样性保育国家林业和草原局重点实验室,云南 昆明 650224)
分子标记辅助育种为包括林木在内的植物遗传育种提供了先进有效的技术手段,相比于传统育种技术而言具有跟踪目标基因(性状)、周期短和育种效率高等优点,目前在遗传多样性分析、品种鉴定、遗传连锁图谱的构建以及分子标记辅助育种方面展现了广阔的应用前景[1-3]。SSR(simple sequence repeat)分子标记又称短串联重复或微卫星DNA,是由1~6 个核苷酸组成的基序(motif)串联重复组成的DNA 序列,其长度一般在100 bp 以内。SSR 广泛分布于真核生物整个基因组中,微卫星的突变率很高,从而产生很多等位基因,导致微卫星的高度多态性[4-5]。SSR 分子标记呈共显性,重复性好,且在种属间拥有良好的通用性,已被大量运用于林木遗传学研究[6-10]。
华山松(Pinus armandiiFranch.)是松科(Pinaceae)松属(Pinus)的高大常绿乔木,是中国独有的材、果多用途树种之一,也是中国西部中山至亚高山地区以及长江中上游防护林体系的重要绿化造林树种[11-12]。现有的大部分华山松人工林分结实量低、长势衰弱、高产林分少、病虫害增加,已远远不能满足现今林业发展的要求[13]。种子园作为林木良种繁育的主要形式之一,在现代林业生产中有着举足轻重的地位。云南省楚雄市紫溪山华山松无性系种子园建于1986 年,总面积为33.3 hm2,为国家级林木良种基地[14]。然而,该种子园自建园以来,杂交亲本的选配多以形态或地理位置远近为主要依据,尚未利用较新的技术手段对种子园内无性系开展DNA 水平上较全面的、深入的种质资源评价工作,这显然具有很大的局限性。因此,为了日后种子园更快捷有效的开展杂交育种工作,明确该种子园的遗传分化情况及不同种源间的亲缘关系显得尤为重要。近年来,中国研究者积极开展了华山松优良基因资源发掘的相关工作。刘成等[15]曾利用SRAP 分子标记对紫溪山华山松种子园内部分无性系的遗传多样性及亲缘关系进行分析,结果表明:该种子园遗传多样性较丰富,可在种源内进行亲本的选配以提高杂种后代基因的丰度。此外,朱晓丹[16]和赵扬等[17]也对华山松开展了优树选择和遗传多样性分析等相关工作。
基于目前紫溪山华山松无性系种子园的生产现状,本研究选取6 个种源共计97 份华山松优良无性系为材料,运用SSR 分子标记技术对其进行遗传多样性分析,明确各无性系遗传变异情况,探讨不同种源间亲缘关系的远近,研究结果可为华山松育种亲本的选配提供理论依据与实践指导。
1 材料与方法
1.1 材料
于楚雄市紫溪山华山松无性系种子园内采集来自6 个种源的97 株无性系叶样(表1)。挑选无病虫害的新鲜幼嫩针叶,分别按单株装入自封袋,并做好标记和编号,备用。

表1 华山松的采样信息Tab.1 Sampling information of Pinus armandii
1.2 华山松基因组DNA 提取与检测
选取5~8 根无病害的华山松叶样,采用改良CTAB 法[5]进行华山松基因组DNA的提取,并利用0.8%的琼脂糖凝胶电泳和超微量紫外分光光度计进行检测,将质量浓度较高的华山松DNA稀释到50 ng/μL,放于-20 ℃冰箱保存,备用。
1.3 SSR-PCR 扩增
使用生物学信息方法从(GIGA)nDB 数据库中下载部分火炬松序列骨架,利用在线搜索SSR位点工具Imperfect SSR Finder DocumentationNWISRL main page、Primer 5.0 和Oligo 7等相关软件进行引物设计、分析及修饰,共设计20 对SSR 引物,再借鉴已报道的22 对SSR 引物[18-19],共计42 对SSR 引物进行PCR 扩增。华山松SSR-PCR 反应体系(20 μL)为:引物0.35 μL,DNA 模板1.00 μL,dNTPs 2.00 μL,TaqDNA 聚合酶1.20 μL,10×PCR Buffer 2.00 μL,用ddH2O 补足至20.00 μL。反应程序为:94 ℃预变性5 min;94 ℃ 50 s,52 ℃ 90 s,72 ℃ 1 min,进行30 个循环;72 ℃延伸10 min,扩增产物于4 ℃保存。
1.4 引物筛选
利用42 对引物对6 个种源各1 个华山松无性系DNA 进行PCR 扩增,用1%的琼脂糖凝胶电泳进行结果检测,最终获得33 条条带清晰、明亮的引物,然后再对33 对引物进行8%聚丙烯酰胺凝胶电泳分析,经过初筛和复筛,最终获得26 对多态性高的引物 (表2),可用于遗传多样性的分析。

表2 供试SSR 引物序列Tab.2 SSR primer sequences for test
1.5 数据分析
将在复筛中筛选出的多态性较好的引物与6 个种源地的每一个无性系DNA 进行PCR 扩增,扩增产物按照每个种源地、每个引物的顺序排列,在8%的聚丙烯酰胺凝胶上检测,检测结果按照主扩增条带的迁移变化读带,将所得数据录入Excel 建立原始数据矩阵。
通过POPGEN 1.32 分析软件分别计算各个种源的等位基因数、有效等位基因数、Nei’s 基因多样性指数和Shannon 信息指数等;再利用NTSYS 2.10 软件构建UPGMA 聚类图;使用Structure 2.3.1 软件,利用MCMC 方法评估多态位点的基因数据并建模聚类,估计最佳群体群组数值(K),其中K的估计值范围为1~13,每个K值重复数为20 次,不作数迭代设定为10 000 次,不作数迭代后的MCMC 设定为10 000 次,得到数据后将数据上传至Structure 2.3.1 Harvester 进行分析,采用Clumpp 1.1.2 软件对Structure 2.3.1 Harvester 分析后得到的数据进行整理和分析,以似然数最大为原则确定最佳K值,通过Distruct 1.1 绘制聚类图。
2 结果与分析
2.1 华山松基因组DNA 提取结果
由图1 可知:所提取的样本DNA 条带明亮、清晰、无明显拖尾现象,可以用于后续试验。
图1 部分华山松样本DNA 琼脂糖电泳检测结果Fig.1 Agarose gel electrophoresis detection result of Pinus armandii DNA
2.2 遗传多样性分析
由表3 可知:6 个种源的观测等位基因数范围为3.730 8 (南华县)~4.807 7 (巍山县),平均观测等位基因数为4.237 1。有效等位基因数的范围为2.574 0 (南华县)~3.087 6 (楚雄市),平均有效等位基因数为2.901 1。Shannon 多样性指数范围为1.069 1 (南华县)~1.242 4 (楚雄市),平均数为1.186 5,所有群体的多样性指数均大于1,6 个种源均具有较高的多态性。Nei’s 基因多样性指数的范围为:0.583 3 (南华县)~0.664 4 (楚雄市),平均数为0.637 6,表明虽然6 个种源在各项遗传参数上存在一定差异,但各个种源均拥有较高的遗传多样性。
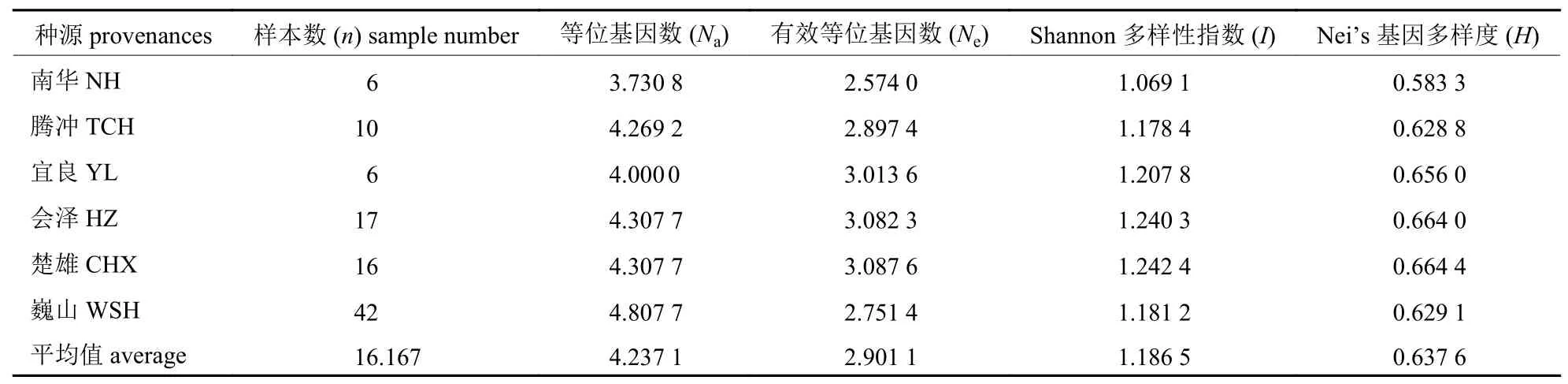
表3 华山松群体遗传多样性参数Tab.3 Genetic diversity parameters of P.armandii population
2.3 聚类分析
由表4 可知:华山松6 个种源的遗传相似系数处于0.801 0~0.939 0 之间,平均遗传相似度为0.873 4,接近1,说明各种源间的亲缘关系较近;各种源间遗传距离处于0.063 0~0.221 9 之间,遗传距离的平均值为0.136 3,接近于0,同样说明各种源间的亲缘关系较近。其中,宜良(YL)和腾冲(TCH)之间的遗传距离最大(D=0.221 9),遗传相似度最小,为0.801 0,说明宜良和腾冲之间的遗传距离最远;巍山(WSH)和会泽(HZ)种源之间的遗传相似系数最大,为0.939 0,遗传距离最小(D=0.063 0),说明巍山和会泽种源之间的遗传差异最小。
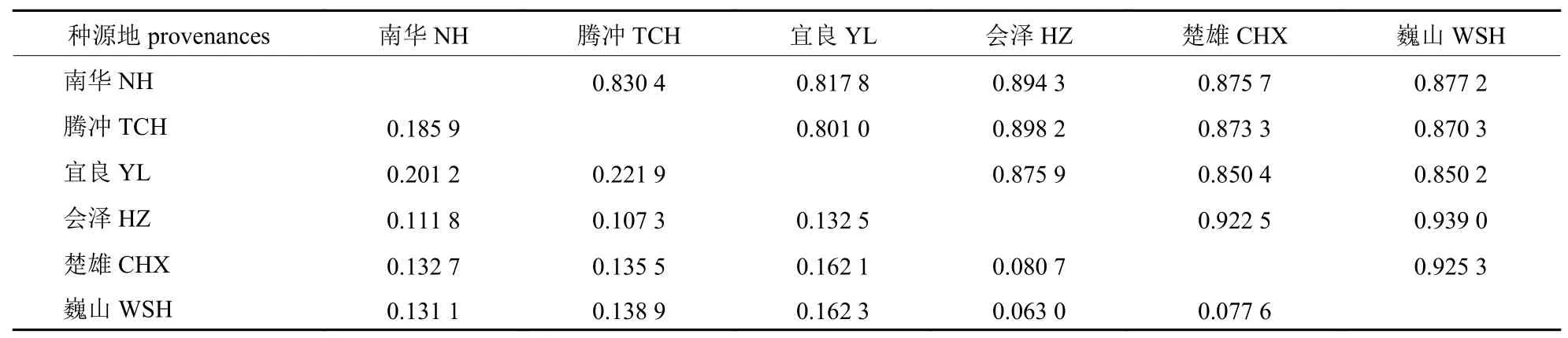
表4 华山松6 个种源间Nei’s 遗传相似系数(对角线上方)和遗传距离(对角线下方)Tab.4 Nei’s genetic similarity coefficient (above diagonal) and genetic distance (below diagonal)among six provenances of P.armandii
为了进一步分析不同种源间的亲缘关系,根据6 个华山松无性系种源的遗传一致度构建华山松无性系6 个种源间UPGMA 聚类图。由图2 所示:以0.864 为阈值,可以将6 个种源分为2 类,南华县(NH)、会泽县(HZ)、巍山县(WSH)、楚雄市(CHX)和腾冲市(TCH)归为一类;宜良(YL)单独归为一类。以0.883 为阈值,大致将6 个种源分为3 类,南华县(NH)、会泽县(HZ)、巍山县(WSH)和楚雄市(CHX)归为一类;腾冲市(TCH)为单独的一类;宜良县(YL)单归为一类。当阈值为0.921 时,可以分成5类,南华县(NH)、楚雄市(CHX)、腾冲市(TCH)、宜良(YL) 4 个种源各自为一类,会泽县(HZ)、巍山县(WSH)聚为一类,说明会泽(HZ)和巍山(WSH)之间的亲缘关系较近。
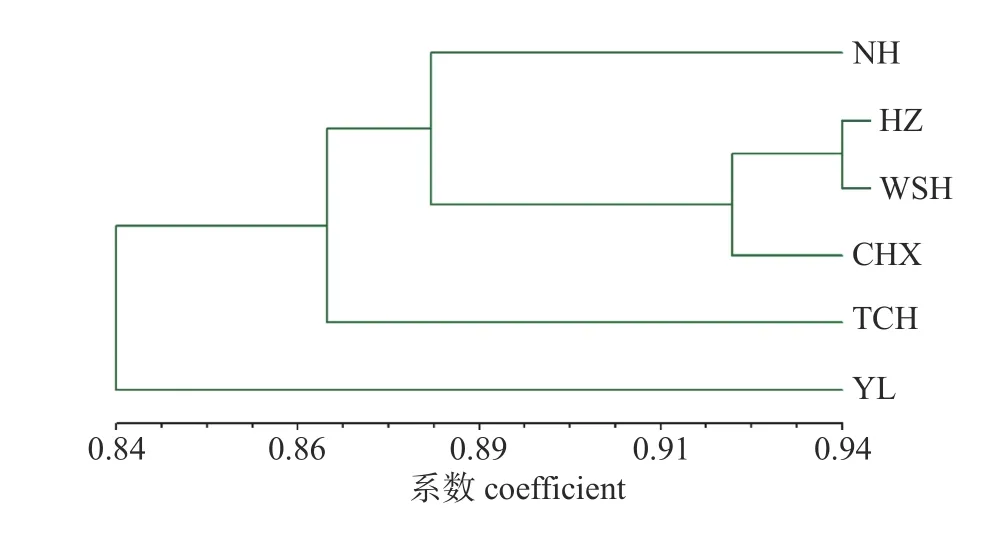
图2 华山松6 个种源聚类分析图Fig.2 Cluster analysis of six provenances of P.armandii
2.4 群体遗传结构分析
对华山松种子园进行遗传结构分析可知:6 个无性系种源的遗传分化系数(Gst)为0.056 8,介于0.05%~0.15%之间,表明种源间存在中等程度的遗传分化,华山松6 个种源的遗传变异主要是来自各个种源内的遗传变异,且其基因流Nm为4.150 3>1。由此可知:种源间的遗传交流较多,削弱了各种源间的遗传差异,高水平的基因流可能是导致华山松种源间产生较低遗传分化的原因。
利用Structure 2.3.1 软件分析97 个华山松无性系的群体遗传结构。由图3 所示:LnP(D)值随着K值的增加而整体降低,LnP(D)在K=2 时出现第1 个转折点,这时的△K为最大值,根据似然数最大的原则来确定最佳的群体数目,可以将6 个华山松种源分为2 个理论群组,分别包含5 个和1 个群体,其中第1 群组包括南华县(NH)、会泽县(HZ)、巍山县(WSH)、楚雄市(CHX)和腾冲市(TCH)种源,第2 群组包括宜良(YL)种源。即意味着华山松6 个种源分化为2 个不同的基因型族。由图4 可知:横坐标表示97 个无性系,纵坐标表示Q值分布,华山松被划分为2 个亚群体 (红、绿)。以Q值0.6 为界限,97 个无性系中Q≥0.6的有37 个,占38.1%,说明这些无性系亲缘关系较为单一,遗传相似度较高;而Q<0.6的有60 个无性系,占61.9%,说明其基因渗透较高,遗传构成较为多样,亲缘关系比较复杂。综上所述,华山松6 个无性系种源具有较为复杂的群体遗传结构,并且具有基因渗透的现象。

图3 LnP(D)和ΔK 随K 值的变化趋势Fig.3 Trends of LnP(D) and ΔK changed with K values
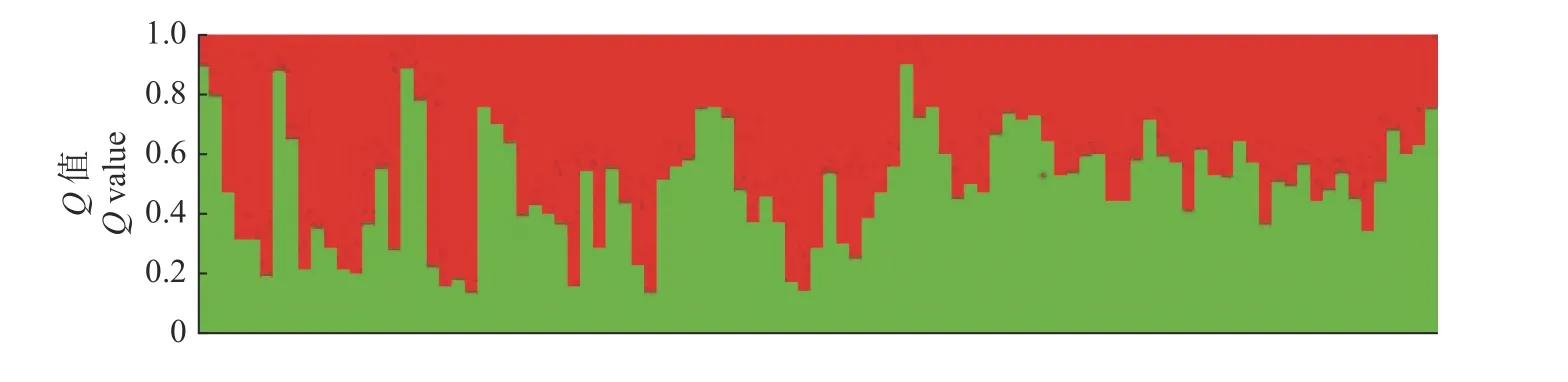
图4 样品材料群组遗传结构Fig.4 Genetic structure group of sample material
3 讨论
种子园的遗传多样性一直是研究者关注的重点,是其子代遗传品质优良的保证。本研究对楚雄紫溪山华山松种子园6 个种源共计97 份无性系进行了遗传多样性分析,在Nei’s 基因多样性指数、Shannon 信息指数和遗传分化系数等各项遗传参数方面,6 个种源均表现出较高水平的遗传多样性,且遗传变异主要是来自各个种源内。刘成等[15]利用SRAP 标记和朱晓丹[16]利用RAPD标记在以该种子园内无性系为试验材料进行遗传多样性研究中均表明:该种子园具有丰富的遗传多样性,各优良无性系间存在不同程度的遗传差异,种源内的遗传变异高于种源间,这一结果与本研究相一致。可见,不同标记在对同一群体进行遗传分析时,在分子水平上所体现的遗传多样性程度是基本一致的。由于各种源间遗传变异小于种源内遗传变异,在该种子园进行杂交育种工作时,可在种源内进行亲本的选配,增加杂种后代的基因型复杂程度,从而更有利于提高选择效率。
在进行植物遗传多样性分析时,遗传距离是反映物种和种源间遗传变异水平及遗传分化程度的重要指标,可为杂种优势提供基本遗传参数[20]。本研究表明:6 个种源间的遗传相似系数趋近于1,遗传距离趋近于0,表明各个种源间的亲缘关系较近,其中宜良(YL)种源与其他种源的遗传距离最远,意味着存在一定程度的遗传差异,而巍山(WSH)种源和会泽(HZ)种源二者之间的遗传差异最小。刘成等[15]运用SRAP 标记对该种子园6 个种源60 个无性系进行聚类分析时也发现种源间的亲缘关系与其分布的地理距离不相符,这与本试验结果相似。此外,凌士鹏等[21]和王鹏等[22]分别对桃种质资源和马铃薯育成品种的研究同样发现:部分地理距离相距较远的品种,其遗传距离表现得较为相近。因此,植物群体间当前的遗传结构不仅与自然地理距离有关,还可能与该植物的进化历史、环境条件、人为干扰程度以及进化过程中基因突变被保留等各种因素有关。所以,在进行植物杂交育种时,仅以两亲本地理位置的远近为选配亲本的主要依据存在较大的局限性。在今后的育种工作中,应以DNA 水平分析的结果为主要依据,结合形态和地理位置等综合评判,最后确定较为理想的亲本组合。
基因流(gene flow)是决定物种遗传多样性的关键因素之一,较大的基因流可以阻碍群体间的遗传分化。本研究结果表明:紫溪山华山松种子园内无性系的基因流(Nm)=4.150 3>1,说明群体间的遗传交流较多,遗传交流削弱了各种源间的遗传差异,华山松种源的遗传变异主要存在于种源内,因此,华山松种源间产生较低遗传分化的原因可能是各种源间存在一定程度的基因渗透现象。基因流的大小受种子流与花粉流的影响,食果动物的远距离传播、单位间的调种以及飞播造林等均能将不同基因型进行扩散,从而在扩大各种源间无性系遗传交流的同时,削弱了种源间的遗传变异。
4 结论
华山松无性系种源间遗传变异不高,其主要遗传变异存在于种源内,研究结果可为利用该种子园内的不同无性系进行华山松遗传改良工作提供理论依据及实践指导。

