响应面法优化控制粪肠球菌发酵产酪胺的研究*
张云鹤,角攀伟,胡永金,龚加顺
(云南农业大学 食品科学技术学院,云南 昆明 650201)
三川火腿是云南省丽江市三川坝特有传统食品,主要利用自然发酵,不使用硝盐及火硝防腐剂和添加剂,是营养丰富的食品[1]。由于三川火腿是在自然条件下发酵成熟,所以发酵过程中微生物大多来源于环境中的杂菌和火腿中本身存在的优势菌,一些具有氨基酸脱羧酶活性的菌会使火腿中的氨基酸脱羧形成生物胺[2]。生物胺是存在于生物体内的一类低分子含氮有机化合物的总称[3],它是生物体合成某些化合物的前体物质,适量的生物胺对机体的生理代谢具有促进作用,过量摄入会对机体产生毒害作用,摄入部分种类的生物胺也会对人体造成危害,其中组胺和酪胺对人体的危害最大[4]。
影响生物胺形成的因素主要有三方面:一是可利用的游离氨基酸,二是能促使相应氨基酸发生脱羧作用的微生物存在,三是有利于细菌生长的适宜条件[5]。假单胞菌、肠细菌、非发酵剂葡萄球菌、微球菌和乳酸菌都属于发酵肉制品中的产胺菌[6]。因此,针对火腿中的产胺菌,了解并掌握腌制火腿中生物胺的产生机理及变化规律,可以有效地控制生物胺的产生。笔者利用从三川火腿中分离鉴定的产胺菌——粪肠球菌,研究环境条件对粪肠球菌产酪胺的影响,并通过响应曲面试验优化粪肠球菌培养条件来降低酪胺产量,为降低火腿中生物胺含量提供理论基础。
1 材料与方法
1.1 材料与试剂
粪肠球菌(Enterococcus faecalis)菌种是云南农业大学食品科学技术学院微生物实验室从三川火腿样品中分离纯化后经鉴定保存的纯种菌株。
1.2 仪器与设备
高效液相色谱仪:美国Thermo Fisher 科技公司;全波长酶标仪:美国Thermo Fisher 科技公司;低温高速离心机:长沙迈佳森仪器设备有限公司;超净工作台:苏州安泰空气技术有限公司。
1.3 方法
1.3.1粪肠球菌生长曲线的测定
根据菌液的OD600nm值测定菌株的生长曲线[7]:配制模拟肉汤培养基(蛋白胨20 g/L,牛肉浸粉20 g/L,葡萄糖10 g/L,氯化钠30 g/L,亚硝酸钠0.15 g/L,色氨酸0.5 g/L,酪氨酸0.5 g/L,苯丙氨酸0.5 g/L,组氨酸0.5 g/L,赖氨酸0.5 g/L,精氨酸0.5 g/L,鸟氨酸0.5 g/L,用蒸馏水配制)。将活化好的粪肠球菌菌液按接种量1%分别接种到不同的三角瓶中,放入30 ℃恒温培养箱中培养,每隔2 h 取样,每个时间点重复测定3 次,取平均值,连续监测24 h。测定菌液的OD600nm值、pH 值及酪胺产量。
1.3.2影响粪肠球菌生长代谢及产酪胺能力的研究
选取温度(10、15、20、25、30 和35 ℃)、pH (4.0、4.5、5.0、5.5、6.0 和6.5)、NaCl 质量分数(0、3.0%、5.0%、8.0%、10.0%、12.0%和15.0%)和供氧条件(对照、微厌氧和富氧)等4 个在发酵过程中起主要作用的因素为条件环境,通过对OD600nm值、pH 值和酪胺产量3 个指标的检测,分析不同的环境条件对粪肠球菌的生长、产酸和产酪胺能力的影响[8]。其中,供氧条件的具体设置为将接种好菌悬液的培养试管分为3 组:1 组使用封口膜将试管口密封,形成微厌氧的培养环境,30 ℃下静置培养;1 组只加盖可透气的硅胶塞,同时置于摇床上200 r/min振荡培养,使培养液中混入氧气,形成有氧培养环境;1 组作为对照组,加盖可透气的硅胶塞在30 ℃培养箱中静置培养。
1.3.3响应面试验
为获得粪肠球菌产生物胺的最低水平条件,在单因素试验的基础上,通过Design-Expert V8.0.6.1 软件,根据Box-behnken的中心组合试验原理,进行响应面试验[9],以酪胺含量为响应值,选取温度、初始pH 和NaCl 质量分数作为单因素,进行3 因素3 水平的响应面试验设计。将得到的最优水平组合条件进行试验验证。
1.3.4菌液酪胺含量测定
菌液中生物胺含量的测定采用高效液相色谱法,用丹磺酰氯柱前衍生法对待测菌液进行处理和衍生[10]。在2 mL的样品保存管中加1 mL 0.1 mol/L的盐酸溶液,用移液枪吸取1 mL 离心好的上清液与之混匀;取混匀后的溶液1 mL,依次加入200 μL 2 mol/L的氢氧化钠溶液、300 μL饱和碳酸氢钠溶液和2 mL 10 mg/mL的丹磺酰氯丙酮溶液,60 ℃水浴15 min,期间注意避光。加热完成后,取出冷却至室温,加入100 μL氨水避光处理30 min,结束后加入乙腈定容至5 mL,使用一次性注射器吸取处理液,经0.22 μm的有机滤膜过滤至进样瓶中进行分析检测。色谱条件:色谱柱Thermo-C18 (4.6 mm×250 mm,5 μm);柱温30 ℃;流动相A 为水,流动相B 为乙腈,梯度洗脱程序为:20 min 内乙腈由60%升到100%,保持4 min,5 min 内乙腈由100%降到60%,保持6 min,整个程序运行35 min;流速1.0 mL/min;检测器:紫外检测器;检测波长254 nm;进样量20 μL。
1.4 数据处理及分析
数据的基本统计用Excel 2010 软件进行,采用SPSS 19.0 软件对数据进行显著性分析。运用Design-Expert V8.0.6.1 软件的Box-Behnken设计法进行试验数据的统计分析和结果优化。
2 结果与分析
2.1 粪肠球菌生长曲线测定
如图1 所示:粪肠球菌在0~2 h 时OD600nm值增长缓慢,表明该时期粪肠球菌处于延滞期;接种2 h 后其菌液的OD600nm值开始迅速上升,持续到14 h 时增长减慢,表明粪肠球菌在2~14 h间处于对数生长期;14~18 h 期间增长缓慢,基本维持在相对稳定的状态,说明粪肠球菌在该时段处于稳定期;18 h 以后曲线呈下降趋势,出现负增长,说明粪肠球菌的生长进入衰亡期。24 h 内菌液中的pH 值呈现先下降后趋于平缓的趋势,14 h 后pH 值稳定在4 左右。粪肠球菌在24 h 内酪胺含量变化显示:4 h 内酪胺含量快速增长,4~10 h 酪胺的含量增长缓慢,10 h 后由于前期酪胺的积累,酪胺含量有降低趋势。
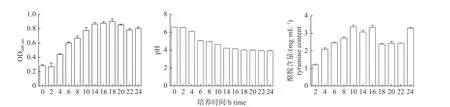
图1 24 h 内粪肠球菌生长、pH 和酪胺含量变化Fig.1 Changes of the growth,pH and tyramine content of Enterococcus faecalis within 24 hours
2.2 温度对粪肠球菌生长代谢的影响
由图2 可知:在25 ℃以下,随着温度的升高,菌液的OD600nm值逐渐增加,当温度超过25 ℃以后,菌液的OD600nm值开始缓慢降低,说明适合粪肠球菌生长的最适温度约为25 ℃,温度过高或者过低均不利于粪肠球菌的生长繁殖。在一定范围内,温度与粪肠球菌发酵液的pH 值呈负相关,随着温度的升高,培养菌液的pH 值呈依次递减,说明粪肠球菌在生长过程中通过代谢积累酸性物质,使得菌液的pH 值降低,且温度与粪肠球菌的产酸能力存在正相关的关系,温度越高,产酸越多。温度升高,菌液的酪胺含量曲线大致呈现上升趋势,温度对粪肠球菌产酪胺能力的影响较明显。通过分析发现:温度对粪肠球菌产酪胺能力的影响主要表现为对粪肠球菌的代谢活性和对培养体系中氨基酸脱羧酶活性的影响,低温条件会抑制菌株的代谢水平和氨基酸脱羧酶的活性,高温则可以杀死培养液中的微生物个体并使酶失活。
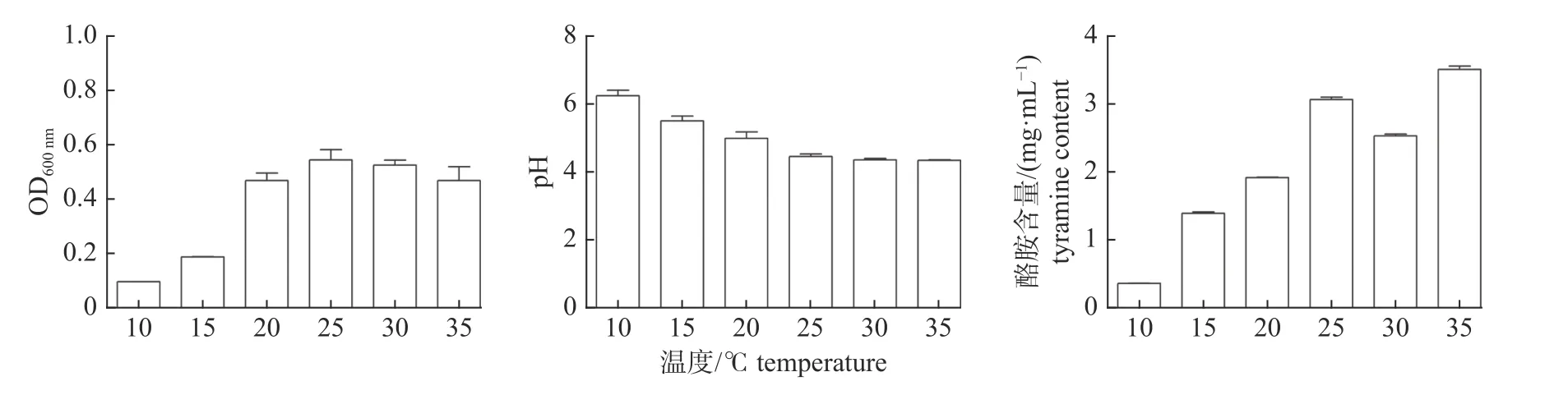
图2 温度对粪肠球菌生长、pH 和酪胺含量影响Fig.2 Effect of temperature on the growth,pH and tyramine content of E.faecalis
2.3 培养基初始pH 对粪肠球菌生长代谢的影响
由图3 可知:粪肠球菌的生长量与培养体系初始pH 呈正相关,培养液的初始pH 值越高,粪肠球菌培养液的OD600nm值也越高,说明粪肠球菌在强酸性的环境条件下生长受到抑制,提高培养环境的酸碱度可以促进粪肠球菌的生长和增殖。随着初始pH的增高,培养液的pH 变化不大,基本维持在4.3 左右,说明培养液的初始pH 对于粪肠球菌培养液的pH 值影响不明显。粪肠球菌具有自我调节能力,能够通过自身发酵产酸来调节外部环境以满足自身生长的需求。pH 值为5.0的粪肠球菌培养液中的酪胺含量最高。超过5.0 后,菌液中的酪胺产量急剧下降,说明低酸环境有利于粪肠球菌发酵产酪胺,pH 是影响氨基酸脱羧酶的关键因素。

图3 培养基初始pH 对粪肠球菌生长、pH 和酪胺含量的影响Fig.3 Effect of initial pH of medium on the growth,pH and tyramine content of E.faecalis
2.4 NaCl 质量分数对粪肠球菌生长代谢的影响
由图4 可知:NaCl 质量分数与粪肠球菌的生长呈负相关性,随着NaCl 质量分数的升高,粪肠球菌培养液的OD600nm值一直呈现下降趋势,NaCl 质量分数小于5.0%时,菌液的OD600nm值下降平缓,说明低盐质量分数下,粪肠球菌的生长虽然受到影响,但是作用不明显;当NaCl质量分数大于5.0%时,菌液的OD600nm值急剧下降,说明粪肠球菌对NaCl的耐受度为5.0%左右,NaCl 质量分数大于5.0%时,大部分菌株不能存活;当NaCl 质量分数大于8.0%时,菌液的OD600nm值下降趋于平缓,且数值几乎趋近于0,说明在高盐质量分数条件下,粪肠球菌难以存活。在0~3.0%的NaCl 质量分数条件下,部分粪肠球菌可以正常代谢产酸,使得菌液的pH 值略有下降,随着NaCl 质量分数的增加,粪肠球菌的生长受限甚至脱水死亡,不再有酸产生,同时由于中性钠盐的加入,培养液的pH 值逐渐上升,接近中性。在0~3.0%的NaCl 质量分数条件下,酪胺的产量有上升的趋势,说明在低盐质量分数条件下,部分粪肠球菌可以正常代谢产生酪胺。随着NaCl 质量分数的增加,酪胺的产量逐渐下降,说明体系中粪肠球菌的数量在减少,且钠盐的加入使得培养体系中的氨基酸脱羧酶失活,酪胺产量锐减。高质量分数的NaCl 会在发酵体系中形成高渗透压,抑制微生物的生长和降低产生生物胺菌株的氨基酸脱羧酶的活性[11]。
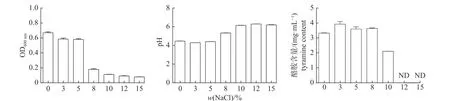
图4 NaCl 质量分数对粪肠球菌生长、pH 和酪胺含量影响Fig.4 Effect of NaCl mass fraction on the growth,pH and tyramine content of E.faecalis
2.5 氧含量对粪肠球菌生长代谢的影响
由图5 可知:在富氧条件下和厌氧条件下培养的粪肠球菌与正常条件下培养的粪肠球菌的菌液的OD600nm值差异对照明显,粪肠球菌是一种兼性厌氧性乳酸菌,在富氧和厌氧条件下均可正常生长。在厌氧条件下培养的粪肠球菌菌液的pH 值稍微低于富氧条件和正常对照条件下培养的。粪肠球菌在富氧和正常对照条件下,以分裂增殖为主,发酵产酸量少;在厌氧条件下,部分菌株发酵产酸,所以pH 值偏低。在正常和封闭厌氧条件下,培养液中酪胺的产量较高,几乎是富氧条件下的1 倍,说明粪肠球菌在氧气供应充足的情况下酪胺的产量较低,增加氧气和改善通气状况可以降低粪肠球菌发酵产酪胺能力。
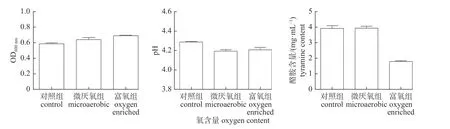
图5 氧含量对粪肠球菌生长、pH 和酪胺含量的影响Fig.5 Effect of oxygen content on the growth,pH and tyramine content of E.faecalis
2.6 响应曲面法优化控制粪肠球菌产生物胺条件
2.6.1响应面试验方案及结果
根据单因素的试验结果,结合实际发酵工艺条件,选取发酵温度、发酵液初始pH 和NaCl 质量分数3 个因素,以酪胺含量为响应值,采用Box-Behnken 中心组进行试验设计优化方案,试验因素与水平设计见表1,方案及结果见表2,方差分析见表3。
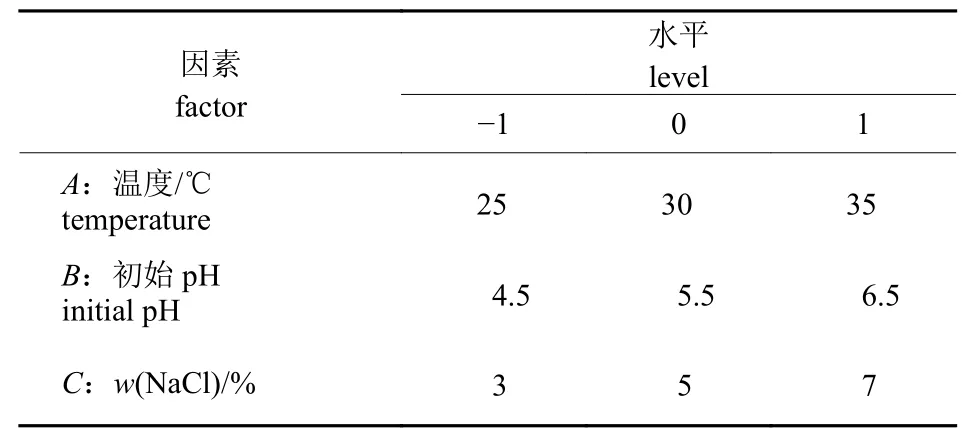
表1 响应面试验因素与水平设计表Tab.1 Variables and levels in response surface design
运用Design-Expert V8.0.6.1 软件对表2 数据进行二次多项式回归拟合得回归模型方程为:
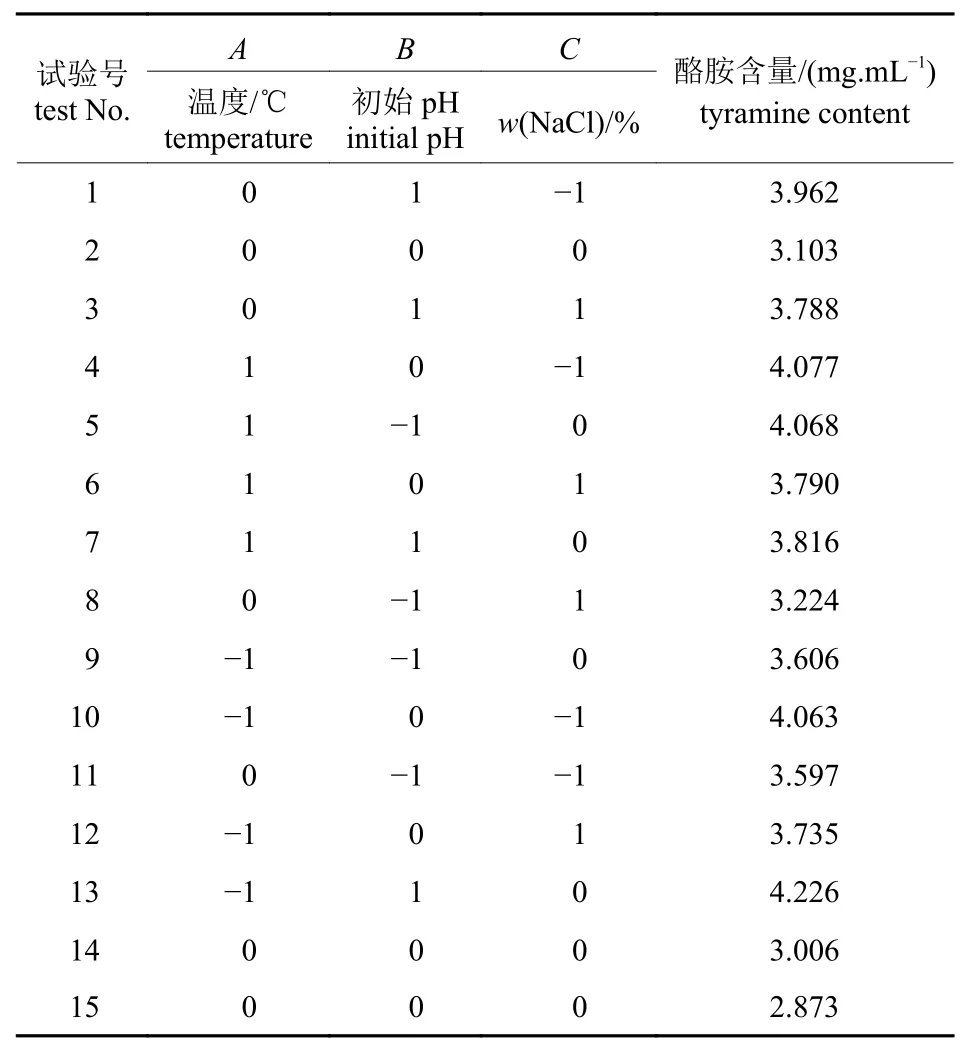
表2 响应面分析试验设计及结果Tab.2 Experimental design for response surface analysis and corresponding experimental data
Y=2.99+0.02A+0.16B-0.15C-0.22AB+0.01AC+0.05BC+0.60A2+0.33B2+0.32C2。
2.6.2响应曲面试验结果分析
由表3 可知:该模型的P值=0.002 0<0.01,表明该模型极显著,而失拟项P值=0.535 6>0.05,表明模型失拟项不显著,说明该二次回归模型具有较好的拟合度,可以用来预测分析。对模型进行回归方程系数显著性检验可知:初始pH 和NaCl 质量分数影响显著,温度影响不显著,平方项均极显著,因此各因素对粪肠球菌酪胺的产生影响不是简单的线性关系。根据F值可知在所取因素水平范围内,各因素对粪肠球菌产酪胺能力影响的顺序为初始pH>NaCl 质量分数>温度。
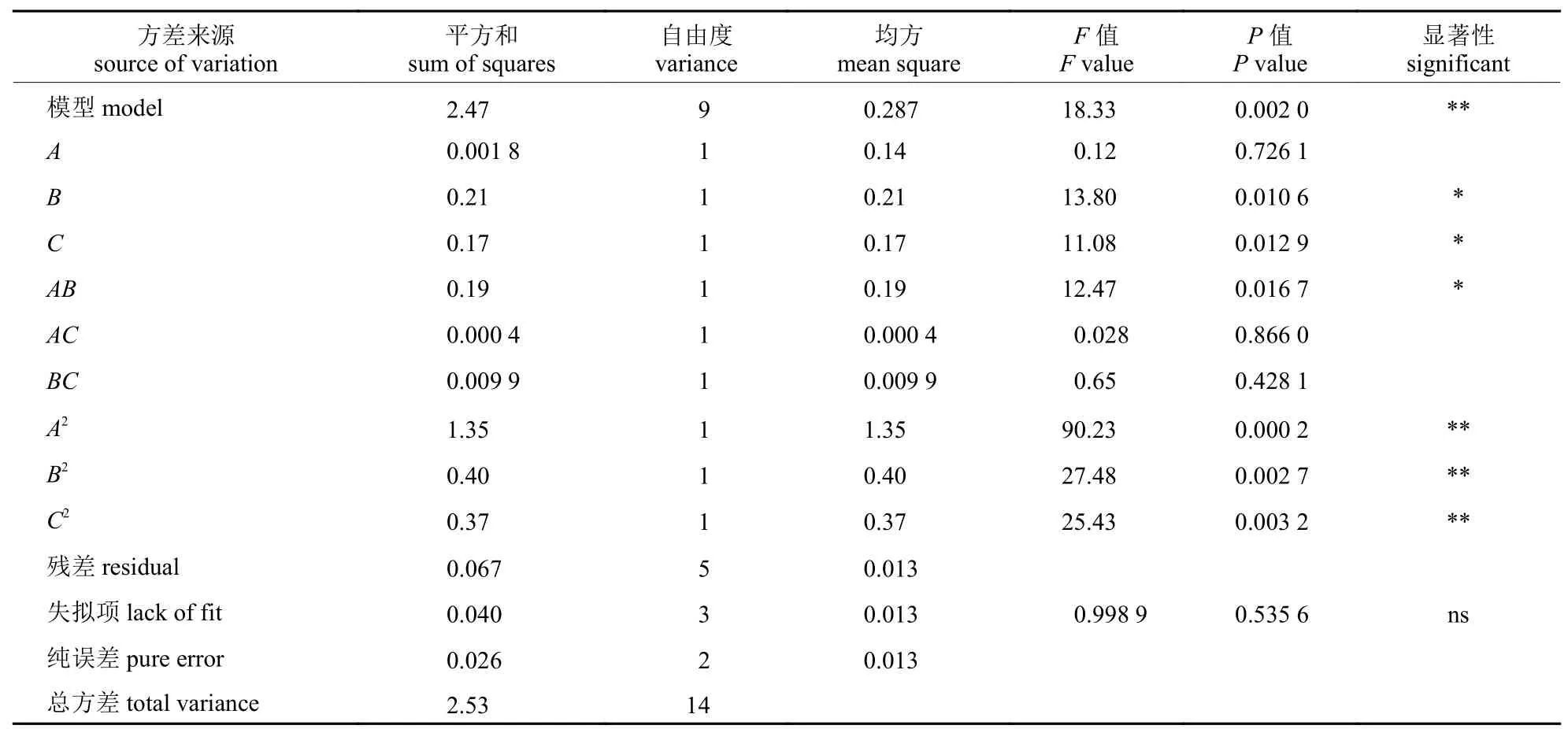
表3 响应面回归模型方差分析Tab.3 Variance analysis of response surface regression model
2.6.3各因素间的交互作用影响分析
由图6 可知:交互项AB显著(P<0.05),AC和BC不显著(P>0.05)。AB之间交互作用的变化曲面较陡峭,说明它们之间交互作用对酪胺含量影响均较大,与方差分析结果相符。各因素间交互作用对粪肠球菌产酪胺影响大小为AB>BC>AC。
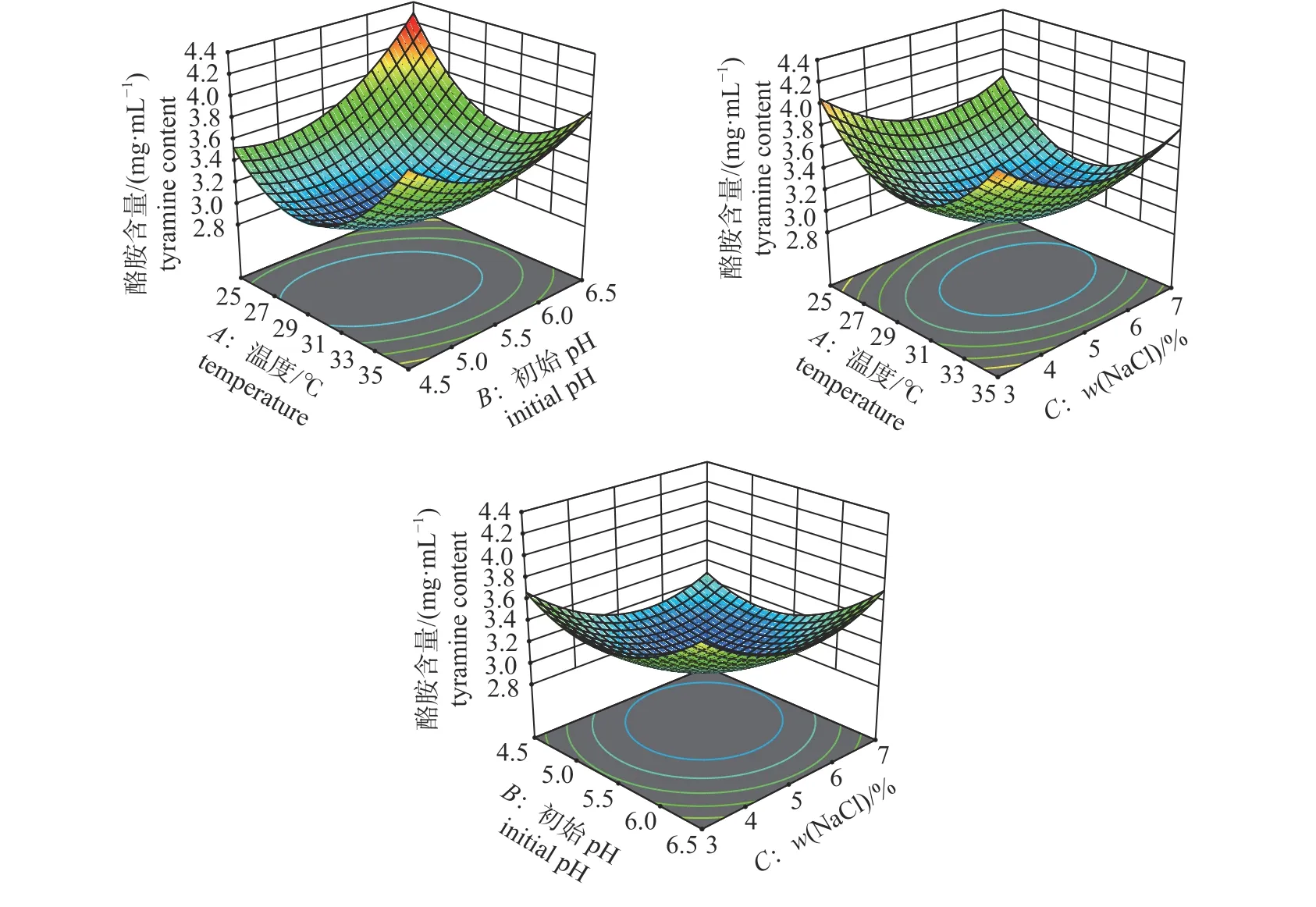
图6 两因素交互作用对酪胺含量影响的响应面图Fig.6 Response surface plot showing the effects of two factors interaction to the tyramine content
2.6.4最佳发酵条件组合的确定
通过Design-Expert V8.0.6.1 软件分析可以得出最优的发酵条件为:温度29.68 ℃,发酵液初始pH 5.22,NaCl 质量分数5.49%。在这一条件下酪胺的理论产量为2.941 mg/mL。
以确定的最优组合条件,同时考虑实际情况,选择发酵温度30 ℃,初始pH 5.5,NaCl 质量分数5.0%的条件进行验证试验,做3 组平行,所得生物胺含量为(3.030±0.079) mg/mL,与预测值接近。说明该模型与实际情况符合较好,表明运用响应面法优化得到的模型参数可靠,能够通过优化粪肠球菌发酵工艺条件来控制培养体系中酪胺的产量。
3 讨论
粪肠球菌(E.faecalis)为革兰氏阳性菌,是一种兼性厌氧型乳酸菌,也是人和动物消化道黏膜的主要菌群之一,具有维持消化道微生态平衡和促进营养物质吸收的作用,可产生天然抗生素,作为一种益生菌被广泛应用于医药学、农业畜牧饲料和食品领域[12],同时也是发酵香肠、火腿和腊肉等发酵肉制品中的优势菌[13]。鉴于生物胺对人体的危害和可能引起的食品安全问题,迫切需要寻找去除或控制发酵食品中生物胺的方法。温度主要对细菌内的脱羧酶活性有影响,温度过高或过低对细菌生长繁殖及代谢作用都将产生不利影响[14]。温度不仅能影响菌体密度、蛋白水解性和酶活性;还能抑制微生物的产胺量。乳酸菌在发酵温度较高环境中,能促使产生物胺菌快速生长繁殖从而增加生物胺的产生[15]。pH 值是影响生物胺含量的关键因素。细菌的脱羧酶在酸性环境中具有较高的活性,因此,较低pH 值能够提高细菌产生物胺的能力,但是,生物胺的积累更取决于具有脱羧酶活性的细菌的生长,迅速降低pH 值可以抑制氨基酸脱羧酶细菌的生长,进而有效抑制发酵肉中生物胺的积累[16]。MARCOBAL 等[17]将粪肠球菌编码酪氨酸脱羧酶的基因转入大肠杆菌体内进行表达,得到的酶不仅可以作用于酪氨酸生成酪胺,还可以催化苯丙氨酸脱羧生成苯乙胺,这与本试验的检测有差别,在本试验中仅检测到粪肠球菌产酪胺。徐维艳[18]研究了盐水鸭贮藏期间的1 株粪肠球菌在不同贮藏条件下的生长特性及产胺情况,其结果表明粪肠球菌可以产生酪氨酸脱羧酶,并且确定了氨基酸脱羧酶与特定生物胺积累之间的关系;徐文娟[19]对屎肠球菌和粪肠球菌酪氨酸脱羧酶基因以及酶活性的影响因素进行了研究,结果表明:底物为酪氨酸时,最适温度为25 ℃,最适pH 为6.0,NaCl浓度对酶催化酪氨酸的活性影响不大;GARDINI等[20]研究了意大利发酵香肠中粪肠球菌菌株的氨基酸脱羧酶活性,探讨了温度、氯化钠浓度和糖的添加量对粪肠球菌的生长以及对酪胺和苯乙胺积累量的影响关系,结果表明:当氯化钠浓度增加和发酵温度降低时,酪氨酸脱羧酶基因表达降低,产生酪胺含量下降,这与本试验结果相同;ALIAKBARLU 等[21]通过响应面法优化了降低伊朗白色卤水奶酪中生物胺含量的工艺。
4 结论
低温可以有效抑制粪肠球菌的生长代谢和降低粪肠球菌产酪胺能力;降低环境体系的pH 可以抑制粪肠球菌的生长,较高的pH 环境可以降低粪肠球菌酪胺的产量;适当的盐质量分数可以有效抑制粪肠球菌的生长繁殖和体系中酪胺的产生;改善培养体系的通气状况可以降低酪胺的生成量。确定的控制粪肠球菌产酪胺量最低的发酵条件为:温度30 ℃,发酵液初始pH 为5.5,NaCl质量分数为5.0%,在该条件下酪胺产量为(3.030±0.079) mg/mL。

