香格里拉葡萄产区根际土壤微生物增强作物干旱适应性的初步研究*
梅馨月,殷 绒,张国涛,邵建辉,杜 飞,邓维萍,朱书生,杨 敏
(云南农业大学,农业生物多样性与病虫害控制教育部重点实验室,云南生物资源保护与利用国家重点实验室,云南 昆明 650201)
自20 世纪90 年代以来,云南省葡萄产业迅速发展,尤其是迪庆州香格里拉地区被认为是世界上酿酒葡萄的优质产区之一。香格里拉地区位于青藏高原南缘横断山区金沙江和澜沧江流域海拔1 700~3 000 m的干冷河谷地带,是目前世界上海拔最高的酿酒葡萄产区之一[1]。葡萄的生长发育受到葡萄园土壤类型、地理地形、光照、降水量和昼夜温差等诸多自然因素的影响[2]。该区域具有土壤沙质深厚、昼夜温差大、降雨量少、光照充足和紫外辐射强等独特的生态环境,多样化的环境赋予了该地生产出优质酿酒葡萄原料的潜力[3]。赤霞珠(Cabernet sauvignon)是目前在香格里拉主栽的酿酒葡萄品种之一[4]。然而赤霞珠为何能适应干旱及寒冷等多样化的生态条件并酿造出独特卓越风味和品质优良的葡萄酒,除了地上部受到阳光积温等原因使其充分成熟保证品质外,地下部是否还受到其他因素的调控还需进一步研究。
在非生物胁迫中,干旱胁迫是制约植物生长的重要原因之一。干旱胁迫会引起植物产生负效应,如产生对植株有害的活性氧(reactive oxygen species,ROS)等[5]。近期研究表明:植物会与根际微生物建立有益的关系从而抵御非生物胁迫[6]。植物在长期的进化过程中,根际土壤微生物可能与周围的环境协同进化[7],从而对植物的生长发育和抵抗逆境具有重要作用,如活化营养帮助养分循环、诱导植物产生抗病性、产生拮抗作用抑制土壤中的有害病原菌和帮助植物抵御非生物胁迫等[8]。研究表明:多年生麦草(Lolium perenne)的根际微生物能增强寄主植物对不同生态环境和地理分布的适应性,从而在干旱的环境大面积生长[9];恶臭假单胞菌(Pseudomonas putida)和巨大芽孢杆菌(Bacillus megaterium)在干旱条件下可以促进白车轴草(Trifolium repens)的生长[10]。因此,在香格里拉的干旱环境胁迫下,赤霞珠在长期种植过程中,根际可能会募集大量有益微生物帮助自身适应干旱高寒等胁迫。
在植物的生长发育过程中,植物的根系不仅是吸收养分的器官,还能通过根系分泌物实现对根际微生物的募集和调控。根系分泌的小分子化合物(如糖、氨基酸、有机酸、酚类及其他次生代谢产物)和大分子的蛋白及黏液等既能提供微生物生长所需的养分,又能作为信号来激活或募集微生物[11]。不同的植物种类、基因型、生长阶段甚至病原菌侵染或害虫危害均会影响根系分泌物的种类和数量,从个体及群体水平调控微生物群落的结构和功能[11-13]。植物受到非生物胁迫后,会通过改变根系分泌物来调控根际微生物应对胁迫,如玉米施用过量氮肥后会通过调控根系分泌物来改变根际固氮相关微生物的组成,影响植物对氮肥的利用率[14]。长期受到重金属胁迫的植物,也会特异性地改变土壤微生物区系,增加群体中对重金属具有抗性的微生物比例,以适应重金属污染的土壤环境[15]。
目前,对不同产区赤霞珠的研究主要集中在该酿酒葡萄品种的果实品质累积规律、不同海拔对果实花色苷的影响、不同工艺对香气和色泽的影响以及受到水分胁迫的生理生化反应等方面[16-19],对于根际微生物在帮助赤霞珠抵御非生物胁迫方面的研究还未见报道。本研究选取香格里拉4 个不同海拔的赤霞珠种植区,评价干旱胁迫下葡萄根际土壤浸提液及浸提过滤液对番茄生物量、抗逆相关酶活性和物质含量的影响,进一步筛选出奔子栏葡萄园根际土壤中对尖孢镰刀菌拮抗活性较强的菌株,并测定干旱胁迫下拮抗菌株对番茄幼苗生长的影响,以期明确根际微生物在协助赤霞珠抵御干旱胁迫中的能力,为利用有益微生物缓解非生物胁迫对植物生长的影响提供理论依据。
1 材料与方法
1.1 供试材料
1.1.1供试土样
采集香格里拉地区4 个不同海拔区域的土壤,分别为云南省德钦县奔子栏镇、达日村、斯农村及阿东村的酿酒葡萄园(表1)。栽培品种均为10 年生赤霞珠。在葡萄采收期进行取样工作,每1 个海拔随机选取3 个葡萄园,每个葡萄园以“S”形取样法分别选取5 个样点,以树干为中心,挖取离树干约30 cm的行内土壤,从挖出的土壤中轻轻取出根系,抖落根系上附着的大块土壤,收集根系上附着的粒状或粉状土壤,然后将5 个样点的根际土均匀混合成1 个土壤样本。将不同区域的葡萄园根际土低温运回实验室,于4 ℃冰箱保存备用。
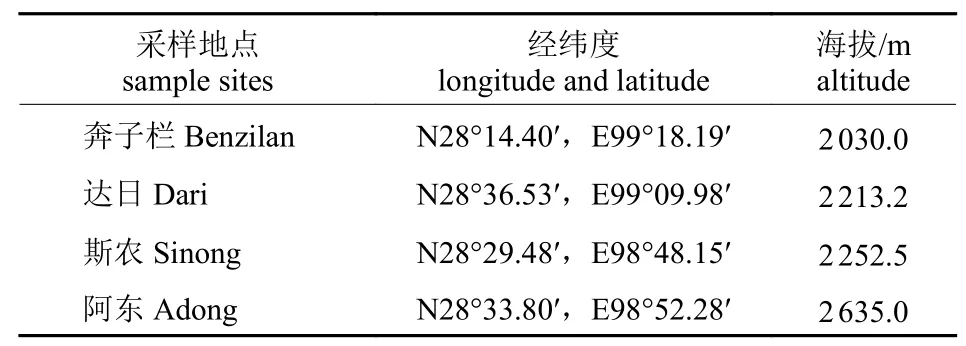
表1 供试土壤样品采集地信息Tab.1 Information of soil sample collection sites
1.1.2供试材料
植物:番茄(Lycopersicon esculentumMill.)种子,品种为毛粉808,市售。
菌株:尖孢镰刀菌株(Fusarium oxysporum),来自云南农业大学生物多样性控制病害实验室。
1.1.3供试培养基
马铃薯葡萄糖琼脂培养基PDA (1 L):200 g马铃薯,20 g 葡萄糖,15 g 琼脂。
牛肉膏蛋白胨培养基 (NA) (1 L):10 g 蛋白胨,3 g 牛肉浸粉,10 g 氯化钠,15 g 琼脂;pH调至7.0。
LB 培养基 (1 L):10 g 胰蛋白胨,5 g 酵母提取物,10 g 氯化钠,固体培养基加入15 g 琼脂。
1.2 试验方法
1.2.1供试植物的培养
试验采用基质[V(石英砂)∶V(蛭石)∶V(红壤土)=3∶1∶6]种植番茄,基质160 ℃干热灭菌3 h,室温冷却后备用。番茄种子在播种前先用1% NaClO 表面消毒5 min,再用无菌水冲洗3 次。将灭菌的基质装入50 孔育苗盘中,每孔播入1 粒番茄种子。所有育苗盘置于温室中培养,每周浇水1~2 次。待番茄生长至3~4 叶期,选取生长一致的幼苗移栽至花盆中,每盆移栽5 棵,移栽3~5 d 待幼苗恢复正常生长后备用。
1.2.2葡萄根际土壤浸提液和浸提过滤液的制备
将采自不同海拔区域的根际土壤过0.84 mm(20 目)筛后放入500 mL的三角瓶,按照土壤和无菌水的体积比为1∶10 加入无菌水后振荡(25 ℃,150 r/min,24 h),过滤收集土壤浸提液。收集到的土壤浸提液分作2 份,一份为不过滤处理的浸提液组(含养分和微生物),另一份为过滤处理(0.22 μm 滤膜)的浸提过滤液组(含养分去微生物)。
1.2.3干旱胁迫下葡萄根际土壤浸提液对番茄植株抗旱能力的影响测定
将正常生长的番茄幼苗分成2 组,第1 组加入未过滤的土壤浸提液;第2 组加入过滤的土壤浸提液,每3 d 进行1 次诱导处理。之后番茄进行正常浇水管理(每间隔2 d 浇灌1 次无菌水)和干旱模拟试验(7 d 后不浇水)。每个处理设置4 次重复,按随机区组摆放于24 ℃/16 ℃,光照强度2 000 lx,12 h 光暗交替的光照培养箱中培养。待50% 以上的番茄苗呈现中度萎蔫(叶片卷曲下垂,早晚不能恢复)时,收获所有植株于60 ℃烘箱中烘至恒质量,再分别测定每一处理中番茄植株茎叶和根系干质量。参照文献[20]的方法,分别测定叶片中过氧化氢酶(CAT)和过氧化物酶(POD)活性以及丙二醛(MDA)和脯氨酸(Pro)的含量。
1.2.4奔子栏葡萄园根际土壤细菌的分离及鉴定
采用稀释平板法分离奔子栏葡萄园土样中的细菌。取10 g 土样加入90 mL 无菌水,在摇床上120 r/min 振荡30 min,静置20 min 制成土壤悬液(稀释度为10-1)。用无菌水将土壤悬液分别稀释至10-2、10-3和10-4梯度,分别取100 μL至LB 培养基上涂布均匀,置于28 ℃恒温培养箱中培养。待细菌菌落长出后,挑取不同形态的单菌落进行纯培养,得到的纯菌落保存在NA 培养基中,置于4 ℃冰箱备用。
对分离获得的细菌按以下方法进行16S rDNA 鉴定。采用细菌DNA 提取试剂盒(昆明硕阳科技有限公司)提取细菌的基因组DNA。利用细菌16S rDNA 通用引物进行PCR 扩增。细菌16S rDNA 扩增通用引物:27F:5′-AGAGTTTGATCCTGGCTCAG-3′ 和1 492R:5′-TACGGCTACCTTGTTACGACTT-3′。PCR 扩增反应体系(50 μL)为:27F (10 μmol/L)和1 492R (10 μmol/L)各2 μL,25 μL 2×PCRTaqMasterMix,模板DNA 2 μL,19 μL 无菌去离子水。PCR 反应条件设置为:95 ℃变性4 min,94 ℃ 变性40 s,55 ℃ 退火45 s,72 ℃延伸1 min,共设30 个循环;最后72 ℃延伸10 min。扩增产物经1%琼脂糖凝胶电泳检测后送至昆明硕阳科技有限公司进行测序。本研究基于实验室前期对香格里拉4 个不同海拔区域葡萄园的根际微生物多样性的分析结果[21],筛选出奔子栏赤霞珠根际土壤中细菌丰度显著增加的5 个优势细菌属(链霉菌属、芽孢杆菌属、红球菌属、鞘氨醇单胞菌属和德沃斯氏菌属)的菌株进行后续研究。
1.2.5奔子栏葡萄园根际土壤中尖孢镰刀菌拮抗细菌的筛选
采用平板对峙法筛选对尖孢镰刀菌具有明显拮抗活性的细菌分离株。将供试病原菌用打孔器制成直径为0.5 cm的菌饼接种于PDA 平板中央,在距其2.2 cm的位置对称接种4 株不同的细菌分离物,于28 ℃ 恒温培养箱中培养。每个处理设置4 个重复,对照为只接种病原菌的PDA平板。待对照菌落长至培养皿面积的2/3 时,观察处理是否出现抑菌圈,并采用“十字交叉法”[22]测量菌落半径,按下列公式计算抑菌率。
抑菌率=[(对照菌落半径-对峙培养菌落半径)/对照菌落半径] ×100%。
1.2.6奔子栏葡萄园根际土壤拮抗细菌对番茄幼苗抗旱能力的影响测定
将分离获得的细菌菌株于LB 固体培养基上活化,挑取单菌落于LB 液体培养基中160 r/min,28 ℃振荡培养48 h,将各菌株发酵液稀释至密度一致(107~108CFU/mL)后备用。干旱胁迫下拮抗细菌对番茄植株生长的影响测定以无菌水处理作为空白对照,对正常生长的番茄幼苗进行菌液浇灌处理,每盆加入60 mL 土壤浸提液进行诱导处理,间隔3 d 后再诱导处理1 次。番茄植株的正常浇水处理与干旱模拟处理同1.2.3 节,收获后的番茄植株分别测定全株鲜质量、茎叶及根系鲜质量。
1.3 数据分析
利用BLAST 软件将获得的菌株序列在NCBI 数据库中进行同源性比对分析,选取相似度高的种属确定供试细菌分离物的分类地位。利用Microsoft Excel 2016 进行数据处理,用SPSS 26.0 软件的Duncan’s 法进行单因素ANOVA 方差分析。
2 结果与分析
2.1 根际土壤浸提液和浸提过滤液对番茄植株生物量的影响
由表2 可知:干旱胁迫条件下,与浇灌土壤浸提过滤液相比,番茄植株地上部在土壤浸提液浇灌后,茎叶干质量极显著增加。除阿东地区外,其他3 个区域的土壤浸提液处理均能显著或极显著增加根系干质量。由此可知,葡萄根际土壤中含有缓解干旱胁迫、促进番茄植株生长的有益微生物。
2.2 根际土壤浸提液和浸提过滤液对番茄植株抗旱能力的影响
2.2.1对番茄叶片CAT 和POD 活性的影响
由图1 可知:与浸提过滤液相比,浸提液处理后均能提高番茄叶片中CAT 和POD 活性。其中,奔子栏的土壤浸提液处理可以显著提高番茄叶片中CAT 和POD的活性,达日的土壤浸提液处理则可以显著提高番茄叶片中CAT的活性。斯农和阿东的土壤浸提液处理对干旱胁迫下番茄叶片中CAT 和POD 活性的诱导作用不显著。说明不同区域的根际土壤浸提液中的微生物均可以提高番茄叶片中CAT 和POD 活性,其中奔子栏的土壤浸提液可以显著增加抗逆相关酶活性,有利于缓解干旱胁迫对植物生长的不良影响。
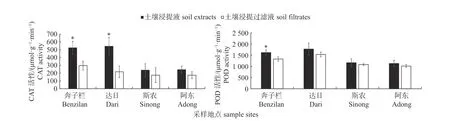
图1 干旱条件下根际土壤浸提液和浸提过滤液对CAT 和POD 活性的影响Fig.1 Effect of rhizosphere soil extracts and filtrates on the activities of CAT and POD under drought stress
2.2.2对番茄叶片MDA 和Pro 含量的影响
由图2 可知:与浸提过滤液相比,奔子栏的土壤浸提液可以极显著降低叶片中MDA 含量,减轻干旱胁迫对植物细胞的损伤;其他3 个区域的土壤浸提液对叶片中MDA 含量的影响不显著。Pro 含量测定结果显示:浸提液处理相比浸提过滤液均能显著或极显著增加叶片中Pro的含量,尤其是奔子栏的土壤浸提液可以极显著地诱导Pro 含量增加。
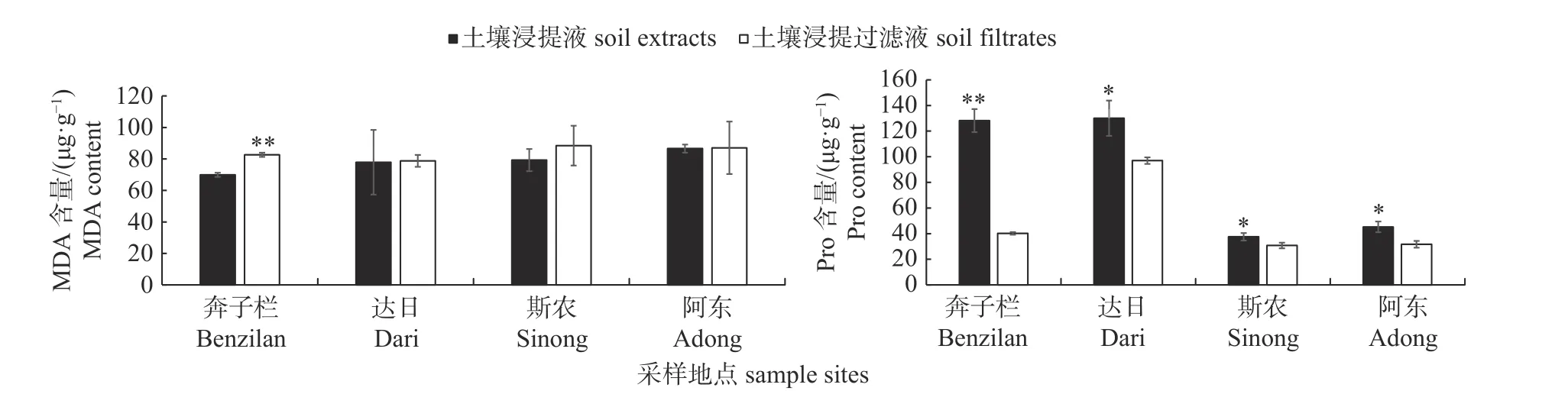
图2 干旱条件下根际土壤浸提液和浸提过滤液对MDA 和Pro 含量的影响Fig.2 Effect of rhizosphere soil extracts and filtrates on the contents of MDA and Pro under drought stress
2.3 奔子栏根际土壤微生物对尖孢镰刀菌的拮抗活性
由表3 可知:从奔子栏葡萄园根际土壤中分离得到90 株目标细菌,包括31 株链霉菌属(Strep-tomyces)菌株、44 株芽孢杆菌属(Bacillus)菌株、11 株红球菌属(Rhodococcus)菌株、2 株鞘氨醇单胞菌属(Sphingomonas)菌株和2 株德沃斯氏菌属(Devosia)菌株。其中,链霉菌属的I_56-10 和I_13-24 菌株,芽孢杆菌属的TR_56-S44、TT_9-20、TT_56-42 和TT_9-7菌株,红球菌属T_123-S40、T_123-S42、TR_123-S35S1 和3ZM63菌株以及鞘氨醇单胞菌属的4TZ122S 和4TZ16对供试尖孢镰刀菌具有明显的拮抗活性,其他菌株的抑制活性均较低。
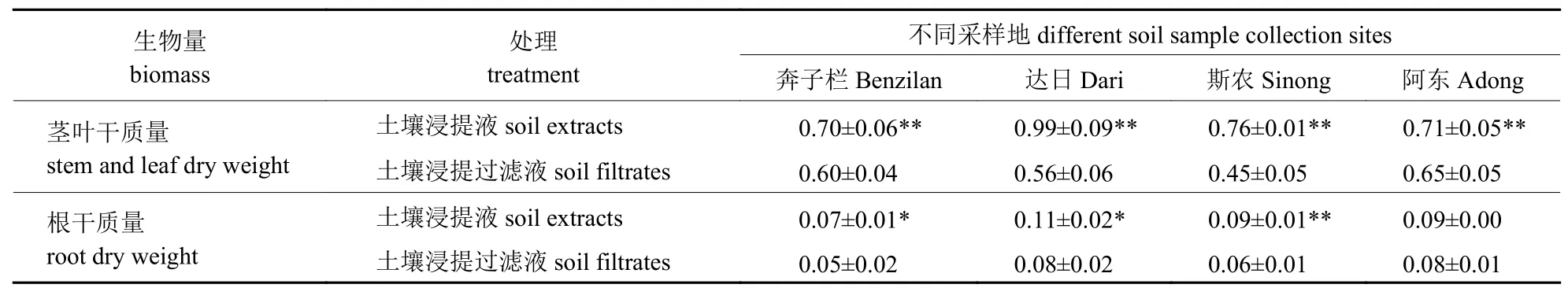
Tab.2 Effects of rhizosphere soil extracts and filtrates from four Shangri-La grape areas on the tomato biomass under drought stress g表2 干旱胁迫下香格里拉4 个葡萄产区根际土壤浸提液和浸提过滤液对番茄生物量的影响
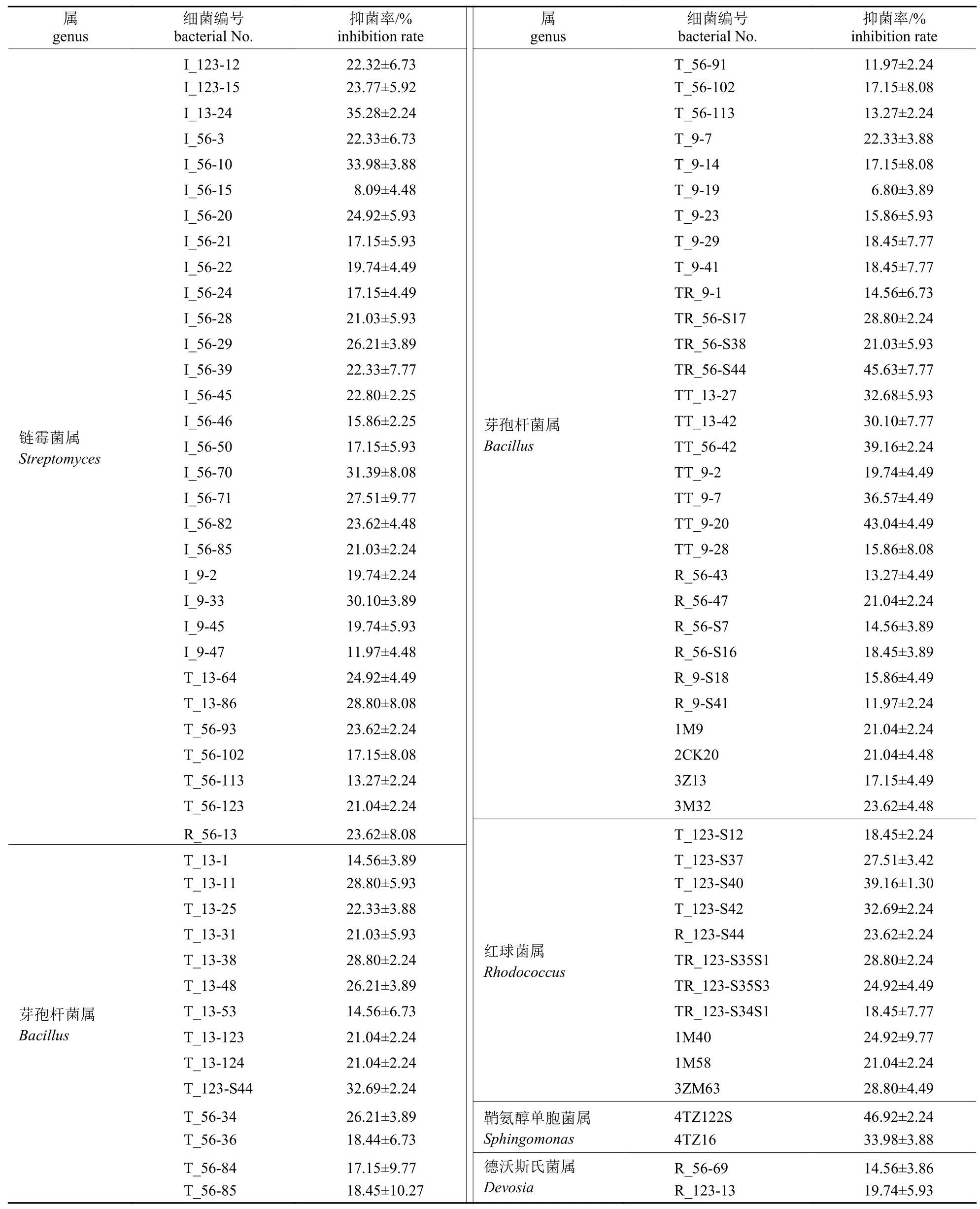
表3 奔子栏地区葡萄根际土壤中不同细菌对尖孢镰刀菌的拮抗活性Tab.3 Inhibitory activity of different bacterial isolates from Benzilan areas against Fusarium oxysporum
2.4 奔子栏葡萄园根际土壤拮抗细菌对番茄植株生长情况的影响
由表4 可知:与浇灌ddH2O 处理相比,除芽孢杆菌属的TT_9-7 菌株和红球菌属的3ZM63 菌株外,其他菌株的菌悬液浇灌番茄植株后均可增加番茄植株的全株和茎叶鲜质量,尤其是芽孢杆菌属的TR_56-S44 菌株、红球菌属的T_123-S42菌株以及鞘氨醇单胞菌属的4TZ16 菌株的增加效应最显著。

表4 干旱胁迫下奔子栏葡萄根际土壤拮抗菌对番茄植株鲜质量的影响Tab.4 Effects of antagonistic bacteria in rhizosphere soil from Benzilan areas on the fresh weight of tomato under drought stress g
3 讨论
香格里拉不同种植区赤霞珠根际土壤浸提液中存在着大量能帮助植物抵抗干旱胁迫的有益微生物,其中奔子栏的土壤微生物对干旱的缓解作用比较显著,从中分离筛选的大部分拮抗细菌均可促进番茄幼苗的生长,尤其是芽孢杆菌属、红球菌属和鞘氨醇单胞菌属。文献报道显示:根际土壤中存在着大量的植物根际促生菌,能够产生植物生长调节因子,如合成植物生长发育所需的生长素、赤霉素和细胞分裂素等[23-24],或降低植物内源乙烯的含量,从而缓解逆境胁迫对植物生长的影响[25]。如:苏云金芽孢杆菌(Bt)能合成IAA,对侧根和根毛的形成有显著促进作用,以协助宿主植物应对干旱胁迫[26];用无色杆菌ARV8(可产生ACC 脱氨酶)处理番茄幼苗后,致使番茄体内的乙烯浓度降低,增强了植株的抗旱能力[27]。前人研究表明:番茄植株中也存在植物根际促生细菌(PGPR),接种菌株后番茄植株的株高和生物量会增高。本研究中赤霞珠根际土壤中部分拮抗细菌对番茄植株的生长促进作用不显著,这可能是试验中浇灌的菌液密度较低,或是拮抗菌株间未进行组合浇灌所致。因此,后续试验需继续深入研究微生物剂量以及不同微生物组合对植株抗旱能力的影响,还需进一步结合气象条件深入分析功能性抗旱微生物是否与当地的气象条件存在协同进化。
植物主要通过体内的酶促抗氧化系统和非酶促抗氧化系统来清除ROS[28]。酶促抗氧化剂主要包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)、谷胱甘肽过氧化物酶(GPX)以及谷胱甘肽转移酶(GST)等。非酶促抗氧化系统主要包括抗坏血酸(ASA)、谷胱甘肽(GSH)、类胡萝卜素、脯氨酸(Pro)和类黄酮等。本研究中香格里拉产区4 个不同海拔葡萄园根际土壤浸提液通过增强CAT 和POD 活性来清除细胞内过量积累的ROS 和MDA,并产生对细胞结构和活性具有稳定作用的Pro,从而提高植物的抗氧化能力,减轻干旱胁迫对植物生长的影响。干旱胁迫下抗氧化酶活性及其表达水平的研究成果存在差异,这可能与植物的生长阶段、植物物种及品种对水分胁迫的耐受性或策略密切相关,也可能与胁迫处理的持续时间和强度有关。在水分胁迫下,不同植株的CAT 活性变化也不相同。如油菜在环境胁迫下CAT 活性上调[29],高羊茅的CAT 活性保持不变[30],黄麻的CAT 活性下降[31]。有研究表明:APX 对H2O2的亲和力较高,是一种比CAT 更敏感的清除酶。CAT 活性仅在严重干旱胁迫下才增强,在中度干旱胁迫下主要通过AsA-GSH 循环清除H2O2。外源添加Pro 可有效减少重金属胁迫下活性氧的过量积累,进而缓解对植物生长的不利影响[32-33]。因此,还需要深入解析植物体内活性氧清除的调控网络以及不同抗氧化酶协调作用的机制。
植物根际微生物的群落组成和丰度受植物生长代谢和根系分泌物的影响。植物在逆境胁迫下可能通过调控激素和防御物质合成相关途径来调控根际微生物的结构和功能,帮助自身抵御逆境伤害。有研究发现:兼性寄生菌侵染、植食性昆虫取食或有益微生物定殖均能激活JA 信号途径,从而诱导植物的系统抗病性或化学和物理防御物质的积累[34]。另外,植物激素(如JA 和SA)还能调控根系分泌物的成分[35]。外源添加JA 及JA 合成突变体均能显著改变根际微生物结构组成。随着植物JA 信号的变化,根系分泌物的释放会影响根际细菌和古菌的相对丰度[36]。有研究报道:外源添加MeJA 和SA 后可明显减轻干旱胁迫下对植株幼苗叶片的伤害,从而提高植株的耐旱性[37]。因此,后续试验亟须进一步深入研究植物在逆境胁迫下的根系分泌物和植物激素含量的变化及相关代谢途径,以及这些变化与特征功能性根际微生物间的相关性,为利用有益微生物菌群应对环境胁迫提供理论参考。
4 结论
香格里拉产区的赤霞珠根际土壤浸提液能增强植株体内CAT 和POD 活性,清除细胞内过量积累的活性氧和MDA,同时产生对细胞结构和活性具有稳定作用的Pro,提高植株抗氧化的能力。奔子栏赤霞珠根际土壤中分离筛选到的拮抗细菌,如芽孢杆菌属的TR_56-S44 菌株、红球菌属的T_123-S42 菌株以及鞘氨醇单胞菌属的4TZ16 菌株,均可以显著促进番茄幼苗的生长,增加茎叶及根的鲜质量,从而缓解干旱胁迫对植物生长的影响。这为利用根际土壤微生物有效缓解环境胁迫提供了理论依据。

