黄芩苷抗炎作用机制的研究进展
周 颖,张 珂,庄 煜,胡国良
(江西农业大学动物科学技术学院,江西省畜禽疫病诊断与防控重点实验室,江西农业大学动物群发性疾病检测和防治研究所,南昌 330045)
黄芩(Scutellaria baicalensisGeorgi),唇形科黄芩属植物,主产于河北、内蒙古、山西、甘肃等地,又称山茶根、土金茶根。其干燥根入药,可泻火解毒,清热燥湿,凉血安胎,主治上呼吸道感染、咳嗽、肺热、痢疾、咯血、胎动不安、温热病等[1],现已被广泛用于治疗癌症、糖尿病、炎症和氧化应激等病症[2]。黄芩含有丰富的黄酮类化合物,此类物质主要用于诱导肿瘤细胞凋亡,其中黄芩苷、汉黄芩苷、黄芩素为其有效成分[3]。黄芩苷从黄芩根部分离而来[4],其化学结构如图1所示。试验研究表明,黄芩苷具有抗炎症[4]、抗癌[5]、抗病毒感染[6]、抗氧化[7]、抗过敏[8]、抗菌[9]、安胎[10]、抗皮肤衰老[11]、促进毛发生长[12]等功能。
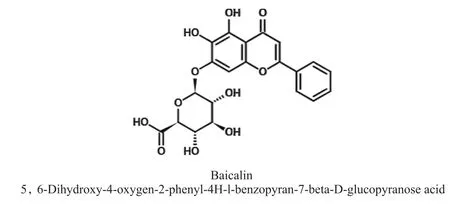
图1 黄芩苷分子式Fig. 1 Molecular formula of baicalin
黄芩苷在临床上广泛用于治疗神经炎症、肠炎、肺炎、继发性炎症等,疗效显著[4]。近年来黄芩苷的抗炎机理得到了深入研究,然而,目前未见该方面的系统总结性报道,因此本文针对黄芩苷抗炎的机制进行综述,为其在临床上的应用及深入研究提供依据。
1 调节肠道菌群
肠道微生物与宿主免疫紧密相关。大量研究显示,肠道中微生物的失调能对宿主代谢和生理生化反应产生影响,过程涉及肠道屏障完整性、胆汁酸代谢和短链脂肪酸等中间代谢产物代谢失衡,从而破坏肠道稳态,诱发肠炎[13]。而厚壁菌门及拟杆菌门细菌减少,肠道内丁酸也会减少,从而导致结肠炎等肠炎的发生[14]。通过膳食添加植物提取物可以改善肠道菌群的稳态[15]。研究表明,黄芩苷可以通过调节肠道菌群进而缓解机体炎症[16]。
Wang等[17]研究发现,黄芩苷对鸡支原体引起的炎性损伤起到了非常好的保护作用:鸡支原体感染改变了肠道菌群组成,但是,通过黄芩苷治疗可部分缓解肠道菌群异常。黄芩苷的使用显著提高了机体内共生细菌脆弱拟杆菌的丰度,使得免疫系统逐渐恢复,从而减轻了鸡支原体感染引起的肺部炎症损伤。
在H9N2型禽流感病毒感染的SPF鸡群中,黄芩苷在保护鸡肠道屏障完整性,防止回肠黏液层结构和紧密连接的损伤,提高抗氧化能力,维持血液生化指标以及抑制炎症细胞因子的产生的同时,还可以有效防止肠道细菌移位,从而抑制继发性细菌感染,进而有效治疗H9N2型禽流感引起的炎症[18]。
2 抑制NF-κB核转位
核因子κB(nuclear factor kappa-B,NF-κB)蛋白在炎症反应中起到关键作用,它可以激活白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等促炎因子释放。当细胞受到刺激后,核因子κB 抑制蛋白(inhibitor of NF-κB,IκB)被活化,泛素化修饰NF-κB·IκB复合物上的IκB亚基,使得NF-κB被解离下来,进而入核启动转录。
黄芩苷可通过抑制Toll样受体6(toll-like receptor 6,TLR6)介导的NF-κB p65核转位,从而缓解鸡毒支原体诱导的鸡肺炎症[3]。不同浓度的黄芩苷均可下调肺炎衣原体感染的血管内皮细胞上清中TNF-α的浓度,缓解血管内皮细胞损伤[19]。熊春红等[20]用脂多糖(lipopolysaccharide,LPS)腹腔注射“杜长大”断奶仔猪引起炎症,并同时注射黄芩苷,检测出腹膜和血液中炎症因子IL-8、TNF-α、IL-6和IL-1β表达量均显著下降。研究表明,黄芩苷可通过下调丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)和NF-κB通路蛋白,避免IκB蛋白被降解,降低细胞外信号调节激酶(extracellular regulated protein kinases,ERK)、p38、NF-κB p65和c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)的入核率,从而使IL-1、IL-6、TNF-α表达量减少,进而缓解缺氧再灌注导致的炎症[21]。张业昊等[22]研究发现,黄芩苷可能通过抑制TLR4信号通路来保护糖氧剥夺损伤的人脑微血管内皮细胞。
骨关节炎是一种退行性关节疾病,伴有炎症发生,可导致软骨细胞外基质降解。Chen等[23]用IL-1β刺激人软骨细胞构建体外关节炎模型,结果表明,黄芩苷可显著抑制IL-1β刺激的NF-κB活化,同时显著抑制IL-1β诱导的一氧化氮和前列腺素E2(prostaglandin E2,PGE2)的产生,以及环氧化酶-2(cyclooxygenase-2,COX-2)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、基质金属蛋白酶-3(matrix metalloproteinase-3,MMP-3)、MMP-13、血小板结合蛋白基序的解聚蛋白样金属蛋白酶-5(a disintegrin and metalloprotease with thrombospondin 1 repeats-5,ADAMTS-5)的表达和聚集蛋白聚糖、II型胶原蛋白的降解。此外,黄芩苷处理胶原诱导的关节炎(collagen induced arthritis,CIA)大鼠模型可以显著降低成纤维样滑膜细胞的滑膜组织中TLR2和髓样分化因子88(myeloid differentiation factor 88,MyD88)的mRNA表达水平以及TLR2、MYD88和NF-κB p65的蛋白水平[24]。
炎症在抑郁症的病理学中起着重要的作用。据报道称,慢性不可预见性动物应激模型或LPS诱导的小鼠海马体中过氧化物酶体增殖物激活受体-γ共激活因子-1α(peroxisome proliferator-activated receptor-gamma coactivator-1 alpha, PGC-1α)的表达受到抑制,而黄芩苷可以增加PGC-1α的表达、减轻抑郁样行为,并通过调节NF-κB信号转导来减轻神经炎症,但降低PGC-1α含量可能会逆转黄芩苷对NF-κB信号传导和神经炎症的作用[25]。
在热灭活的痤疮丙酸杆菌诱导的THP-1α细胞和灭活的注射痤疮丙酸杆菌的雄性SD大鼠痤疮模型中,黄芩苷可下调促炎因子的表达和JNK、ERK的磷酸化,并抑制NF-κB p65的核转位。此外,黄芩苷还抑制了核苷酸寡聚结构域样受体家族3(NOD-like receptor 3,NLRP3)炎性小体的活化[26]。
3 增加相关miRNA的表达
MicroRNA(miRNA)是一种内生的非编码小RNA,长度约为20~24个核苷酸,可通过参与转录后翻译抑制和mRNA的降解来独立或联合调控基因表达。
Duan等[27]研究发现,在LPS诱导的II型肺泡上皮细胞的炎症损伤模型中,A549细胞增殖抑制率显著降低,上清液中IL-6、IL-1β、PGE2和TNF-α水平也明显降低,iNOS、NF-κB p65、p-ERK和p-JNK1的表达水平显著降低,而miR-200b-3p的表达以剂量依赖性方式显著增加。因此,黄芩苷改善LPS诱导的II型肺泡上皮细胞的炎症损伤可能与其增加miR-200b-3p的表达来抑制ERK/JNK通路的激活有关。
在小鼠胰腺炎模型中,黄芩苷显著提高miR-15a水平,从而抑制CDC42/MAP3K1信号通路,同时通过靶向MAP2K4抑制JNK信号通路转导来发挥抗炎作用[28]。
Liu等[29]研究发现,黄芩苷通过上调miR-21表达来抑制NF-κB和PDCD4/JNK途径,从而减轻LPS诱导的H9C2心肌细胞炎症损伤。
4 抑制自噬
炎症与自噬联系密切,二者可相互调节。活性氧和炎症相关转录因子可调控自噬反应,而自噬又可通过Toll样受体和核苷酸寡聚结构域(nucleotide oligomerization domain,NOD)样受体信号通路来调节炎症反应。
黄芩苷可抑制LPS诱导的肠炎模型中的NF-κB活化,并抑制TNF-α和IL-1β的表达。同时,添加黄芩苷后LPS诱导的自噬相关基因的表达下调现象得到恢复,Claudin-1的mRNA和蛋白质表达水平也得以回调。该结果表明黄芩苷的抗炎作用可能与自噬通量的调节有关[30]。
黄芩苷可部分缓解鸡支原体导致的炎性细胞浸润和核碎裂、法氏囊细胞凋亡及线粒体膜变形和线粒体肿胀。黄芩苷可显著抑制自噬相关基因的mRNA和蛋白水平,同时抑制NF-κB的表达,从而下调促炎因子的表达[31]。
5 调节Treg/Th17平衡
Th17细胞和Treg细胞同属于辅助型T细胞(Th细胞),它们是维持机体免疫防御与免疫耐受平衡的重要参与者。Treg细胞主要介导外周免疫耐受,可以直接或间接抑制如CD4+CD25+T细胞、CD8+T细胞、自然杀伤细胞、树突状细胞等的功能,以达到免疫抑制。而Th17细胞主要通过分泌IL-6、IL-17A、IL-17F、IL-21、IL-22等细胞因子促进炎症的发生。因此,Treg细胞和Th17细胞在免疫调节中的作用完全相反,它们通过调节促炎因子与抑炎因子之间的平衡来维持机体正常的免疫功能。
黄芩苷以剂量依赖性方式显著减轻小鼠鼻窦炎的症状,减少组织病理变化,并降低血清中组胺和IgE的水平,同时降低IL-17A和升高IL-10水平。在小鼠淋巴细胞中,黄芩苷分别通过减弱Th17细胞和增强Treg细胞来调节Treg/Th17比例的平衡。此外,黄芩苷可提高磷酸化Smad蛋白3(drosophila mothers against decapentaplegic protein3,Smad3)和叉头框P3(forkhead box p3,FOXP3)的水平,从而促进Treg细胞抑制磷酸化信号传导及转录激活蛋白 3(signal transducer and activator of transcription 3,Stat3)和视黄酸相关的孤儿核受体γt(retinoid-related orphan nuclear receptor γt,RORγt)的表达,进而抑制Th17细胞的生长[32]。
过敏性鼻炎患者通常伴有Th17/Treg失衡和自噬激活。Li等[33]的研究表明,黄芩苷在体外能恢复Th17/Treg细胞的平衡并抑制自噬。体内试验表明,黄芩苷可通过抑制自噬来调节Th17/Treg细胞分化,从而治疗鸡卵清白蛋白(ovalbumin,OVA)诱导的过敏性鼻炎。此外,黄芩苷还减少了鼻灌洗液中不同炎症细胞的浸润,防止上皮细胞受到损伤,并改善了鼻黏膜厚度和黏液分泌。
辅助性T细胞1(Th1)、Th17和Treg的失衡在败血症和其他炎性疾病的发展中起着至关重要的作用。黄芩苷治疗盲肠结扎并穿孔小鼠可显著降低败血症相关的胰腺损伤的范围、严重性和病理变化的程度。黄芩苷可以通过抑制ras同源家族成员A-Rho(ras homolog family member A-Rho,RhoA-Rho)相关卷曲螺旋形成蛋白激酶(Rho associated coiled coil forming protein kinase,ROCK)途径来下调外周血、脾脏、胰腺组织中的Th1和Th17细胞,并上调Treg细胞。除此之外,T盒蛋白(T-bet)表达受到抑制,RORγt和FOXP3表达上调且p-STAT4、p-STAT3和p-STAT5表达降低。黄芩苷还显著降低血清和胰腺组织中IFN-γ和IL-17的表达,并上调IL-10的表达[34]。
6 调节基因表达和阻断信号通路
6.1 抑制5-LOX/LTB4信号通路
黄芩苷被证明可通过抑制5-LOX/CysLTs途径来抑制缺血后炎症损伤,且其对LTB4合酶LTA4H有相当大的结合活性。黄芩苷呈浓度依赖性减少由氧糖剥夺(OGD/R)引起的细胞凋亡。OGD/R能显著提高TNF-α、IL-1β、NF-κB、p-NF-κB和CD11b的释放,而这些作用被黄芩苷抑制。在小胶质细胞中,OGD/R诱导的NF-κB p65从细胞质向细胞核的转移及5-LOX途径蛋白的表达受到黄芩苷抑制。该结果表明,黄芩苷通过调节5-LOX/LTB4信号通路来减弱炎症反应,从而抑制BV2细胞中OGD/R诱导的极化[35]。
6.2 促进TUG1的表达
Huang等[36]利用LPS刺激肝脏L-02和THLE2细胞构建肝炎模型,而黄芩苷可减轻该模型的细胞凋亡和炎症反应。此外,LPS降低了L-02细胞中牛磺酸上调基因1(taurine-upregulated gene 1,TUG1)的表达,而黄芩苷则促进了L-02和THLE2细胞中TUG1的表达和LPS刺激的L-02细胞中p38MAPK和JNK通路失活。敲除TUG1后p38MAPK和JNK通路被激活,并上调L-02细胞中炎症因子的表达。该结果表明,黄芩苷可能是通过上调TUG1,使p38MAPK和JNK通路失活来缓解LPS诱导的炎症反应。
6.3 调控SIRT1/ HMGB1途径
Li等[37]的研究表明,黄芩苷通过激活沉默信息调节剂1(silent information regulator 1,SIRT1)使高迁移率族1(high-mobility group box 1,HMGB1)蛋白脱乙酰化,以应对急性LPS诱导的小鼠小胶质细胞BV2相关性神经炎症,并改善急性神经认知功能障碍。在海马体中,黄芩苷不仅减少了小胶质细胞中炎性细胞因子的产生,而且还调节了小胶质细胞中的SIRT1/HMGB1信号传导。黄芩苷通过调控SIRT1/HMGB1途径抑制HMGB1的释放,并抑制了LPS诱导的BV2细胞中HMGB1的核转运。而SIRT1抑制剂EX-527的使用和沉默内源性SIRT1使黄芩苷的作用在BV2细胞中被逆转。
6.4 阻断PI3K/AKT信号通路
炎症性肠病(inflammatory bowel disease,IBD)是一种非特异性的、持续性炎症的肠道慢性免疫系统疾病。黄芩苷不仅可通过减少IL-6、TNF-α和IL-1β的释放以及上调IL-10的表达水平来显著缓解2,4,6-三硝基苯磺酸(TNBS)引起的结肠炎,而且还可以促进紧密连接蛋白ZO-1和β-连环蛋白的表达,这可能是通过阻断PI3K/AKT信号通路来实现的。在体外试验中,黄芩苷能明显通过此途径抑制LPS诱导的HT-29细胞的凋亡[38]。
7 总结与展望
炎症是机体对于刺激的防御反应,通常情况下,炎症是人体自我防御的表现,但是当其过于剧烈时会危害人体健康。大量研究表明,黄芩苷适用于缓解全身或局部炎症,是一种理想的抗炎药物,黄芩苷作用的可能机制如图2所示。然而,由于黄芩苷常以其镁盐的形式存在,提取后的黄芩苷水溶性与脂溶性较差,生物利用度低,因此,如何优化提取工艺及制剂制备以提高其吸收率及生物利用度亟待解决。与此同时,黄芩苷目前的研究还局限于离体细胞及动物模型上,已有的试验结果表明,其作用位点多、机制复杂,需要进一步进行临床试验研究阐明其作用机制及药物配伍机理。

图2 黄芩苷发挥抗炎作用的可能机制Fig. 2 The potential mechanism of baicalin on anti-inflammation

