可释放一氧化氮多模式协同抗癌纳米体系研究进展
史淑文
(江苏省徐州医药高等职业学校,徐州 221116)
一氧化氮(NO)是一种性质较活泼的自由基分子,能够在细胞间、细胞内传递信息,在生物体的生命过程中发挥了重要的作用,特别是在心血管治疗、免疫系统调节、神经系统治疗等领域。除了具有以上的功能外,研究发现NO还能够诱导癌细胞的凋亡,但是NO性质不稳定、半衰期短,需要将其供体与纳米体系相结合形成NO递送体系,在特定部位释放出NO,起到抗癌作用。近年来,越来越多的研究者们尝试将NO气体治疗与传统肿瘤治疗方法相结合,改善了单一治疗方案的局限性,发挥了较好的协同抗癌效果。
1 协同放射治疗
放疗具有穿透力高、定位精确和副作用小的特点,已被广泛用于无创治疗体内深部肿瘤。然而,肿瘤部位的严重缺氧降低了放疗的效果,因此,人们将视线转移到了将放射疗法和其他肿瘤治疗方案相结合上,以提高放射射线对癌细胞的杀伤力。研究者们发现,NO是一种低氧放射增敏剂,可以有效提高肿瘤治疗效果[1-3]。
Fan等[4]设计了一种纳米治疗体系PEG-USMSs-SNO,其示意图如图1所示。该纳米治疗系统是一种核壳结构,壳表面连接NO供体S-亚硝基硫醇。当药物富集到肿瘤组织后,用X射线照射可以诱导S-N键的断裂,释放出NO气体,按需释放出的NO气体增强了氧含量较低的癌细胞对X射线的敏感性。该研究同时开展了斑马鱼和携带4T1肿瘤的小鼠活体试验,均证实X射线触发的NO释放量依赖于X射线的强度,可根据需求有效调控NO的释放量,当X射线和释放出的NO同时作用时,显示出较好的肿瘤抑制性。这项研究将X射线辐射和NO气体治疗相结合,展示出了NO气体治疗协同放射疗法在治疗体内深层缺氧肿瘤中的光明前景。
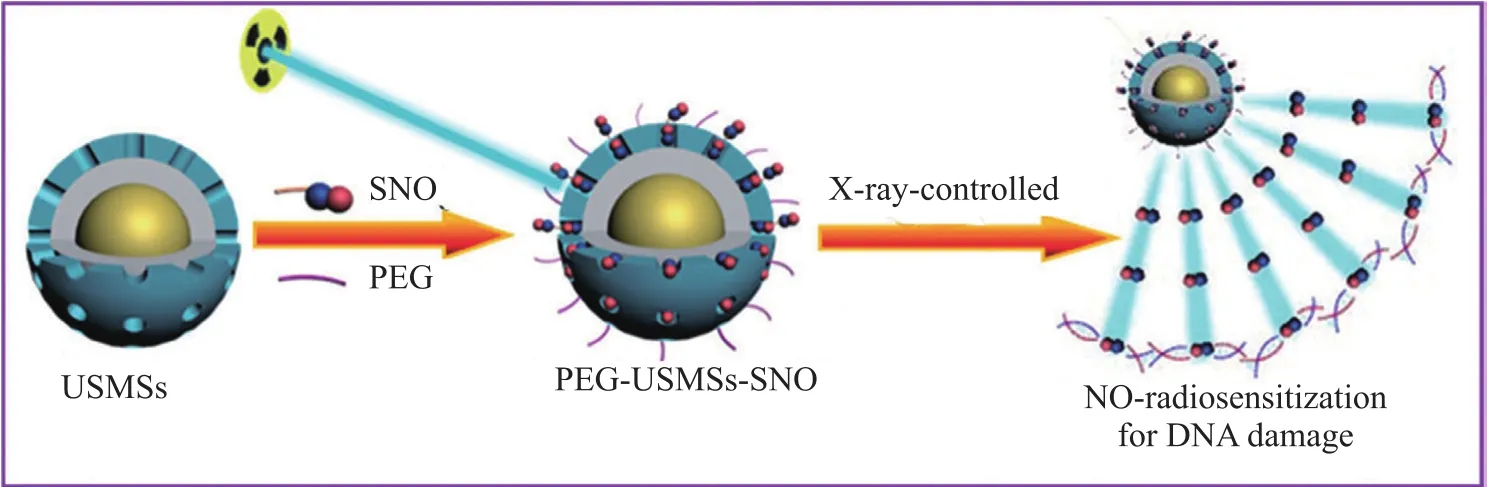
图1 NO及X射线辐射损伤DNA的示意图[4]Fig. 1 Schematic diagram of DNA damage caused by NO and X-ray radiation[4]
2 协同超声治疗
近年来,超声波在癌症治疗领域越来越受欢迎。人们不仅可以利用超声波成像来诊断疾病,还可以利用其穿透性治疗癌症。研究表明,用于诊断治疗的超声波的频率为0.75~3.00 MHz,其中1.00 MHz和3.00 MHz的超声频率使用最为频繁[5-6]。一般来说,超声波的穿透深度随超声频率的增加而增加,但是当使用聚焦超声波时,其穿透深度大大提高。有研究表明,在频率为1 MHz时,聚焦超声波的穿透深度可达到10 cm左右,甚至更深[7-8]。目前,超声治疗的技术还在不断发展,但关于将超声治疗联合NO气体治疗协同抗癌的研究不多,其中大多研究是基于超声的无创、非电离、易于控制和高穿透深度的优点,将超声作为可释放NO纳米体系的触发源[9-12]。
Zhang等[13]构建了一种超声响应的NO释放系统,其在中空介孔二氧化硅纳米粒子(HMSN)表面修饰聚乙二醇(PEG)分子和靶向分子,L-精氨酸作为 NO 供体加载到HMSN 的介孔和内腔中。如图2所示,不同于传统的激发源(如光、热和X射线),1 MHz频率的聚焦超声波能轻松穿透组织到达肿瘤部位,激活 Panc-1 肿瘤中的 H2O2,产生更高活性的含氧物质,一旦NO 释放体系进入肿瘤区域,这些含氧物质就可以有效地氧化该系统中的L-精氨酸分子,从而产生更多可用于杀死 Panc-1 肿瘤细胞的NO 气体,增加对肿瘤细胞的杀伤力。在这里,NO对破坏肿瘤组织起主要作用,而在局部目标部位施加的聚焦超声波能够穿透组织到达肿瘤细胞,刺激纳米体系产生更多的NO气体,高浓度的NO气体能有效损伤胰腺癌细胞并使其最终消融。聚焦超声疗法与NO气体治疗的协同作用增强了抗癌效果。
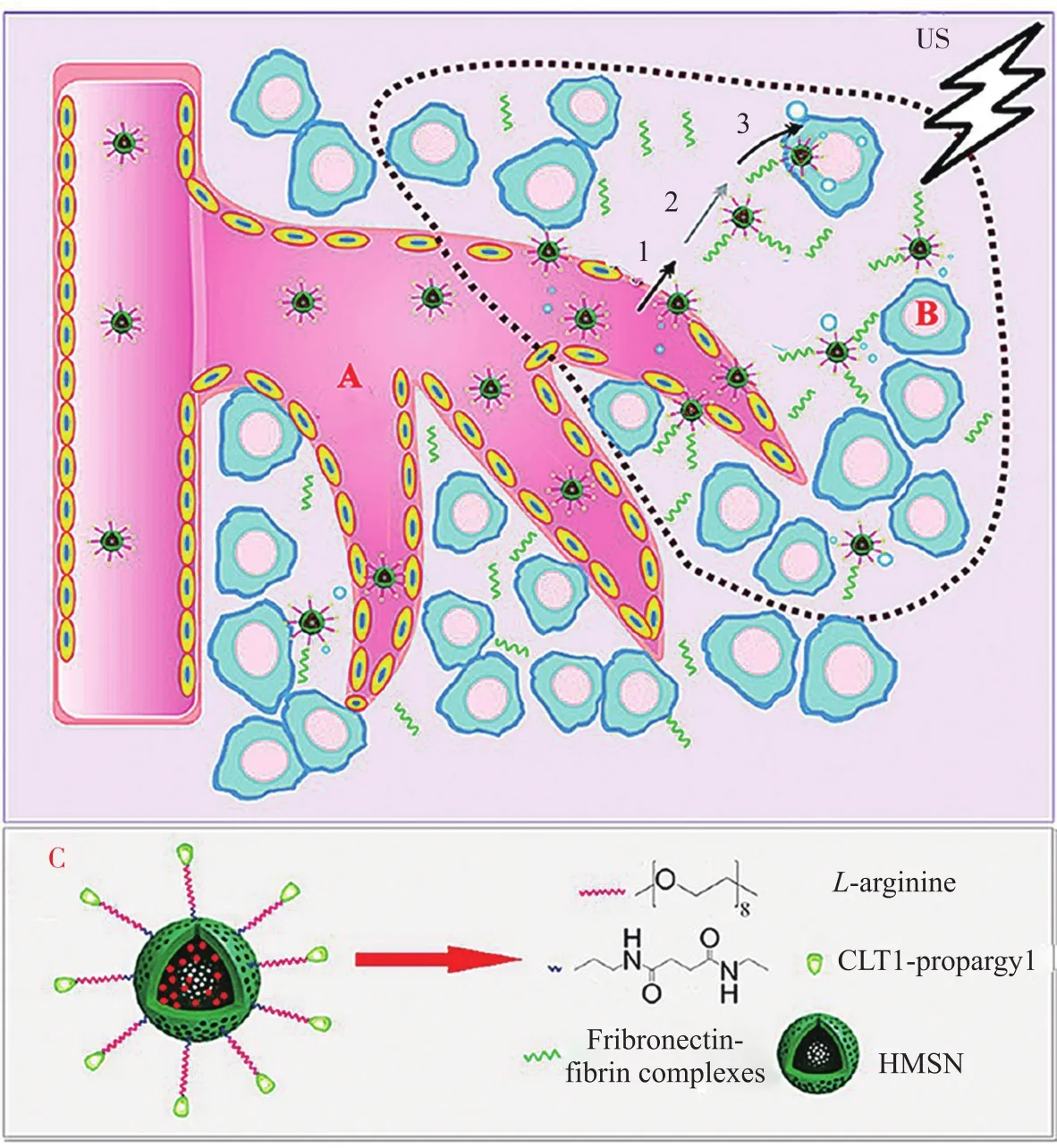
图2 超声响应的NO释放纳米体系的结构与治疗过程示意图[13]Fig. 2 Schematic diagram of the structure and the therapy process of ultrasound-responsive NO-releasing nanosystem[13]
3 协同光热疗法
3.1 光热治疗现状
光热疗法(photothermal therapy,PTT)是指分子或者纳米体系将吸收的光能转化为热能用于癌症治疗的一种方法。为了实现肿瘤的彻底消融,通常需要使用大功率激光将肿瘤加热到50℃以上,但是痛苦的治疗程序和严重的健康组织损伤限制了其实际应用[14]。另外,研究者们又研究出了一种温和的光热治疗方法,将肿瘤区域的温度控制在相对较低的水平(45℃),并且操作简单,病人康复快,住院时间短[15]。然而,光照后肿瘤细胞中热量分布不均匀以及热损伤不足会导致细胞的自我修复,如果只单独使用这种温和的光热治疗,其功效可能不尽如人意。为了改善疗效,人们逐渐将目光转移到将热消融与其他治疗方式相结合的方法[16-18]。高浓度的NO可以直接导致癌细胞的凋亡,因此,基于多模式的协同抗癌机制,研究者们提出将PTT与NO气体治疗相结合,有助于规避以上问题并提高治疗功效。
3.2 光热治疗结合NO气体治疗
Zhang等[15]报道了一种将PTT与NO气体治疗相结合的抗癌治疗方案,并构建了一种纳米复合材料(BNN-Bi2S3)。如图3所示,该纳米复合材料的光热转换效率为33.7%,这种高的光热转化效率使得癌症部位局部温度可升高到46℃,而其他正常部位温度无明显变化。该方案利用光热转化剂提供热能,结合NO气体的可控释放,实现了抗肿瘤功效的增强。

图3 近红外光诱导的NO释放协同PTT在癌细胞中的治疗机制示意图[15]Fig. 3 Schematic diagram of NO release induced by NIR and synergistic mechanism of NO and PTT in cancer therapy[15]
Guo等[19]报道了一种纳米药物体系,以氮掺杂石墨烯量子点为载体,表面共价连接钌亚硝酰化合物(NO供体)和线粒体靶向基团。以HeLa癌细胞作为模型,该复合纳米体系能够选择性富集在肿瘤细胞的线粒体细胞器中,在近红外光照射下药物富集区域温度升高,并伴随大量NO气体的释放。体外细胞试验和小鼠体内试验均证明NO气体治疗协同PTT疗法展现出较强的抗肿瘤性能。
4 协同活性氧疗法
细胞内过量的活性氧(reactive oxygen species,ROS)能诱导细胞凋亡,较高浓度的ROS 则会引起细胞坏死,并且ROS还能够诱导细胞产生自噬现象,从而导致癌细胞凋亡。NO气体能够增强癌细胞对ROS的敏感性,可以与不同的分子(即O2、·OH、H2O2)反应形成各种活性氮氧化物(RNOS),如N2O3或ONOO-,以诱导DNA断裂并抑制酶的活性,从而导致肿瘤细胞凋亡[20-24]。
Zhu等[25]开发了一种新型多壳纳米粒子(CuS@SiO2-L-Arg@PCM-Ce6,CSLPC),可利用ROS和NO气体的协同作用治疗肿瘤。如图4所示,该新型纳米粒子用模板法合成,以硫化铜(CuS)为核,多孔二氧化硅(SiO2)纳米粒子为壳,水溶性的L-精氨酸NO供体负载在SiO2腔内。为了解决L-精氨酸在循环中过早释放的问题,将Ce6预先封装在一种相变材料(phase-change material,PCM)内,并用该PCM密封孔隙。CuS@SiO2在近红外光区域有较高的吸光率,产生的光热效应导致纳米体系解离,从而准确可控地在肿瘤部位释放L-精氨酸和Ce6。然后使用660 nm激光激活Ce6以产生大量的ROS,氧化L-精氨酸产生NO气体,杀死癌细胞。在特定部位可控释放的“联动机制”解决了无法将ROS和NO气体有效地提供给肿瘤部位的难题。NO气体和ROS的协同作用还成功地弥补了单一ROS治疗在肿瘤低氧微环境中不良的治疗作用。

图4 热控制药物释放及协同光动力/气体治疗的CuS@SiO2-L-Arg@PCM-Ce6纳米粒子的示意图[25]Fig. 4 Schematic diagram of the CuS@SiO2-L-Arg@PCM-Ce6 nanoparticles for thermal controlled drug release and synergistic photodynamic/gas therapy[25]
除了利用光照激发位于肿瘤部位的光敏剂产生ROS,还可以通过增加肿瘤细胞内的过氧化氢(H2O2)含量,利用一系列反应产生ROS,再与NO气体结合产生高细胞毒性的ONOO-,达到显著的抗肿瘤效果。例如,Cao等[26]设计了一种自组装的纳米体系,该纳米体系以L-精氨酸作为NO供体,肿瘤细胞内过量的H2O2通过二茂铁(Fc)催化的芬顿(Fenton)反应和哈伯·韦斯(Haber-Weiss)反应产生·O2-,细胞内的NO气体和·O2-结合产生高细胞毒性的ONOO-。试验结果证实,这种基于ROS和NO气体的协同疗法具有显著的癌细胞抑制作用。
5 协同化疗
5.1 协同普通化学药物
大量研究已经证实,癌症的化学治疗效果不佳是由于肿瘤细胞的抗药性[27-28]。而导致抗药性的主要原因是肿瘤细胞表面P-糖蛋白(P-glycoprotein)的过表达。P-糖蛋白可以将化疗药物排出到细胞外,使得癌细胞内的药物含量减少,降低治疗效果。因此,多药耐药性癌症治疗迫切需要一种能有效抑制P-糖蛋白表达以改善细胞内药物蓄积的有效方法。
Riganti等[29]提出NO能够抑制P-糖蛋白和多药耐药性相关蛋白在肿瘤细胞上的表达,使得药物较多地累积在细胞内,从而改善化学药物对耐药性癌细胞的治疗效果。Kim等[30]和Yoo等[31]报道了通过抑制P-糖蛋白的表达改善癌细胞的耐药性的研究,证实了NO的这一特性。Chung等[32]组建了一种空心微球,将NO供体[二(氨乙基)-1-羟基-2-羰基-1-三氮烯]和化疗药物伊立替康封装进该微球内部。将该微球注射到酸性肿瘤组织中后,H+透过空心微球的外壳并与封装在内的NO供体反应产生NO气体,改善抗药性,使得伊立替康药物在细胞内的积累量超过细胞杀伤阈值,增强了其抗肿瘤活性。因此,这种pH响应性空心微球系统为治疗多药耐药性的癌症提供了一种潜在有效的治疗方法。
Ding等[33]进一步证明了NO通过抑制P-糖蛋白表达,展现出了更强的与化疗药物的协同治疗效果。该研究报道了一种多肽涂覆的聚多巴胺纳米复合物[聚(L-半胱氨酸)-b-聚(L-赖氨酸)-b-聚(环氧乙烷)]连接S-亚硝基硫醇NO供体和 2,3-二甲基马来酸酐(DMMA),用作 pH 敏感的多肽层,有独特的电荷逆转能力。该纳米复合物在生理环境(pH 7.4)中较稳定,通过高渗透长滞留(enhanced permeation and retention,EPR)效应到达肿瘤细胞环境(pH 6.8)后,纳米复合物表面的负电荷转换为正电荷,使得药物递送和细胞摄取能力增强。在近红外光的辐射下,释放出的高浓度NO气体抑制P-糖蛋白表达,减少药物流出,从而使化疗药物阿霉素(doxorubicin,DOX)起作用。研究表明,该纳米材料能够完全根除MCF-7/ADR肿瘤,为癌症研究中的联合治疗提供了有效的策略。
5.2 协同铂类药物
铂(Pt)类药物也是一类重要的癌症治疗药物,如顺铂、卡铂和奥沙利铂。二价铂的药物对机体有严重的毒副作用,因此,开发出相对惰性的四价铂前体药物是非常必要的。四价铂前体药物本身没有毒性,但进入肿瘤细胞后,细胞中的还原性物质将其还原为二价铂药物,针对性的对抗癌细胞,有效降低了二价铂对身体其他部位的损害[34-38]。
研究者们已经证明,NO气体可以增强铂类药物对人类癌细胞的细胞毒性[39],NO气体和铂类药物联合会产生积极的协同抗癌作用[40-42]。Pramanick等[43]通过将光响应的硝基苯与光不稳定的聚合物胶束组合,设计了一种光触发NO释放的铂前体药物(图5)。胶束进入到细胞内后,紫外光照射促进硝基苯解离释放出NO气体,减轻癌细胞的耐药性,同时,光不稳定的疏水基团从胶束中裂解出来,NO供体的亲水性增强,从而导致铂 (IV) 前体药物的快速释放。铂(IV)前体药物和NO气体治疗的协同治疗策略产生了增强的抗癌作用。
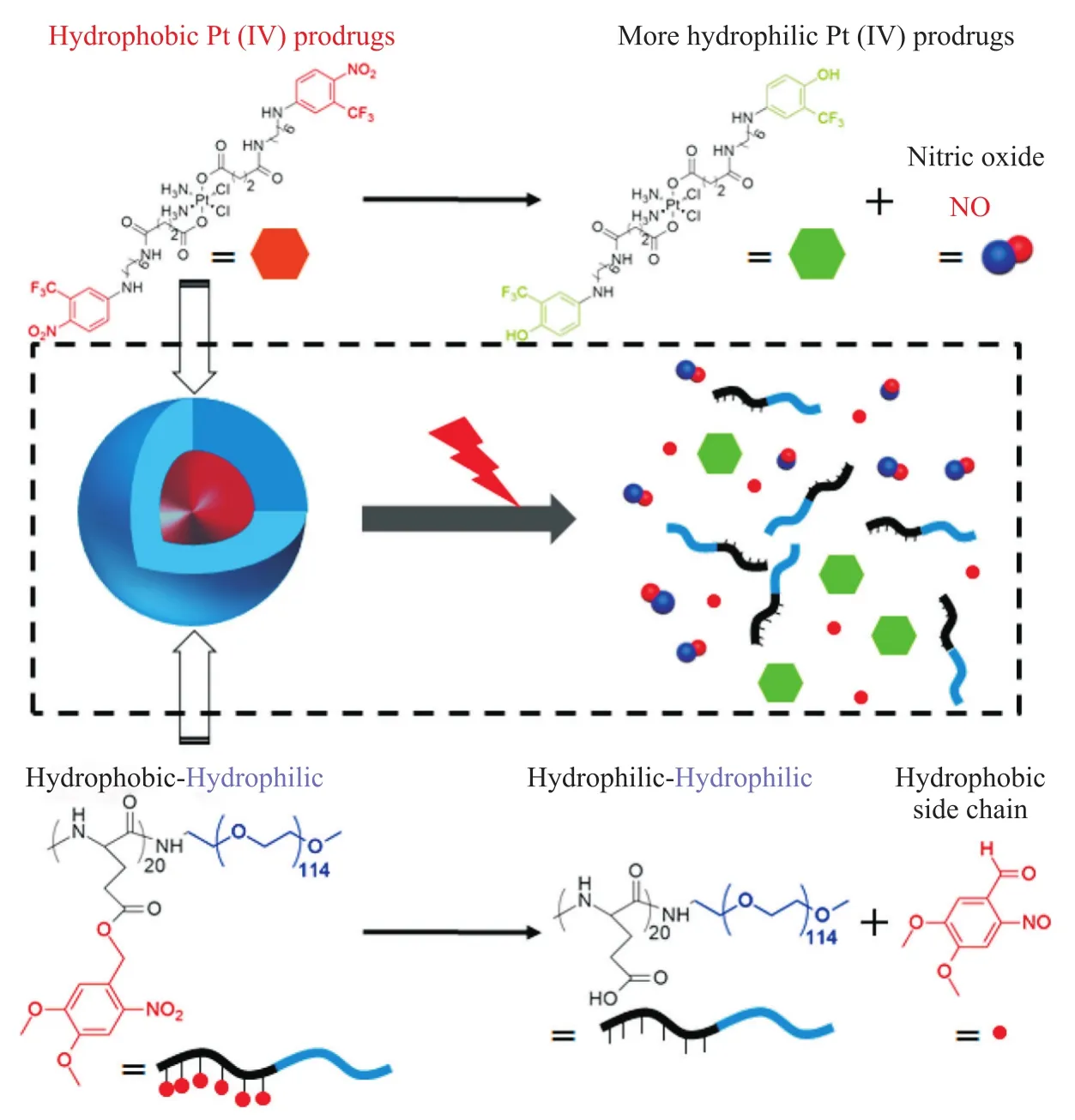
图5 光触发释放NO的铂(IV)前体药物[43]Fig. 5 Schematic diagram of the photoactivated NO-releasing Pt (IV) prodrugs[43]
6 多模式协同
除了将单一模式的肿瘤治疗方案与NO气体治疗相结合,也有研究者尝试将NO气体治疗与多种模式结合,以求达到更好的治疗效果[44-45]。Shi等[46]报道了一种纳米体系,该纳米体系以量子点为载体,共价结合了金属NO供体、四价铂前体药物和叶酸分子,将NO气体与PTT、铂类药物结合实现三模式协同治疗。如图6所示,该纳米体系选择性靶向叶酸受体过表达的肿瘤细胞,在肿瘤细胞的酸性环境下释放出二价铂药物,对癌细胞产生细胞毒性,同时,808 nm 近红外光照射导致NO的释放并伴随PTT的产生,损伤肿瘤细胞。与只存在单一治疗模式的对照药物对比,该三种治疗模式相结合的纳米体系表现出更显著的抗癌功效。

图6 纳米体系(N-GQDs@Ru-NO-Pt@FA)的结构以及NO与铂类药物、PTT协同攻击癌细胞示意图[46]Fig. 6 Schematic showing nanosystem (N-GQDs@Ru-NO-Pt@FA), and its synergistic attack on cancer cells through NO, Pt-based drug and PTT[ 46]
7 总结与展望
NO通过破环细胞内的主要物质来诱导癌细胞的凋亡,NO气体治疗作为一种新兴的治疗模式,还可以与其他癌症治疗模式结合,起到增强的协同抗癌效果。放射治疗能够通过X射线的高穿透力和精准定位治疗体内深藏的肿瘤,但肿瘤细胞的严重缺氧降低了X射线对其的杀伤力,而NO气体能有效增强缺氧癌细胞对X射线的敏感性[1-4]。传统的超声波可以诊断癌症,还可以穿透组织辅助治疗肿瘤,超声波和NO气体治疗的结合大大增强了抗肿瘤效果[9-13]。光热治疗利用光能转化成热能,使肿瘤部位温度升高消融癌细胞,但是温度过高会损伤正常人体组织[14]。若采用温和的热消融方式又会使癌细胞产生自我修复,因此将温和的光热治疗与NO气体治疗结合可有效改善治疗效果[15-18]。ROS能够诱导肿瘤细胞坏死,而NO气体能够与ROS分子结合增强癌细胞对ROS的敏感性[25-26]。传统的化学治疗会使癌细胞产生耐药性[27-28],而NO气体可通过抑制P-糖蛋白的表达降低耐药性,增强细胞内的药物富集,协同抗癌[29-33]。
因此,将NO气体治疗与其他的肿瘤治疗方式结合,组成多模态的NO释放纳米体系协同机制是非常有价值和潜力的。然而,尽管有很多文献报道了这方面的研究,但NO气体的协同抗癌治疗应用还面临一些问题和挑战:1)设计出能够在特定肿瘤组织可控释放NO的纳米体系,提高纳米体系的靶向效率,并研究药物的有效释放性能,减少药物的损耗及对其他组织的副作用;2)增加NO协同治疗模式的机理研究,为协同抗癌治疗提供更多理论依据。
综上所述,以长远的目光来看,研究并不断改进NO气体与其他抗癌治疗方式的结合来提高肿瘤治疗效率将为癌症的治疗起到推动作用。

