菊粉对ApoE-/-小鼠动脉粥样硬化症的保护作用
王丽娟,李一唯,杨立波,严宁,王浩,贾绍斌*
(1.宁夏医科大学临床医学院,宁夏银川 750004)(2.银川市第二人民医院心内科,宁夏银川 750011)(3.宁夏医科大学基础医学院,宁夏银川 750004)(4.宁夏医科大学总医院心脏中心,宁夏银川 750081)(5.国家卫生健康委员会代谢性心血管疾病研究重点实验室,宁夏医科大学,宁夏银川 750004)
动脉粥样硬化(Atherosclerosis,AS)是一种与脂质代谢障碍有关的、主要累及大、中动脉的全身性疾病,病变特征是血液中脂质在动脉内膜沉积并引起内膜发生坏死、斑块形成、纤维化病理损害,伴有显著升高的血浆总胆固醇(Total cholesterol,TC)、甘油三酯(Triglyceride,TG)、低密度脂蛋白(Low density lipoprotein,LDL)含量。AS是冠心病、脑梗死及外周血管病的主要病变基础之一[1]。心血管疾病是我国目前死亡率最高的疾病,占居民死亡构成的40%以上,并且仍处于上升阶段,迫切需要丰富安全、有效的干预策略与手段[2]。
近年来,越来越多的研究证实肠道菌群的改变与AS疾病的发生发展密切相关[3,4]。正常生理情况下,宿主肠道内定植着大量的肠道菌群包括细菌、病毒、原虫、蠕虫和真菌,这些肠道菌群作为一个“特殊器官”,在宿主生命过程中发挥着重要的作用[5]。但AS疾病中肠道菌群发生显著改变。采用16S rRNA测序分析动脉粥样硬化症患者与健康志愿者肠道菌群发现存在显著差异,如在属水平上,Collinsella菌在动脉硬化患者肠道内显著增多,与此同时,Roseburia、Eubacterium与健康者相比显著减少[6,7]。另一项研究表明,肠道菌群中拟杆菌、梭菌属、乳杆菌与动脉粥样硬化以及冠心病密切相关[8],但是确切的相关机制尚不清楚。肠道菌群中乳酸杆菌(Lactobacillus plantarum)能够缓解部分患者疾病,并且增加患者肠道菌群多样性,降低炎症水平与胆固醇水平[9]。
慢性炎症已被证实参与了包括AS在内的多种慢性病的发生发展[10]。动脉粥样硬化病理改变过程中,多种促炎细胞因子如肿瘤坏死因子(Tumor necrosis factor,TNF)-α、白细胞介素(Interleukin,IL)-1β、IL-6等显著增加[11]。ApoE存在于除了LDL以外的所有脂蛋白中,主要通过LDL受体(LDLR)途径和非LDLR途径参与血浆TC、TG的转运与清除[12]。在ApoE-/-基因敲除小鼠中证实,采用Tlr4和/或Myd88基因敲除可以减少炎症因子的产生,进而减少主动脉斑块的形成[13,14]。与此相对应地,临床研究表明AS损害部位的炎症也明显加重[15,16]。
菊粉(Inulin,INU)作为一种植物来源的膳食纤维,其本身不会被机体所吸收,但作为重要的益生元已在多种慢性代谢性疾病中被证实具有改善作用,如酒精性肝病[17]、非酒精性脂肪性肝病[18]、多囊卵巢综合征[19]、Ⅱ型糖尿病[20]、结肠炎[21]和结肠癌[22]。但是INU干预对于AS的研究报道不多且不一致,本研究旨在确定菊粉干预动脉粥样硬化ApoE-/-小鼠的作用及对于炎症和肠道菌群的影响,为心血管疾病的防治提供实验数据与思路。
1 材料与方法
1.1 实验材料
1.1.1 主要仪器设备
AU400全自动生化分析仪,奥林巴斯;Multiskan GO全自动酶标仪、TRACE 1310-ISQ LT气-质联用仪,赛默飞;DMI3000倒置显微镜及数码摄像系统,莱卡;AccuriTMC6流式细胞仪,BD。
1.1.2 试剂
鲎试剂检测试剂盒,厦门鲎试剂;油红O染色、马松染色和HE染色试剂,北京索莱宝;流式多重蛋白定量(Cytometric bead array,CBA)小鼠炎症因子检测试剂盒,BD;短链脂肪酸(Short-chain fatty acids,SCFAs)标准品,Sigma-aldrich;PCR引物,上海生工;PCR反应采用Phusion®High-Fidelity PCR Master Mix试剂盒,New England Biolabs。
1.1.3 实验动物、饲料及菊粉
45只8周龄雄性ApoE-/-小鼠(20~22 g),购自北京维通利华实验动物有限公司,其许可证号为scxk2016-0006,在宁夏医科大学实验动物中心无特定病原体(Specific pathogen free,SPF)环境下饲养。所有实验动物研究均通过了宁夏医科大学伦理委员会伦理审核(2016-106)。菊粉购自中国丰宁平安高科实业有限公司,纯度为91%。高脂饮食(High fat diet,HFD)饲料(60%脂肪,20%碳水化合物,20%蛋白质,含1.2%胆固醇,饲料编号TP28520)购自南通特洛菲饲料科技有限公司。
1.2 实验设计
参照文献报道方法采用高脂ApoE-/-小鼠建立AS模型[23]。将小鼠随机分为对照组(CON)、AS模型组(AS)和INU干预AS组(AS+INU)。其中,CON组小鼠给予正常饮食,AS组给予HFD饮食,AS+INU组在AS的基础上饮水中加INU(10 g/kg体重)。每周监测体重(body weight,BW),每日记录食物摄入量。干预12周后,分别采集新鲜小鼠粪便(5个(只)/组)用于后续肠道菌群测序及SCFA分析。随后处死小鼠,收集血浆和主动脉根部组织用于后续实验。
1.3 检测指标及实验方法
1.3.1 主动脉根部病理学观察
主动脉根部组织用4%多聚甲醛固定,常规石蜡包埋切片后,分别采用油红O染色、马松染色、苏木素-伊红(Hematoxylin-eosin,HE)染色,经光学显微镜观察各组病理改变并采用Image J软件进行定量分析。
1.3.2 血脂指标的检测
全自动生化检测仪分析血浆中TC、TG、LDL和高密度脂蛋白(High density lipoprotein,HDL)的变化。
1.3.3 16S rRNA肠道菌群测序与分析
各组分别无菌收集新鲜的小鼠粪便标本各5个,立即保存在-80 ℃冰箱。待各组收齐后,采用以往报道过的十六烷基三甲基溴化铵(Cetyltrimethylammonium bromide,CTAB)方法[24]提取粪便样本中DNA。经1%琼脂糖电泳鉴定后,采用细菌V3-V4区引物(341F 5'-CCTAYGGGRBGCASCAG-3' 和 806R 5'-GGACTACNNGGGTATCTAAT-3')进行PCR扩增。建库后送北京诺禾致源公司采用Illumina HiSeq 2500测序平台测序及分析。
1.3.4 鲎试剂法检测血浆脂多糖(Lipopolysaccharide,LPS)水平
采用鲎试剂盒说明书检测各组血浆LPS水平。
1.3.5 微量样本多指标流式蛋白定量技术(CBA)检测炎症因子
按照小鼠炎症因子CBA检测试剂盒的说明书要求,首先准备好标准品、混合微球及待测样本(血浆和主动脉根部组织研磨上清液)。其次,每个流式管中分别加入混合微球50 μL。随后标准品流式管和待检测样品管中分别加入不同浓度标准品和待测样品50 μL,涡旋混匀。接着流式管中分别加入PE标记的检测试剂50 μL,混匀后室温避光孵育2 h。每管分别加入细胞染色缓冲液1 mL并混匀,300 ×g离心5 min,弃上清后重复洗涤1次。最后,所有流式管分别加入细胞染色缓冲液300 μL重悬微球,立即上机检测样本并采用FACP软件分析炎症因子含量。
1.3.6 气质联用(Gas chromatography-mass spectrometer,GC-MS)检测SCFAs
采用美国Thermo公司的TRACE 1310-ISQ LT气-质联用仪。色谱柱为Agilent HP-INNOWAX毛细管柱(30 m×0.25 mm×0.25 μm)。分流进样,进样量1 μL,分流比为10:1。进样口温度250 ℃,离子源温度230 ℃,传输线温度250 ℃,四极杆温度150 ℃。程序升温起始温度90 ℃,然后以10 ℃/min升温至120 ℃,再以5 ℃/min升温至150 ℃,最后以25 ℃/min升温至250 ℃维持2 min。载气为氦气,载气流速1.0 mL/min。质谱(MS)条件:电子轰击电离(EI)源,SIM扫描方式,电子能量70 eV。标准品曲线的制作:称取适量的乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸、己酸标准品,用乙醚配分别配制成0.01、0.1、0.5、1、5、10、25、50、100、250、500 μg/mL十一个标准浓度梯度。对标准液的浓度系列分别进行GC-MS检测,以标准品的浓度(X)为横坐标,标准品与内标的峰面积比值(Y)为纵坐标进行线性回归分析,绘制标准曲线。同时进行精密度、重复性、回收率、定量限的考察。
1.4 统计学方法
所有数据经SPSS 20.0统计软件和Graphpad Prism 5软件进行数据统计和图表制作。数据采用均数±标准差(X±s)表示。三组之间比较采用方差分析。结果符合正态分布,则两两比较采用t检验进行差异性分析。p<0.05表示差异有统计学意义。
2 结果与讨论
2.1 菊粉干预显著改善动脉粥样硬化小鼠血管病变
从图1a、b中的大体油红O和显微镜下油红O染色结果中可以发现,与CON对照组大体油红O及显微镜下油红O染色百分比3.66%、1.19%相比,AS模型组分别为50.39%、8.76%,差异均有统计学意义(p<0.001),表明AS疾病发生发展中动脉血管中脂质显著堆积。而在INU干预后分别减少至40.54%、6.51%,差异均有统计学意义(p<0.01),证实INU的长期干预能显著减缓AS血管斑块的脂质沉积,有助于改善疾病。马松染色结果表明,AS组动脉血管纤维化水平72.06%与CON组的2.57%相比显著加重(p<0.001,图1a、d);而INU能够改善血管纤维化水平至57.18%,差异有统计学差异(p<0.01,图1a、d)。进一步通过常规病理HE染色表明,AS疾病组的动脉血管病理损害较为严重,而其可以被INU干预后部分逆转。

图1 主动脉根部组织切片染色检测INU干预AS的效果Fig.1 Detection of the effects of INU intervention on AS by tissue section staining of aorta root
这些病理检测结果均提示,膳食INU在当前的实验条件下能够显著改善动脉粥样硬化的病理损害。以往研究中,Rault-Nania等[25]亦发现膳食纤维能够显著改善AS疾病的发生。但是,另一个研究团队发现膳食纤维不能够改善AS[26,27]。通过分析上述这两个研究结果矛盾的原因,发现可能是由于采用的动物模型不一致:前者采用的是ApoE-/-小鼠,但是并未给予高脂高胆固醇饮食;而后者尽管给予了高脂高胆固醇饮食诱导AS,但不是采用ApoE-/-小鼠,而是采用其实验室制备一种模型高胆固醇血症的APOE*3-Leiden.CETP小鼠。基于此,试图采用更为广泛的HFD饮食诱导ApoE-/-小鼠制备AS模型,进一步确定INU对于AS的作用,而结果表明INU能够有效改善AS疾病的发生发展,这为膳食纤维防治临床AS提供动物实验依据。此结果与以往的INU能够改善多种慢性代谢性疾病如Ⅱ型糖尿病[20]、非酒精性脂肪肝病[18]、酒精性肝病[17,28]、多囊卵巢综合征[18]等的结果相一致,证实了INU的可靠性。由于INU属于植物来源的低聚果糖,作为一种益生元能够有效改善肠道菌群但不会被机体所吸收,为AS的防治提供了安全、廉价而有效的选择。

2.2 菊粉膳食干预逆转部分AS常规指标
进一步检测了不同组之间的基础指标的变化(图2)。其中,各组体重在动物实验开始时无差异(图2a),而在干预结束时,与对照组BW 26.43 g相比,AS组的BW增加至32.99 g,差异有统计学意义(p<0.05),这可能是由于对照组只给予了正常饮食,而AS组小鼠给予了高脂高胆固醇饮食。但INU干预3个月后BW为32.02 g,与AS相比无显著差异(p>0.05),说明膳食纤维并不是通过改变体重而改善AS疾病。同样,发现CON组、AS组和AS+INU组的平均食物摄入量分别为34.60 g、34.06 g、35.48 g,差异无统计学意义(p>0.05,图2b),提示INU对AS的改善作用与饮食摄入量无关。以往的研究表明,INU能够增加不同阶段糖尿病的体重并分析可能与改善肠道能量吸收有关[20],但是在非酒精性脂肪性肝病的研究中发现体重在INU干预后是显著下降的[18]。本研究中并没有发现显著改变的体重,这可能是由于INU对于不同慢性病体重的影响是不一样的。有研究表明INU不会对饮食摄入量造成显著影响,这与本研究的结果是一致的[18,20]。


图2 INU长期干预对于AS相关指标的影响Fig.2 Impacts of INU long-term intervention on parameters of AS
进一步分析动脉粥样硬化相关的脂质指标发现(图2c~f),与CON对照组血浆TC 6.81 mmol/L、TG 0.21 mmol/L、LDL 1.52 mmol/mL、HDL 6.22 mmol/mL相比,AS疾病组的血浆TC、TG、LDL分别升高至17.01 mmol/L、0.51 mmol/L、2.65 mmol/mL,而HDL下降至3.36 mmol/mL,差异均有统计学意义(p<0.05)。而INU干预3个月后发现能够显著降低AS疾病血浆TC、TG及LDL至14.04 mmol/L、0.35 mmol/L、2.31 mmol/mL,差异均有统计学意义(p<0.05),但HDL 3.48 mmol/mL无影响,提示膳食纤维的长期摄入不仅能够改善AS的病理损害,还能显著逆转AS的脂质异常。以往研究亦表明INU及其多种聚合物都能显著改善AS的脂质代谢[29]。研究证实膳食纤维可以改善其他多种慢性代谢性疾病的脂质代谢紊乱[17-20],其可能机制在于改善肠道菌群及其代谢产物,进而由后者发挥血脂调控作用[30]。
2.3 菊粉膳食干预显著改变肠道菌群组成
INU作为一种重要的益生元,被广泛报具有显著调节肠道菌群失调作用,为此进一步检测了菊粉干预对AS疾病肠道菌群的影响。本研究各组小鼠粪便(5只/组)采用16S rRNA肠道菌群测序,其原始测序数据已上传到NCBI公共序列读取数据库,登记号为PRJNA624814。如图3a和3b所示,能够发现在ɑ多样性上CON组与AS疾病组有差异,表明疾病组小鼠肠道菌群多样性发生了改变。而ɑ多样性上在AS组和AS+INU组之间没有差异,提示INU并没有对AS疾病的菌群种类的丰度产生显著影响。通过主坐标分析(Principal Co-ordinates Analysis,PCoA)(图3c)与非度量多维尺度分析(Non-metric multi- dimensional scaling,NMDS)(图3d)的结果发现,各组样本位点显著分开,提示三组的β多样性具有显著差别,表明AS疾病肠道菌群总体组成上发生了显著改变,而其可以通过INU长期干预而显著调节。韦恩图也提示三组共有240种细菌,而CON对照组具有更多的特有的菌的种类(129种),与此同时AS疾病组仅具有特有的14种,而在膳食纤维干预后其特有的增加到67种(图3g)。
进一步分析各组之间的差异菌,发现在门水平上与CON组菌厚壁菌门(Firmicutes)、拟杆菌门(Bacteroides)和变形杆菌门(Proteobacteria)相对丰度0.26、0.69、2.55×10-3相比(图3e、3h),AS疾病的主要组成菌厚壁菌门和变形杆菌门的相对丰度均显著增加至0.78、0.03,而拟杆菌门却减少至7.93×10-2,差异均有统计学意义(p<0.001,p<0.001,p=0.001);与此相对应的是,厚壁菌门/拟杆菌门(Firmicutes/Bacteroides,F/B)的比值从CON的0.38显著增加至AS的9.84(p<0.001,图3i)。而INU干预后拟杆菌门为8.28×10-2,与AS相比具有升高趋势,而厚壁菌门为0.64,与AS相比呈现下调趋势,这两种菌在两组间均无统计学差异(p>0.05);但有趣的是,INU干预组的F/B比值显著下降至7.73,差异有统计学意义(p<0.05)。

图3 INU对于AS肠道菌群的影响Fig.3 Modulation of INU on gut microbiota in AS
在属水平上,较之CON组的Alistipes、Muribaculum、Candidatus_Saccharimonas、Blautia、Intestinimonas、Parabacteroides、Bilophila、Anaerotruncus、Parasutterella、Oscillibacter、Negativibacillus的相对丰度4.91×10-2、8.84×10-3、6.13×10-3、1.60×10-4、2.07×10-3、1.94×10-3、5.21×10-5、3.53×10-4、7.06×10-4、3.23×10-4、1.12×10-5相比,AS组的Alistipes、Muribaculum、Candidatus_Saccharimonas显著减少至5.80×10-3、3.72×10-6、1.12×10-5,差异有统计学意义(p<0.05);而Blautia、Intestinimonas、Parabacteroides、Bilophila、Anaerotruncus、Parasutterella、Oscillibacter、Negativibacillus显著增加至2.07×10-3、1.70×10-2、1.94×10-3、9.65×10-3、5.22×10-3、2.25×10-3、3.85×10-3、1.96×10-3(p<0.05),表明AS疾病模型肠道菌群在属水平上发生了显著改变。INU长期干预近3个月后,可以发现AS属水平上菌群组成发生部分逆转,主要体现在Faecalibaculum的相对丰度增加至0.28,而AS异常增加的Alistipes、Intestinimonas、Bilophila、Oscillibacter、Negativibacillus均减少至1.09×10-3、3.46×10-4、1.86×10-4、1.56×10-4、3.72×10-6,差异有统计学意义(p<0.05)。


上述肠道菌群在门与属水平上显著差异菌表明AS疾病会引起肠道菌群的显著改变,如门水平上的主要组成菌厚壁菌门、拟杆菌、变形杆菌均发生了显著的变化,而在属水平上也有多种菌显著发生了变化;而通过3个月长期给予膳食纤维干预能够显著调节肠道菌群的组成,纠正AS中异常改变的菌的丰度。其中,在门水平上,显著改善F/B比值,说明可能是通过在降低厚壁菌门或升高拟杆菌门发挥作用。有文献报道采用拟杆菌Bacteroides vulgatus和Bacteroides dorei直接干预可以显著抑制AS疾病进展[31]。该研究结果与本研究中改善拟杆菌及F/B比值的结果是一致的。而在属水平上,特别是Faecalibaculum并没有在AS中发生显著变化,但是在膳食纤维干预后却成为属水平上显著改变的关键菌。最近有研究揭示该菌是重要的产SCFAs菌[32],而后者作为肠道菌群重要代谢产物参与了多种生理功能,为此后续又进一步检测了SCFAs的含量(结果2.6)。
2.4 菊粉膳食干预减轻内毒素血症
当肠道菌群失调时,肠道革兰阴性菌来源的LPS引起的内毒素血症被认为是引发多种慢性代谢性疾病炎症重要触发因素[11],为此检测了外周血LPS水平。结果表明,AS疾病组的血浆LPS水平0.44 EU/mL较之CON组0.20 EU/mL显著升高(p<0.001,图4),提示AS疾病中存在内毒素血症,这与以往的AS临床与动物研究结果是一致的[33,34]。
而在膳食纤维长期干预后,发现AS疾病血浆中LPS水平显著降低至0.34 EU/mL(p<0.01,图4),表明INU能够显著缓解AS疾病中的内毒素血症。以往INU研究表明能显著下调多种慢性病中血浆LPS水平[17-20,35],与本研究结果是一致的,说明INU可能是通过抑制LPS在肠道中的产生,减少其经门静脉入肝及血液循环,进而抑制AS慢性低度炎症的发生。

图4 INU干预对AS血浆LPS的影响Fig.4 The impact of INU intervention on LPS in AS
2.5 菊粉膳食干预降低血浆与血管组织炎症因子浓度

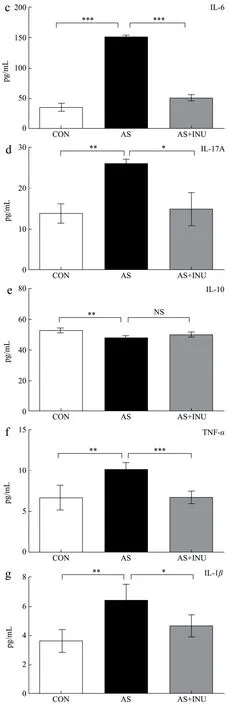

图5 膳食INU干预对于AS炎症因子的影响Fig.5 The impacts of dietary INU on the inflammatory cytokines in AS
通过分析上述发现的血浆异常升高的LPS提示AS可能存在炎症,以往研究中也表明炎症与AS密切相关[10-15],故本研究又进一步分析了膳食纤维干预对于AS炎症的影响。结果提示,与CON对照组主动脉组织和血浆中炎症因子TNF-α、IL-1β、IL-6、IL-17A、IL-10的浓度19.89 pg/mL和6.64 pg/mL、13.38 pg/mL和3.60 pg/mL、34.86 pg/mL和6.08 pg/mL、13.79 pg/mL和2.98 pg/mL、52.19 pg/mL和2.99 pg/mL相比,AS疾病组主动脉组织和血浆中的促炎因子TNF-α、IL-1β、IL-6、IL-17A升高至39.89 pg/mL和10.02 pg/mL、21.83 pg/mL和6.42 pg/mL、150.20 pg/mL和12.80 pg/mL、25.70 pg/mL和9.84 pg/mL,主动脉根部组织IL-10降低至47.24 pg/mL,差异有统计学意义(p<0.05);而AS血浆中抑炎因子IL-10为3.16±0.13 pg/mL,无显著改变(p>0.05)。这些结果提示AS疾病发生发展中存在慢性低度炎症,这与以往研究中AS中显著升高的促炎因子结果是一致的[36]。
经膳食纤维长期干预12周后,可以发现AS疾病中的主动脉组织和血浆中的促炎因子TNF-α、IL-1β、IL-6、IL-17A降低至27.32 pg/mL和6.59 pg/mL、19.15 pg/mL和4.60 pg/mL、49.81 pg/mL和8.57 pg/mL、16.70 pg/mL和3.57 pg/mL,差异有统计学意义(p<0.05);而抑炎因子IL-10的浓度49.35 pg/mL和2.80 pg/mL,无显著改变(p>0.05)。这些结果表明膳食INU显著抑制了AS慢性低度炎症,而原因可能是膳食纤维通过改善肠道菌群失调,减少LPS的异位入血,进而减少了其引发的炎症损害。这里显著升高的IL-17A提示分泌IL-17A的Th17细胞可能参与了INU的有效性。此外,可能还有其他多种免疫细胞如调节性T细胞(Regulatory T cells,Tregs)、巨噬细胞、单核细胞、中性粒细胞等参与该INU对于炎症的调控过程。如有研究表明巨噬细胞及其极化参与了INU对于慢性病炎症抑制作用[28]。前期发现INU能够显著影响其他慢性病中的髓源抑制性细胞(Myeloid suppressor cells,MDSCs)[37]和肠道粘膜免疫γδT细胞[38]。但是这些免疫炎症细胞是否参与了INU对AS的作用及其相关分子机制需后续进一步实验证实。
此外,在膳食纤维改善肠道菌群失调过程中,能够改变多种细菌组成及其代谢产物如SCFAs、色氨酸代谢、胆汁酸代谢、氧化三甲胺(Trimethylamine oxide,TMAO)等,而这些肠道菌群来源的代谢产物已被证实参与多种疾病的发生与发展,亦有可能参与调控INU抑制炎症的机制,如SCFAs已经被证实能够通过结合G-蛋白偶联受体(G-protein coupled receptor,GPR)而显著抑制炎症的发生[39]。
2.6 菊粉能够显著改变AS疾病中肠道菌群来源的SCFAs含量

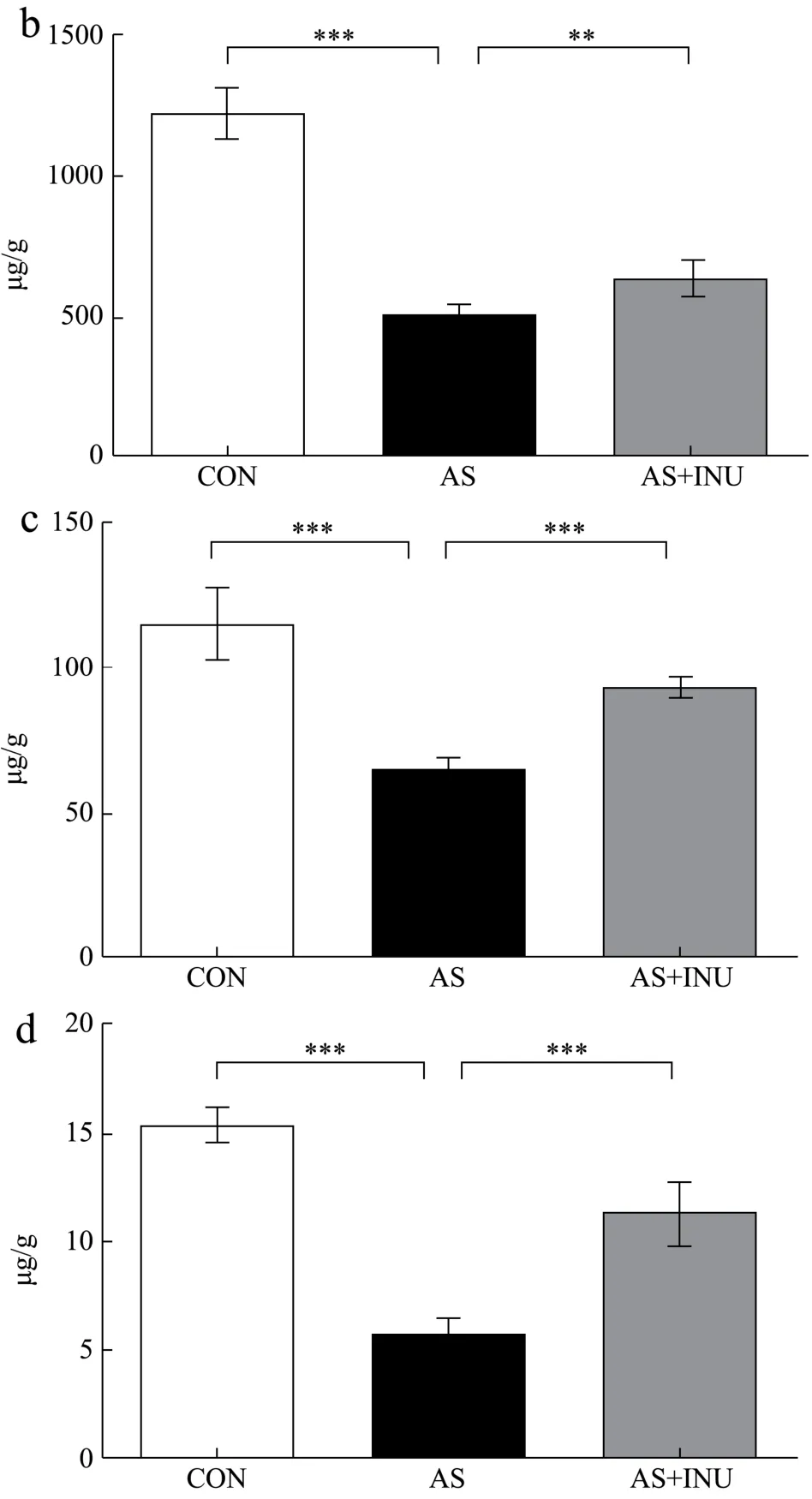
图6 INU对于AS肠道菌群来源SCFAs的作用Fig.6 The effect of INU on gut microbilota-derived SCFAs in AS
上述研究发现INU能够调节肠道菌群并抑制LPS及炎症的发生,然而由于肠道菌群代谢产物SCFAs被报道也能显著抑制炎症的发生[40],故本研究又进一步检测膳食纤维干预后SCFAs的改变。结果发现,与对照组乙酸、丙酸和戊酸的值1218.00 μg/g、115.30 μg/g、15.25 μg/g相比,AS疾病组乙酸、丙酸和戊酸降低至505.00 μg/g、64.52 μg/g、5.74 μg/g,差异有统计学意义(p<0.05);在INU长期干预后能够显著改善至631.90 μg/g、92.70 μg/g、11.25 μg/g(p<0.05),而其他短链脂肪酸无显著改变,提示AS疾病存在的肠道菌群失调导致异常减少的代谢产物SCFAs能够通过膳食纤维的干预而部分逆转。已有研究表明,SCFAs的减少会对机体造成如下的影响[41-43]:首先,SCFAs是能量代谢的基本原料,而其减少将可能引起肠道内皮细胞的能量代谢紊乱,后者将会破坏肠道屏障功能;其次,SCFAs能够通过结合细胞受体GPR抑制核因子(Nuclear factor,NF)-κB炎症信号通路,进而显著抑制炎症因子的产生,而SCFAs的减少将会导致炎症的加重;再者,SCFAs作为去乙酰化酶(Histone deacetylase,HDAC)的抑制剂,能够通过影响基因的乙酰化水平进而调控基因的表达,影响疾病的发生发展,而SCFAs的减少可能是参与疾病发生相关基因表达的重要原因。而本研究中INU干预AS过程中显著改变的SCFAs是通过怎样的途径发挥作用仍需后续进一步研究揭示。
3 结论
以动脉粥样硬化症为基础的心脑血管疾病是当前重大疾病,发病人群广泛,由其导致的死亡率位居首位,故寻找安全、有效、低廉的防治方法与策略意义重大。本研究证实菊粉能够有效改善AS疾病的发生发展,并初步提示其作用与调节肠道菌群、抑制炎症发生密切相关。本研究为膳食纤维干预临床AS疾病提供了实验数据与防治思路。

