内体分拣转运复合物与自噬关系的研究进展
李 艺,孙大伟,崔德荣
上海交通大学附属第六人民医院麻醉科,上海 200233
自噬(autophagy)由Ashford 和Porter 在1962 年发现细胞内有“自吃”的现象后提出[1],是指双层膜结构包裹部分胞质和细胞内需降解的细胞器、蛋白质等成分形成自噬小体,并与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,以实现细胞本身的代谢需要和某些细胞器的更新。自噬是细胞应激条件下支持生存的生理机制之一[2]。自噬具有多种生理功能,包括耐受饥饿,清除细胞内折叠异常的蛋白质或蛋白质聚合物、受损或多余的细胞器,促进发育和分化,延长寿命,清除微生物等[3]。自噬功能障碍与众多疾病相关,包括神经系统的帕金森病、阿尔茨海默病,肌肉系统的Danon 病、溶酶体沉积症,肺组织的囊性纤维瘤,胰腺的急性胰腺炎和糖尿病,消化组织的克罗恩病以及免疫组织的免疫相关反应等[4]。
内体分拣转运复合物(endosomal sorting complexes required for transport,ESCRT)最初被发现能够协助内体膜内陷形成多泡体(multivesicular body,MVB),促进被泛素标记的膜蛋白的降解[5-6]。有关线虫、蝇类和哺乳动物的研究[7]表明,抑制ESCRT 的表达不仅阻碍内体的形成,也导致未成熟自噬小体结构的积累。ESCRT通过抑制自噬降解,参与多种神经退行性疾病的形成[8-10],说明ESCRT 对自噬的调控具有重要作用。本文就ESCRT 对巨自噬、微自噬的调控以及ESCRT 与自噬相关蛋白的关系进行综述。
1 自噬及自噬流
1.1 自噬的分类
根据细胞物质被运到溶酶体内的途径不同,将自噬过程分为3种:①巨自噬,内质网来源的膜包绕待降解物形成自噬小体,然后与溶酶体融合并降解其内容物。②微自噬,溶酶体的膜直接包裹长寿蛋白等,并在溶酶体内降解。③分子伴侣介导的自噬(chaperone mediated autophagy,CMA),胞质内蛋白结合到分子伴侣后被转运到溶酶体腔中,然后被溶酶体酶消化[11]。
巨自噬是游离膜包裹细胞质的一部分(包括细胞器等)形成一个自噬小体,外膜与溶酶体相融合并将内部物质进行降解。巨自噬可以是非选择性的,通常在饥饿的条件下观察到,细胞质蛋白被催化分解为游离的氨基酸;也可以是选择性的,由胞质连接蛋白介导,将待降解物与自噬系统连接起来。这种机制对细胞分解代谢以及降解可能有害的细胞内物质(包括病原体,积聚的蛋白质或者受损的细胞器)来说都是非常重要的。微自噬是溶酶体直接吞噬并消化胞质中待降解物质,其既可以不加区别地包裹细胞内可溶性成分,也可以高度选择性地降解特定的细胞器,例如线粒体、过氧化物酶体以及部分细胞核。CMA 是具有高度选择性的,并且只能降解一些特定蛋白而不能降解细胞器,这些被降解的蛋白都含有特定的氨基酸序列且能被分子伴侣热休克同源蛋白70(heat shock cognate protein 70,HSC70)或其复合物识别并结合,随后底物蛋白和分子伴侣复合物被直接运送到溶酶体内。
1.2 自噬流
当细胞受到应激后,细胞内相应胞质成分被双层膜包裹与胞质分隔,形成自噬小体,随后这些自噬小体和晚期内体或溶酶体融合形成自噬溶酶体,在自噬溶酶体中将包裹的胞质成分降解或循环再利用于细胞稳态维持。因此,自噬可以分为几个步骤:双层隔离膜的形成(成核),隔离膜的延伸(延伸),自噬小体的形成和运输(成熟),自噬小体与溶酶体之间的对接和融合(融合)以及降解溶酶体内胞质(降解)[12],这一完整的过程称之为自噬流(图1);其中,任何一个步骤阻断都会造成自噬流受损。

图1 自噬流过程及其内体途径Fig 1 Schematic illustration of autophagic flux and its endosome pathway
2 ESCRT与自噬的关系
2.1 ESCRT概述
ESCRT 主要负责膜的剪切[13-14],在许多细胞生理过程中都发挥着重要的作用,包括胞质分裂、神经元修建、质膜修复、质膜出芽小泡的形成、核被膜维护、内体分拣和细胞自噬、病毒复制和出芽等[15]。
ESCRT 由4 个亚复合物(ESCRT-0、ESCRT-Ⅰ、ESCRT-Ⅱ,以及ESCRT-Ⅲ)以及一些辅助蛋白[液泡分选蛋白4 (vacuolar protein sorting 4,VPS4)、VTA1(vesicle trafficking 1)等]组成(表1)。其在内体膜上的招募顺序已经确定,首先是位于最上游的ESCRT-0 招募ESCRT-Ⅰ,随后ESCRT-Ⅰ和-Ⅱ在内体上结合,ESCRT-Ⅱ通过激活ESCRT-Ⅲ亚单位VPS20 实现ESCRT-Ⅲ聚合。最后VPS4拆解ESCRT-Ⅲ复合物以实现其亚单位的回收利用。ESCRT-Ⅲ是最终促进膜结构变化的亚复合物,而上游组件ESCRT-0、ESCRT-Ⅰ和ESCRT-Ⅱ负责招募ESCRT-Ⅲ到细胞内的特定位点[16]。各亚复合物对自噬的影响也不尽相同,干扰ESCRT-0 的表达对自噬结构形成影响最小,而抑制ESCRT-Ⅰ、ESCRT-Ⅱ和ESCRT-Ⅲ的表达会导致自噬结构形成障碍,尤其是在干扰ESCRT-Ⅲ和VPS4的表达后,表明它们是自噬结构形成中最重要的ESCRT成分[17]。
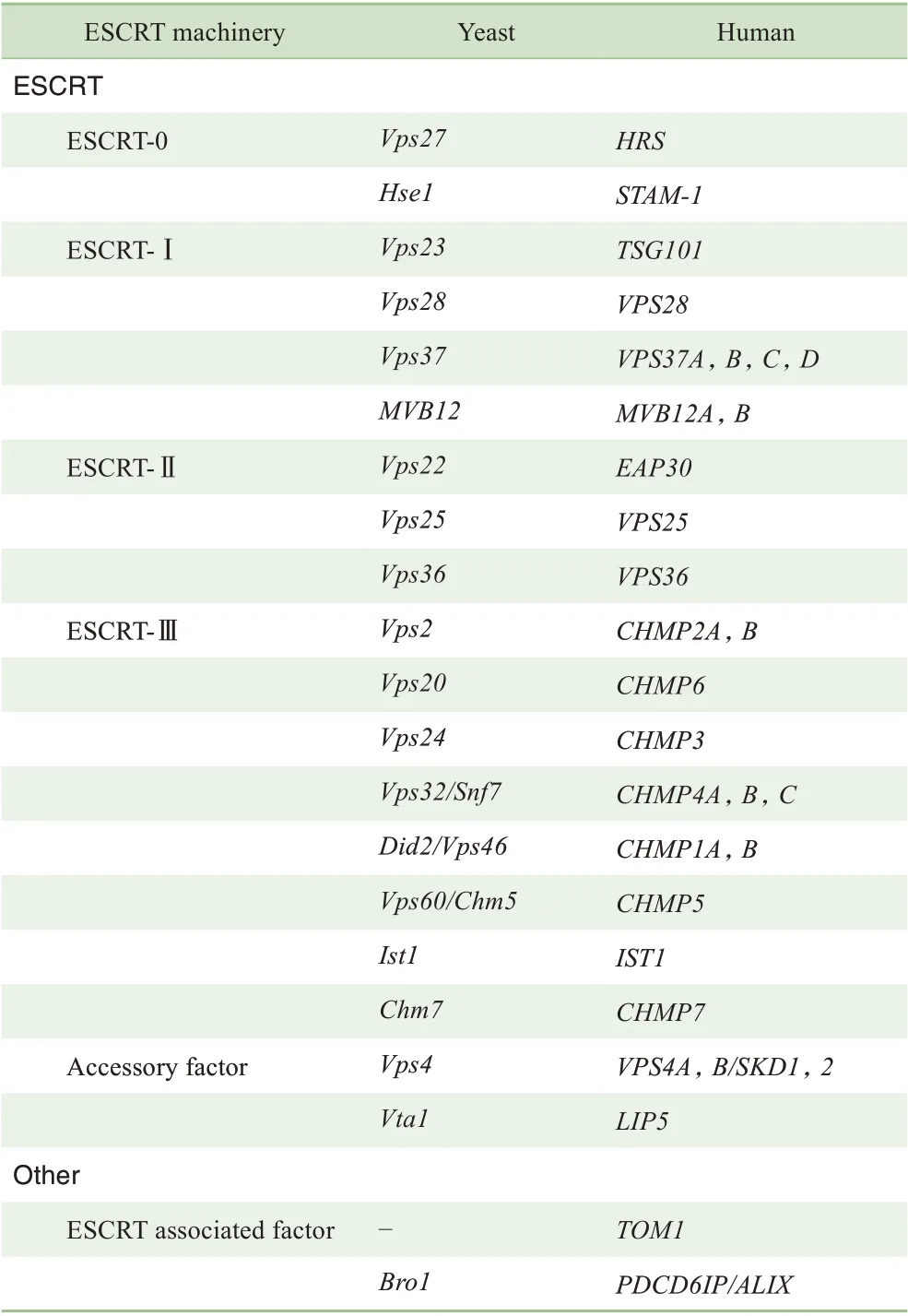
表1 酵母和人类的ESCRT复合物及其相关分子同源基因命名对照Tab 1 Nomenclature of ESCRT and ESCRT-associated orthologs between yeast and human
2.2 ESCRT与巨自噬
巨自噬过程可以分为5个阶段,包括自噬诱导、自噬小体成核、自噬小体膜延伸、自噬小体双层膜闭合、自噬小体与溶酶体融合形成自噬溶酶体[18]。ESCRT 相关基因突变体中普遍存在自噬小体的积累[7],可由以下2种原因导致:一是自噬激活,自噬流增强,自噬小体形成增多;二是自噬流受阻,自噬小体尚未来得及降解而造成堆积。
在形成成熟自噬小体之前,双层膜需要闭合,这个过程与ESCRT 调控的膜剪切在空间结构上基本相同。为了区分闭合和未闭合的自噬小体双层膜,Takahashi 等[17]发明了HaloTag-LC3自噬小体闭合实验,在共聚焦显微镜下通过不同颜色的荧光表达来区分双层膜闭合前后的自噬小体。在抑制ESCRT-Ⅲ亚单位CHMP2A的表达后,镜下观察到未闭合的自噬小体数目明显增加,而成熟的自噬小体数目减少,说明CHMP2A 的表达缺失阻碍了自噬小体双层膜的关闭,ESCRT在双层膜闭合阶段有直接的参与作用。Zhen 等[19]随后发现另一ESCRT-Ⅲ亚单位——CHMP4B,在双层膜闭合前被招募到未成熟的自噬小体周围;活细胞荧光显微镜下观察到CHMP4B 短暂地停留了1~2 min,而在干扰上游分子CHMP2A 的表达后,CHMP4B 的停留时间显著延长。上述研究提示,自噬小体双层膜的闭合可能需要多个ESCRT 亚单位协同作用参与调节,但是由于目前的siRNA 筛选只能针对单个ESCRT 基因,因此下一步研究可着眼于ESCRT 联合突变对自噬小体双层膜闭合的影响,更充分全面地验证ESCRT各亚单位在其中扮演的角色。
高级真核细胞中,自噬小体在与溶酶体融合之前可以和早期或晚期内体结合形成自噬内体。有研究[20]证实,ESCRT 的突变导致自噬小体积累的另一个可能原因是自噬内体形成障碍。ESCRT 相关AAA-ATP 酶SKD1(即VPS4 的小鼠同源蛋白)能够将ESCRT 从内体膜上解离下来,并参与自噬内体的成熟过程。HeLa 细胞中过表达SKD1可以抑制内体向自噬小体的运输,这一过程发生在溶酶体融合之前,同时晚期内体的标记蛋白溶血磷脂酸(lysobisphosphatidic acid,LBPA)不再出现在自噬小体结构中,说明自噬内体的形成受阻,继而提示SKD1能够调控自噬小体和内体的融合,ESCRT 在这一阶段有参与作用。在果蝇的卵巢卵泡细胞和脂肪体中抑制VPS4 的表达后也得到了相同的结果[21],即VPS4 的缺失能够影响自噬通路。可见在自噬进程中,ESCRT 的ATP酶VPS4也发挥重要作用。之后的实验研究中,研究人员降低了VPS28 (ESCRT-Ⅰ)、VPS25 (ESCRT-Ⅱ) 或VPS32(ESCRT-Ⅲ)的表达,同样观察到了自噬小体数目的增加。上述研究提示,ESCRT 各亚单位(ESCRT-Ⅰ、ESCRT-Ⅱ和ESCRT-Ⅲ)及其ATP 酶VPS4 在自噬内体成熟的过程中都是不可缺少的。
成熟自噬小体形成后,与溶酶体融合形成自噬溶酶体,完成降解。有研究[21]发现,ESCRT复合物可以促进自噬小体与溶酶体的融合。溶酶体相关膜蛋白1(lysosomal associated membrane protein 1,LAMP1)是溶酶体的标记物,在野生型幼虫的自噬溶酶体能够观察到LAMP1 与绿色荧光蛋白(green fluorescent protein,GFP)-自噬相关基因8(autophagy related gene 8,ATG8)(自噬标记分子)的共定位,而在沉默VPS25 的表达后,GFP-ATG8 聚集的结构和LAMP1 标记的结构并不相同,提示在没有功能性ESCRT 的情况下,自噬小体和溶酶体之间缺乏融合,无法完成下一步的降解,导致自噬小体堆积。利用mCherry-GFP-LC3B自噬双标系统也可以观察自噬小体和溶酶体的融合。在肿瘤易感基因101(tumor susceptibility 101,TSG101)或VPS24 敲低表达的细胞中,指示自噬溶酶体的红色荧光减少,而指示自噬小体的黄色荧光增多,这表明自噬小体与溶酶体融合减少,ESCRT功能障碍会抑制自噬溶酶体的形成。
现有报道集中于探究ESCRT突变体中自噬流的改变。近来1 篇有关阿尔茨海默病的报道[22]验证了疾病发生发展过程中, TAU 蛋白/MAPT (microtubule associated protein tau)的积累引起ESCRT-Ⅲ亚单位IST1 表达下降。进而导致自噬小体与溶酶体融合障碍以及自噬小体增多。因为自噬流障碍本身就会引起TAU 蛋白积累,研究人员在人Mapt转基因小鼠上调了IST1表达,发现不仅减轻了自噬缺陷,TAU 蛋白的积累也减少了,认知功能得到改善。说明通过在自噬相关疾病中探究并调控ESCRT 相关分子的表达,可以延缓疾病进展。目前,类似上述研究的报道较少,有望成为新的重点研究方向。
以上报道表明,ESCRT 参与了巨自噬中自噬小体双层膜闭合、自噬小体和内体融合以及自噬溶酶体的形成等过程,对自噬流的通畅发挥了重要的功能。溶酶体形成也是自噬流过程中必不可少的一步,而MVB 是溶酶体形成过程中出现的小体,提示ESCRT 功能障碍也可能影响溶酶体发生,但现有的研究无法提供直接证据,有待进一步验证。
2.3 ESCRT与微自噬
目前,微自噬的膜动力学分子机制尚未被阐明,但已有研究表明这个过程中有ESCRT 相关分子的参与。动物细胞的溶酶体在植物细胞和酵母中被称为液泡。液泡是细胞质中泡状的结构,内含液体,周围有薄膜使液泡与细胞质分开。有研究[23]证明,酵母细胞的膜蛋白VPH1在液泡腔中可通过微自噬进行降解;ESCRT的通道蛋白VPS27 在微自噬激活后,转位于液泡膜上,在VPS27表达减少的细胞中VPH1的降解减少,而在重新表达VPS27的重要分子结构域后VPH1的降解恢复;继而表明VPH1 进入液泡进行降解需要VPS27 的参与,ESCRT在微自噬过程中能够协助待降解物进入液泡,与其中的膜重塑过程密切相关,起到关键性作用。
有关内质网微自噬的最新研究[24-25]报道,ESCRT-0、ESCRT-Ⅰ、ESCRT-Ⅱ、ESCRT-Ⅲ蛋白和VPS4蛋白的敲低会抑制内质网微自噬,其中验证的ESCRT 分子包括VPS2 (ESCRT- Ⅲ)、 VPS23 (ESCRT-Ⅰ)、 VPS24(ESCRT-Ⅲ)、SNF7(ESCRT-Ⅲ)等;并且发现SNF7 能够短暂地与含有内质网组件的内陷囊泡颈部相结合,提示ESCRT 可能通过调控溶酶体膜最后的剪切参与到内质网微自噬过程中。
还有研究人员在鼠树突状细胞的内体中发现了一种类似于微自噬的降解机制[26]。与发生在溶酶体的CMA 不同,这种被称为内体微自噬(endosomal microautophagy,eMI)的机制出现在MVB 形成过程中,依赖于ESCRT-Ⅰ和Ⅲ来形成囊泡,由分子伴侣HSC70介导蛋白降解物的分选,并通过静电作用与内体膜相互识别,在晚期内体中降解或者与溶酶体融合。在降低TSG101(ESCRT-Ⅰ)和VPS4 的表达后,晚期内体对胞质蛋白的摄取和降解均减少,溶酶体内却没有出现这种现象,这说明阻碍MVB 的生成确实会影响待降解物运输到内体。在黑腹果蝇中也存在这种机制,研究[27]显示其可以通过延长饥饿时间来诱导eMI。之后科研人员在小鼠胚胎成纤维细胞中又发现了新的eMI[28]——一种特殊的线粒体清除途径,待降解的线粒体在ESCRT 的参与下进入早期内体。内体成熟后,将线粒体运送到溶酶体进行降解,在这个过程中ESCRT-Ⅰ、ESCRT-Ⅱ和ESCRT-Ⅲ都有参与。
这些研究成果均表明ESCRT 在微自噬中也参与了膜重塑、膜剪切等过程,并在其中发挥重要的作用,影响自噬进程。
2.4 ESCRT与ATG蛋白的相互作用
自噬形成所需的20 多种基因被称为ATG。ESCRT 也可以通过与ATG蛋白相互作用间接对自噬进行调节。在自噬过程中,自噬调节因子可以与ESCRT 亚基相互联系,促进内体成熟,进而推动自噬小体与MVB融合[29]。在一项有关基础自噬的研究中[30],研究人员通过免疫共沉淀实验和质谱分析发现ESCRT 相关蛋白PDCD6IP/ALIX 与促进自噬溶酶体形成的自噬复合物ATG12-ATG3有强大的相互作用,ALIX 在与ATG12-ATG3 结合后,会发生结构上的改变,有利于它对内体的成熟进行调控;说明ESCRT除了直接参与自噬过程中膜融合、膜剪切的阶段外,也可以和自噬相关蛋白发生相互作用,进而调节自噬过程。
最近在植物中发现了一种ESCRT 亚单位——FREE1(FYVE domain protein required for endosomal sorting 1)[31],FREE1 表达缺失会导致异常MVBs 的产生,引起膜蛋白回收利用障碍。同时FREE1突变体内自噬小体数目增加,自噬小体或自噬内体与液泡的融合均发生障碍,说明FREE1影响了自噬进程。进一步研究[32]发现,FREE1通过N-末端结构域与植物ESCRT-Ⅰ亚单位VPS23结合,调节MVBs的形成,并通过C-末端结构域与调节植物自噬的特殊因子SH3P2(SH3 domain-containing protein 2)连接调控自噬。此外,免疫共沉淀结果也显示它能和自噬相关蛋白ATG6以及SH3P2相互作用[33]。研究人员推测FREE1可能是通过SH3P2招募到自噬小体,促进自噬小体成熟或者募集参与内体和自噬小体融合的调节因子,表明ESCRT亚单位可通过调控自噬相关蛋白进而影响自噬流。
3 总结与展望
自噬功能障碍与许多人类疾病(如癌症、神经退行性变、免疫性疾病等)相关,因此增加对自噬调节机制的理解至关重要。ESCRT 通过对自噬的调节,参与疾病的发展,这无疑为自噬机制以及相关疾病的研究开辟了一个新的领域。同时在微观上,通过研究ESCRT 在自噬小体双层膜闭合、自噬小体与内体或溶酶体融合等过程中发挥作用的具体机制,进一步理解了巨自噬和微自噬的相关膜动力分子学机制。虽然已有研究证实了ESCRT在不同类型自噬进程中的膜闭合、膜剪切以及膜融合等阶段发挥了重要功能,多个ESCRT 亚单位可协同作用参与其中,但目前没有研究涉及ESCRT 亚单位联合突变对自噬产生的影响,ESCRT 对自噬前信号通路以及溶酶体形成的调节机制也尚未阐明,并且有关自噬相关疾病中ESCRT 亚单位表达改变的研究也较少。通过深入探究两者间的相互联系,ESCRT 有望成为调控自噬流的新靶点。

