肝豆状核变性影像学研究进展
周香雪, 黄海威
(中山大学附属第一医院神经科,广东 广州510080)
肝豆状核变性又称威尔逊病(Wilson disease,WD),是一种常染色体隐性遗传的铜代谢障碍疾病。由于ATP7B基因突变,出现铜蓝蛋白合成不足及胆道排铜障碍,导致铜在多个脏器异常沉积而发病。WD好发于青少年,以肝硬化、锥体外系症状为主,发病率为(15~30)/100万[1-2]。其神经系统症状主要是锥体外系症状,如肌张力障碍、震颤、构音障碍、吞咽困难、流涎、步态异常等。根据临床症状的不同,WD患者可被分为肝型(肝硬化症状为主,无明显神经精神症状),脑型(神经精神症状为主,肝脏症状轻微),混合型(同时有明显神经精神症状以及肝脏症状)。根据神经症状又可将脑型WD分为运动障碍型(1型)、帕金森综合征型(2型)、口-下颌肌张力障碍型(3型)和精神症状型(4型)。神经症状多持续终身,若不治疗,将造成患者严重残疾,极大影响生活质量,给患者家庭和社会带来极大经济负担。WD也是至今少数可治的神经系统单基因遗传病之一,需早诊断,早治疗,并终身治疗。
实验室检查对WD诊断非常重要,包括铜蓝蛋白降低、血清铜降低、尿铜增高等。影像学检查对WD诊断、病情评估、疗效评估等都有作用。本文就常见神经系统影像学检查对于WD的临床意义进行讨论。
头颅CT
WD患者头颅CT异常率高达85%,主要表现为双侧对称的基底节区及丘脑密度减低,多伴有不同程度的脑皮质及白质萎缩。
头颅磁共振成像
一、磁共振成像(magnetic resonance imaging,MRI)平扫
WD脑部病变在MRI上的信号可分为3种。第一种是T1低信号,T2高信号。该型最常见,可发生在基底节、丘脑,是由于铜的沉积导致神经元非炎性变性和坏死伴水肿、胶质细胞增生所致。第二种是T1高信号,T2高信号。主要发生在苍白球,WD合并肝衰竭患者可出现这种信号,可能门体静脉分流后结合有顺磁效应的毒物聚积在病变部位。第三种是T1低信号,T2低信号[3]。主要发生在基底节,是由于铜在脑组织中的聚积而致。铜沉积和脑组织病理变化同时存在,可在T2上造成高、低混杂信号。
梁秀龄教授[1-2]发现,WD病变范围广泛,脑部病灶双侧基本对称,常累及的依次是壳核、苍白球、尾状核、丘脑、中脑、桥脑、小脑,其中中脑、脑桥异常病灶多位于中脑和脑桥背盖部。其他较少见的病灶可见于皮层、皮层下白质,未见延髓有异常病灶。脑萎缩常见,见于皮质和白质。脑型WD患者脑萎缩发生率高于肝型。
二、MRI定量分析方法
MR的T2成像上可根据高、低信号来分析WD患者金属沉积或者神经损伤的不同病理生理过程,因此,我们根据Sinha等[3]对MRI异常信号的量化评定标准,在T2加权成像上,将WD异常信号分为高信号和低信号2种。分别对苍白球、壳核、尾状核、丘脑、中脑、桥脑、延髓、小脑、皮层、皮层下白质的高信号及低信号范围及程度进行评分(见表1)[4]。这种方法可以更好地区别和量化WD患者脑部核团铜沉积以及神经损伤的程度。

表1 WD患者脑部MRI评分[4]
WD影像学变化与神经系统临床表现严重程度相关性意见不一。部分学者认为WD脑部病变分布与临床表现无相关性[5],也有学者认为症状与影像学之间存在相关性[6]。本团队研究[4]发现,某些神经症状评分与脑部核团高信号评分有一定相关性,如壳核损伤与语言障碍有关,而震颤与丘脑损伤关系密切,但未发现神经症状与低信号评分的相关性。这提示WD神经症状与特定部位的神经损伤有关,而不是由铜沉积直接引起。
弥散加权成像
WD脑部病变区域在弥散加权成像(diffusion weighted imaging,DWI)上可出现略高(细胞毒性水肿)、略低(血管源性水肿)及等信号3种信号,提示可能存在3种不同的病理生理情况,并与WD的不同病程有关。DWI可以评估WD脑部急性病变。金属络合剂治疗过程中,神经症状加重患者在DWI上显示扩散限制,这些DWI的异常在1个月时改善,2年时消失[7]。
磁共振波谱
磁共振波谱(magnetic resonance spectroscopy,MRS)可在一定程度上反映WD患者颅内病变区神经元细胞的减少或丢失[N-乙酰天冬氨酸(N-acetylaspartate,NAA)降低]、广泛的星形胶质细胞增生[胆碱(choline,Cho)升高]等代谢异常变化信息。既往研究[8]发现,脑型WD患者的苍白球,Cho/肌酸(creatine,Cr)、谷氨酸 (glutamate,Glx)/Cr和脂质(lipid,Lip)/Cr比值升高,NAA/Cr比值下降。肝型WD的Cho/Cr和NAA/Cr比值降低。即使MRI正常,MRS也可检测到WD的早期神经变化[8]。我们课题组观察了27例WD患者1H-MRS特点,发现脑型WD患者脑1H-MRS的特点是NAA/Cr下降,提示WD患者脑部损害有神经元受损;肝型WD患者在神经症状出现前,即可出现脑部MRS异常。本团队也进行了WD患者2H-MRS的研究,发现脑型、肝型WD患者均存在神经元细胞的减少或丢失(NAA/Cr降低)和广泛的星形胶质细胞增生(Cho/Cr升高),且脑型WD患者的脑组织损伤更重,神经元损伤和胶质增生与WD神经症状有关。不同脑型的WD患者脑部神经元细胞的减少及星形胶质细胞增生存在差异,病程越长,NAA/Cr比值降低越明显。
单光子发射计算机体层摄影和正电子发射体层摄影
本团队[9]观察了28例肝豆状核变性患者脑99mTc-TRODAT-1单光子发射计算机体层摄影(single photon emission computed tomography,SPECT)多巴胺(dopamine,DA)转运蛋白(dopamine transporter,DAT)功能显像特点,发现脑型WD患者脑内DA神经递质在突触前膜水平降低,并与临床表现高度负相关,即临床症状越重,DA神经递质的降低越明显。张祥松等[10]对13例WD患者进行了脑局部葡萄糖代谢变化的18F-氟代脱氧葡萄糖(2-fluoro-2-deoxy-D-glucose,FDG) 正 电 子 发 射 体 层 摄 影(positron emission tomography,PET)的研究,发现WD患者双侧豆状核和尾状核放射性摄取对称性减低,豆状核比尾状核更明显。本课题组对WD患者脑18F-FDG PET的研究还发现,WD患者出现神经症状前已有脑代谢水平降低;经过驱铜治疗可以改善WD患者脑的葡萄糖代谢水平和代谢分布的均衡性。
磁敏感加权成像
磁敏感加权成像(susceptibility weighted imaging,SWI)是利用组织间磁敏感性差异产生图像对比的一种T2技术,能反映金属含量[11]。SWI通过相位(corrected phase,CP)值分析,可作为测定金属浓度的非侵入性方法[12]。本团队[13]已经证明,Tx小鼠SWI的CP值同时受铁和铜含量的影响,CP值与铁和铜的含量呈负相关。
WD是铜代谢障碍疾病,其铁代谢同样存在异常。本团队[13]在WD动物模型Tx小鼠脑中,发现铁含量增高。另外还发现,WD患者黑质、尾状核、苍白球SWI的CP值降低,其中黑质的CP值最低,提示这些部位金属沉积明显[13]。在SWI与临床症状的相关分析中,SWI的CP值与WD神经症状的关系并不明显。WD患者的神经症状与金属沉积并不一致,金属沉积引起的继发病理学损伤可能才是出现神经症状的基础。
SWI能动态观察WD患者脑部金属沉积量,评估驱铜治疗效果。本团队[14]观察了金属络合剂治疗后WD患者大脑SWI的变化。在络合剂治疗过程中,WD患者脑内CP值有升高的趋势,提示抗铜治疗可减少脑内金属沉积。并且,不同的治疗方案对WD患者脑CP值的改变不同(见图1)。

图1 WD患者治疗过程中SWI图[14]
神经网络的影像学评估
脑部神经连接包括解剖连接、功能连接及有效连接,形成复杂的脑网络。锥体外系神经网络是脑网络的重要部分,在运动调节方面有重要作用。目前对于神经网络的结构连接和功能连接的研究方法,主要有弥散张量成像(diffusion tensor imaging,DTI)和静息态功能磁共振(resting state functional MRI,rs-fMRI)。
一、DTI
DTI是在活体脑组织显示白质纤维束走行的手段,可以间接评价大脑白质纤维的完整性[15-16]。DTI常用的量化指标包括表观弥散系数(apparent diffusion coeffecient,ADC)、各向异性分数(fractional anisotropy,FA)、特征值λ等。本团队[17-18]既往通过DTI指标与病理学指标的相关分析,证实DTI FA值反映轴索、髓鞘损伤情况,λ1值可反映轴索的完整情况,λ2和λ3值主要反映髓鞘的完整情况。同时,DTI是观察纤维束走行的有效方法,可用于研究纤维的结构性连接(见图2、3)。

图2 锥体外系直接通路重建图[18]
本团队[18]发现,WD患者锥体外系FA值降低,联系纤维数量降低,提示WD患者锥体外系网络存在结构性损伤。在WD患者中,苍白球和壳核之间的纤维束损伤可能最明显。
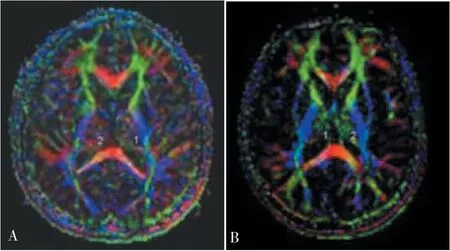
图3 WD患者及正常对照FA图[18]
同时,本团队[18-19]证实,锥体外系网络损伤对WD神经症状类型、严重程度、症状对称性有重要影响。WD患者可表现为帕金森样动作、舞蹈样动作、共济失调等不同类型,且严重程度不同。通过DTI研究[18-19]证实,DTI指标与WD类型之间有相关性,即震颤与小脑-丘脑-皮质网络相关。不自主运动与壳核、尾状核传入纤维损伤有关;肌张力增高与苍白球、黑质传出纤维损伤有关。
二、rs-fMRI
rs-fMRI是对大脑静息状态下自发活动进行研究的方法[20]。在静息状态下多个相关的脑区间具有一定的功能连接。常用的分析方法有局部一致性分析ReHo和低频振幅分析(amplitude of low-frequency fluctuations,ALFF),分别反映神经元自发活动和脑区自发神经元活动的一致性。本团队[21]通过WD患者的rs-fMRI研究发现,静息状态下,WD患者扣带回后部、前额叶皮层和双侧颞叶区域ALFF值较全脑平均水平增高,WD患者存在默认网络。WD患者核团ALFF、ReHo值降低,证明WD患者锥体外系存在功能连接异常。神经功能连接与WD患者的临床症状也有一定的关系(见图4、5)[21]。以精神症状为主的WD患者,其尾状核、丘脑的ALFF值、ReHo值异常于其他类型,推测皮层下核团如壳核、丘脑功能的神经元活动性抑制或者增强都可能与精神症状有关。

图4 WD患者与正常对照rs-fMRI ALFF值T检验图[21]
不对称性的影像学研究

图5 WD患者与正常对照rs-fMRI ReHo值T检验图[21]
WD患者神经症状有不对称性现象。步态、僵硬、震颤和舞蹈症状的左右不对称性在WD患者中很常见。神经症状不对称的机制尚不清楚。帕金森病不对称性可能与黑质中多巴胺神经元的不对称丢失有关[22]。本团队[22]通过SWI研究发现,WD患者黑质、丘脑等部位CP值不对称,提示WD患者大脑中的金属沉积有不对称性(见图6)。但WD患者皮质下核团CP值的不对称性与运动不对称性之间无相关性。WD患者的神经症状不对称可能与金属沉积不对称关系不大。通过DTI研究发现,WD患者皮层下核团FA值和λ值、核间纤维投射纤维数量不对称(见图7),表明锥体外系网络的损伤不对称。核团之间联系纤维损伤的左右差异是导致神经症状不对称的主要原因。黑质相关纤维联系不对称性影响肌张力增高症状不对称,丘脑、小脑、尾状核联系纤维的不对称是导致震颤等不自主运动产生左右差异的原因。纤维投射的不对称性对运动不对称性的影响可能大于核团损伤的不对称性。本团队的rs-fMRI研究[22]发现WD患者皮层下核团ALFF和ReHo值不对称。然而,rs-fMRI指标的不对称性与运动不对称性之间并没有相关性。

图6 WD患者SWI不对称性[22]

图7 WD患者DTI联系纤维不对称性[22]
肝型、脑型的影像学对比
肝型WD患者为何没有出现明显神经精神症状?目前尚没有明确的认识。本团队采用了影像学方法,比较了肝型、脑型患者脑部核团损伤、纤维网络损伤、功能代谢、金属沉积方面的差异。通过脑型和肝型SWI的CP值比较[23](见图8),脑型WD患者在壳核、尾状核等部位的CP值低于肝型,提示肝型WD患者脑部某些核团金属含量低于脑型。但是肝型、脑型WD患者核团SWI CP值的差异并无显著性,肝型WD患者脑部金属沉积量与脑型相比并无太大差异。另外,肝型WD患者在核团、核团投射纤维以及核团之间的联系纤维存在DTI指标异常,提示肝型WD患者在锥体外系存在结构性损伤。但是肝型WD患者在核团、核团纤维以及核团之间联系纤维的DTI指标,与脑型患者存在较多差异,提示肝型患者脑部纤维联系的损伤程度低于脑型患者(见图9)。rs-fMRI研究发现,肝型WD患者皮层下核团如苍白球、壳核的ALFF值低于正常,提示肝型WD患者脑部存在功能活动的下降。肝型、脑型WD患者在某些核团的ALFF值和ReHo值有差异,提示肝型WD患者脑部核团神经元活动性的损伤与脑型患者存在差异。

图8 WD患者及正常对照SWI图[23]
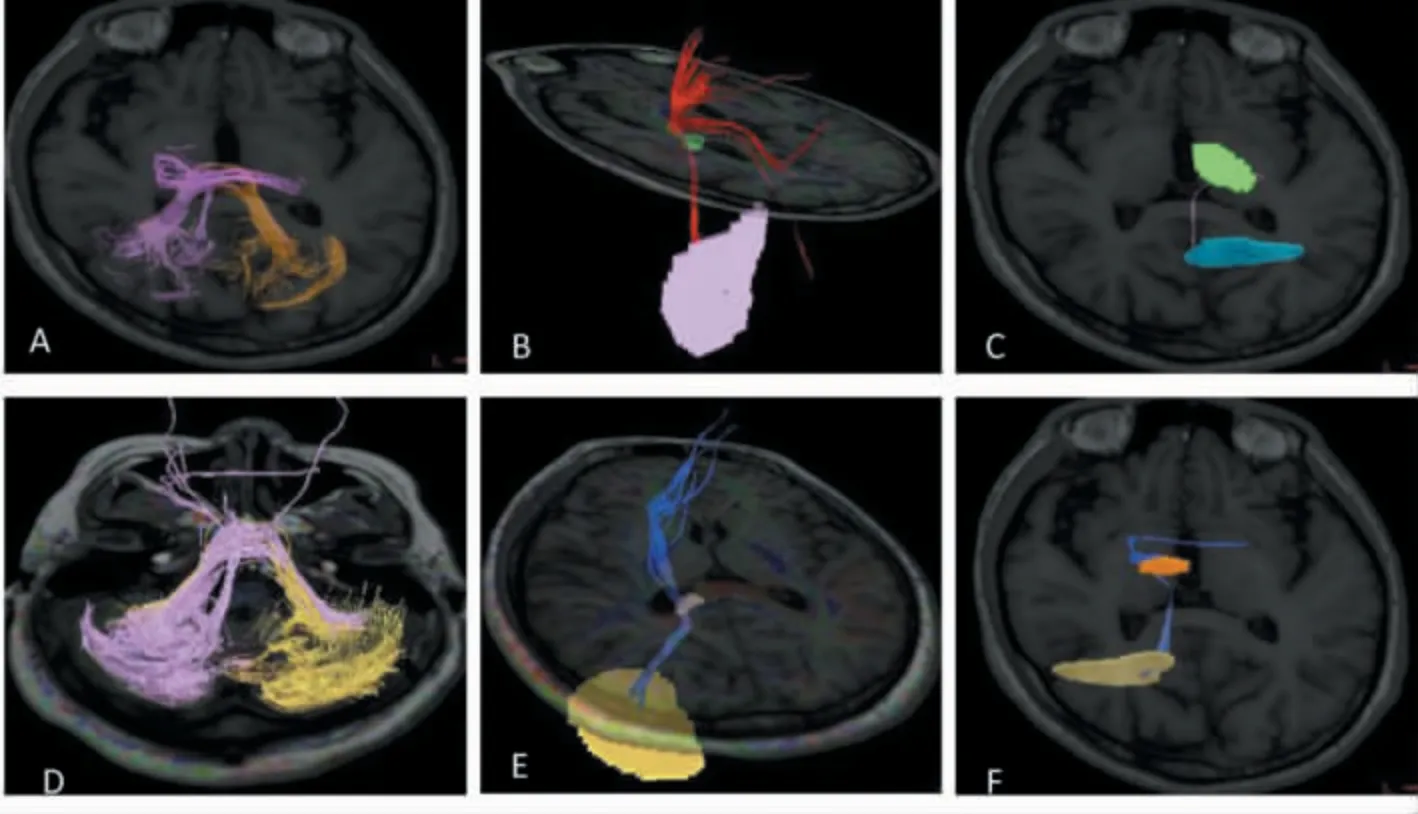
图9 肝脑型WD患者纤维联系图[23]
综上所述,神经系统影像学对于WD的诊断,病情评估,以及治疗效果评价方面都有重要作用。研究更多的影像学方法,在WD病理生理机制的分析、诊断、评估方面的应用,有重要的价值。

