农杆菌介导几种不同马铃薯外植体转化研究
曹贞菊, 李 飞, 陈明俊, 罗小波, 李 标, 尹 旺
(贵州省农业科学院生物技术研究所,贵州省马铃薯工程中心, 贵阳 550006)
马铃薯(SolanumtuberosumL.)起源于南美洲,茄科茄属草本植物,是继水稻、小麦和玉米后的第四大粮食作物。中国马铃薯种植面积占世界总种植面积的30%,种植分布区涵盖寒带、温带、亚热带、热带等多种生态区,发展马铃薯产业对保障中国粮食安全、西部扶贫开发、种植结构调整和农民增收具有重要意义[1]。然而马铃薯易受非生物胁迫的影响,包含高温、冷冻、盐分、干旱、水涝、辐射及重金属毒性等,这在很大程度上阻碍了马铃薯生长且造成严重经济损失[2]。其中,冷冻胁迫是影响马铃薯产量的主要因素之一。当温度低于-3 ℃时,马铃薯很难存活[3]。2008年,中国南部的冰雹导致马铃薯直接经济损失高达15亿元[4]。而近年来气候变化加剧,极端天气愈加频繁,挖掘植物自身的耐冻基因,培育耐低温霜冻的马铃薯品种尤显必要[5]。
脂肪酸脱氢酶基因(FAD2)是植物体内脂肪酸代谢中油酸转变为亚油酸的关键基因。植物的耐霜冻性依赖于体内饱和脂肪酸和不饱和脂肪酸的比例,饱和脂肪酸在脂肪酸脱氢酶的作用下转变单键为双键合成不饱和脂肪酸,并且单个脂肪酸的不饱和程度通常受基因和环境的调控[6]。
用农杆菌介导几种不同马铃薯外植体将具有耐冻性的FAD2基因转入马铃薯中,并比较不同马铃薯外植体转化效率,获得较为便捷、稳定的转化方法,为马铃薯基因转化研究提供可行方案。期望获得综合抗逆性明显增强的优良马铃薯新品系,为马铃薯抗性育种提供新材料,创造新种质资源。
1 材料与方法
1.1 试验材料与菌株
供试马铃薯品种中薯8号微型薯和中薯8号组培苗来自中国农业科学院蔬菜花卉研究所;黄金薯微型薯和Desiree组培苗由贵州省马铃薯工程中心实验室保存;FAD2基因由贵州省马铃薯工程中心实验室克隆;根癌农杆菌为GV 3101(购自上海维地生物技术有限公司)。
1.2 试验方法
1.2.1农杆菌活化
-80 ℃低温保存的GV 3101农杆菌株含有FAD2基因,接种到含有Kan(50 μg·mL-1)和Rif(20 μg·mL-1)的YEB固体培养基上,28 ℃培养48 h,挑取单菌落接种于5 mL含有Kan(50 μg·mL-1)和Rif(20 μg·mL-1)的液体培养基中,28 ℃培养24 h,再吸取2 mL菌液接种到50 mL含有Kan(50 μg·mL-1)和Rif(20 μg·mL-1)的液体培养基中,培养3~4 h,观察菌落生长情况并测OD600值,待OD600值到0.4时进行马铃薯外植体侵染。
1.2.2遗传转化
1) 农杆菌介导微型薯遗传转化
将中薯8号微型薯、黄金薯微型薯分别用蒸馏水冲洗干净,并用1%的次氯酸钠浸泡过夜,去皮切成1~2 mm的薄片,放入准备好的含FAD2基因的GV 3101菌液中浸泡10 min。用无菌镊子夹出,再无菌滤纸吸干表面多余菌液,转入含有4 mg·L-1ZT和0.2 mg·L-1IAA的MS共培养基上。28 ℃下黑暗培养2 d,见薯块周围出现淡淡一圈菌斑即可。
用无菌蒸馏水清洗共培养后的薯块3次,再用含有250 mg·L-1TIM的无菌蒸馏水浸泡薯块15 min,置于经高温灭菌的滤纸上,待薯块表面干后,转至含有4 mg·L-1ZT+0.2 mg·L-1IAA+250 mg·L-1TIM的MS培养基上进行脱菌培养7 d,在培养皿上盖上6层纱布,每天去除一层纱布,光照强度由弱到强,培养条件为24 ℃、1 500 lx、光照16 h/暗8 h的光周期下培养。将薯块转至含有4 mg·L-1ZT+0.2 mg·L-1IAA+250 mg·L-1TIM+50 mg·L-1Kan的MS培养基上进行抗性筛选培养,待分化出再生植株长到2~3 cm时,从愈伤组织上切下再生苗插入含有1 mg·L-1IBA+150 mg·L-1TIM的生根培养基中进行生根培养。
2) 农杆菌介导马铃薯组培苗茎段遗传转化
将用于转化所需的中薯8号无菌苗和Desiree无菌苗(培养4~5周),在超净工作台内,每个茎段切成1~1.5 cm长,需确保茎段上不含有生长点,在马铃薯预培养基上培养2 d,再在农杆菌GV 3101中浸泡茎段10 min,用吸水纸吸干后均匀排布在马铃薯共培养基上,黑暗条件下培养3 d,然后将茎段转至马铃薯愈伤培养基上培养,待2~3周后愈伤组织完全长出,将材料转接到马铃薯分化培养基上直至长出嫩芽,将1~2 cm嫩芽切下插入马铃薯生根培养基中,诱导完成完整的抗性组织。
马铃薯预培养基:MS固体培养基+2,4-D(0.1 mg·L-1)+6-BA(1 mg·L-1)
马铃薯共培养基:MS固体培养基+2,4-D(0.1 mg·L-1)+6-BA(1 mg·L-1)+AS(0.1 μmol·L-1)
马铃薯愈伤培养基:MS固体培养基+2,4-D(0.1 mg·L-1)+6-BA(1 mg·L-1) +TIM(100 mg·L-1)+Kan(50 mg·L-1)
马铃薯分化培养基:MS固体培养基+GA3(1 mg·L-1)+ZT(1 mg·L-1) +TIM(100 mg·L-1)+Kan(50 mg·L-1)
马铃薯生根培养基:1/2 MS固体培养基+IBA(1 mg·L-1)+TIM(150 mg·L-1)
1.2.3转化株PCR检测
参照BioMIG试剂盒操作说明提取马铃薯总DNA,以转化株的总DNA为模板,未转化株的总DNA为对照,正向引物为35 S-F 序列为5′-TGTAAAACGACGGCCAGT-3′,反向引物为FAD2-SmaⅠ-R序列为5′-TCAAGCGTAGTCTGGCATTACTTTTTTAAG-3′,扩增产物长度约为1 300 bp。通过PCR温度梯度试验,最佳退火温度为50 ℃。PCR反应体系包括10 μL 2×M 5-Tag -Mix,1 μL的35 S-F正向引物,1 μL的FAD2-SmaⅠ-R反向引物,1 μL DNA模板,用ddH2O补20 μL。PCR反应条件为:94 ℃ 3 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 2 min,35个循环;最后72 ℃延伸7 min,用1.5%的琼脂糖凝胶进行检测。
2 结果分析
2.1 农杆菌介导微型薯遗传转化结果分析
经过农杆菌侵染后的中薯8号微型薯薯片、黄金薯微型薯薯片在MS共培养基上28 ℃条件下黑暗培养2 d,转至含有4 mg·L-1ZT+0.2 mg·L-1IAA+250 mg·L-1TIM的MS培养基上进行脱菌培养7 d。将薯块转至含有Kan抗生素的MS培养基上进行抗性筛选培养,并逐渐分化出很多小突起。约35 d后,外植体开始萌生小芽点(图1)。待分化出的再生植株长到 2~3 cm时,从愈伤组织上切下再生苗插入含有Kan的生根培养基中进行生根培养。经过Kan连续筛选,获得中薯8号微型薯转化抗性植株15株,黄金薯微型薯转化抗性植株12株。

注:A为黄金薯转化15 d;B为黄金薯转化35 d;C为黄金薯转化55 d;D为黄金薯转化85 d;E为中薯8号转化15 d;F为中薯8号转化35 d;G为中薯8号转化55 d;H为中薯8号转化85 d。
2.2 农杆菌介导马铃薯组培苗茎段遗传转化结果分析
经农杆菌侵染后的中薯8号无菌苗茎段和Desiree无菌苗茎段,在MS共培养基上28 ℃条件下黑暗培养2 d,转至愈伤培养基上培养,待愈伤组织完全长出,再转至分化培养基上直至长出嫩芽(图2),待分化出的再生植株长到 2~3 cm时, 从愈伤组织上切下再生苗插入含有Kan的生根培养基中进行生根培养。经过Kan连续筛选,获得中薯8号茎段转化抗性植株13株,Desiree茎段转化抗性植株8株。
2.3 PCR检测结果分析
中薯8号微型薯和黄金薯微型薯,中薯8号无菌苗茎段和Desiree无菌苗茎段所获得的抗性植株进行PCR鉴定,中薯8号微型薯和黄金薯微型薯所获得的抗性植株分别检测出2株和3株阳性植株,中薯8号无菌苗茎段和Desiree无菌苗茎段所获得的抗性植株分别检测出2株阳性植株,均扩增出约1 300 bp与阳性对照相对应的条带,而未转化的马铃薯植株未能扩增出相应条带。
2.4 农杆菌介导不同马铃薯外植体转化效率分析
在遗传转化过程中,马铃薯诱导愈伤分化产生抗性芽,经过生根选择即为抗性植株,试验分别接种中薯8号微型薯和黄金薯微型薯,中薯8号无菌苗茎段和Desiree各无菌苗茎段各30个,诱导产生抗性芽分别为中薯8号微型薯抗性植株15株,经PCR检测阳性植株有2株,转化率为13.3%;黄金薯微型薯抗性植株12株,经PCR检测阳性植株有3株,转化率为25%。中薯8茎段抗性株13株,经PCR检测阳性株有2株,转化率为15.4%;Desiree茎段抗性株8株,经PCR检测阳性株有2株,转化率为25%。
在试验过程中发现,用中薯8号微型薯、黄金薯微型薯转化,污染较为严重,且需要频繁的更换培养基,而用无菌的中薯8号和Desiree茎段,污染较微型薯少。并且不同的杆菌浓度,也对试验过程产生影响,最适农杆菌浓度OD600值为0.4,大于或小于0.4均会导致外植体农杆菌污染严重而死亡;另外,在抗性植株生根培养过程中使用IBA的生根效果较IAA好。

注:A为Desiree茎段转化15 d;B为Desiree茎段转化35 d;C为Desiree茎段转化75 d;D为中薯8号茎段转化15 d;E为中薯8号茎段转化35 d;F为中薯8号茎段转化75 d。
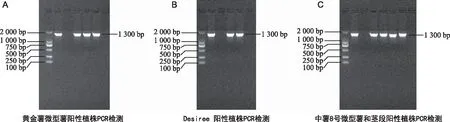
注:M为marker;P为阳性对照;C为阴性对照,其中A图中1~3为黄金薯微型薯转化阳性植株;图B中1~2为Desiree茎段转化阳性植株;图C中1~2为中薯8号微型薯转化阳性植株;3和4为中薯8号茎段转化阳性植株。

表1 农杆菌介导不同马铃薯外植体转化效率分析
3 讨 论
农杆菌介导法是应用最早、最实用、有效且有最多成功实例报道的植物转基因方法,在众多的转基因植物中80%是由农杆菌介导转化的[7]。马铃薯微型薯和茎段是农杆菌介导外源基因转化的理想受体,马铃薯高效的遗传转化体系具有基因型的依赖性,需根据不同品种、不同基因型和外植体转化关键因素进行优化选择。有许多关于农杆菌介导马铃薯基因遗传转化的研究报道,如齐恩芳等[8]以陇薯11号试管薯为材料,成功将PVX、PVS、PVY和PLRV四种病毒CP融合基因导入马铃薯;崔少彬[9]以脱毒微型薯为外植体,成功将ODREB2B基因导入中薯3号中,并提高了中薯3号的抗干旱和耐盐能力。石虎[10]以青薯9号无菌苗为外植体,优化遗传转化体系获得ERFs类转录因子抗性植株。本研究以马铃薯中薯8号微型薯和黄金薯微型薯,中薯8号无菌苗茎段和Desiree无菌苗茎段为外植体,通过根癌农杆菌介导方法成功转化马铃薯,并对遗传转化中的关键因素进行优化。
在马铃薯转化过程中,不同品种、农杆菌的浓度和抗生素的选择对转化出阳性植株很重要,这能有效去除农杆菌侵染造成的污染和确保转化植株的正常生长。作为遗传转化的材料,必须来源充足和再生稳定,且在生长状态最好的时间段进行遗传转化。综合以上因素,通过对马铃薯不同品种不同外植体进行遗传转化分析,发现马铃薯茎段转化效率相对微型薯高,且工作量和污染相对较少。用微型薯转化,污染较为严重,且需要频繁的更换培养基。并且在试验过程发现,最适农杆菌浓度OD600值为0.4,OD600值大于或小于0.4,均会导致外植体农杆菌污染严重而死亡。此外,在促进转化植株生根过程中发现,IBA的生根效果比IAA更好。
本研究获得的转FAD2基因马铃薯阳性植株进行PCR检测,确认FAD2基因已经整合到马铃薯中,这为后续的遗传转化试验及FAD2的功能验证和耐冻性鉴定奠定基础。

