小麦高配对材料CS-PhI的鉴定
裴自友, 程天灵, 温辉芹, 辻本壽, 李 雪, 王宏兵, 张立生
(1.山西农业大学农学院, 太原 030031; 2.鸟取大学干燥地研究中心, 日本 鸟取 680-0001)
染色体重组是对基因组重新排列组合的过程,对育种和遗传研究都有重要意义。普通小麦(TriticumaestivumL.)是异源六倍体(2 n=6 X=42),染色体组为AABBDD。在普通小麦的减数分裂中只有同源染色体可以发生配对重组,这种类二倍化的减数分裂配对机制是受小麦5号染色体长臂上的主效基因Ph1控制。操控Ph基因诱导小麦-外源部分同源染色体配对重组,形成高遗传补偿性的染色体易位,是利用近缘属种优良基因的重要方式[1-3]。
有些拟斯卑尔脱山羊草(Ae.speltoides,SS)可以在5 B染色体存在的情况下提高小麦×拟斯卑尔脱山羊草杂种F1的部分同源染色体配对水平。原因是拟斯卑尔脱山羊草含有抑制Ph基因效应的显性上位基因(PhI,又称高配对基因),该基因能够诱导普通小麦与小麦近缘种属的部分同源染色体配对和交换[4-5]。Dvorak等[6]定位了拟斯卑尔脱山羊草中能够抑制Ph1的两个主效QTL(Su1-Ph1和Su2-Ph1),分别位于3 S长臂和7 S长臂上,利用Su1-Ph1抑制系统定向诱导部分同源染色体间的重组交换[7]。
Chen等[8]将拟斯卑尔脱山羊草中PhI基因转移到普通小麦中国春上,育成含有PhI基因的普通小麦中国春高配对材料(Chinese Spring PhI,以下简称CS-PhI),利用该材料与硬簇麦杂交育成了小麦-簇毛麦T 5 VS·5 VL-5 DL易位系[9]。
目前对高配对材料CS-PhI的染色体组成仅进行了染色体C带分析,初步定为小麦4 D易位[8],但尚无准确的定论,且没有有效的连锁标记。随着技术的进步,利用基因组原位杂交(Genomic in situ hybridization, GISH)、重复序列探针双色或多色荧光原位杂交(fluorescence in situ hybridization,FISH)技术相结合可以更高效地识别染色体的身份[10-14]。
为了明确小麦高配对材料CS-PhI的分子细胞遗传学组成,本研究利用基因组原位杂交和简单重复序列(AAG)5为探针的FISH技术鉴定CS-PhI中小麦与拟斯卑尔脱山羊草的易位情况。同时开展白粉病抗性基因推导与成株期抗性鉴定,旨在了解其遗传多样性,为今后的利用提供科学依据。
1 材料与方法
1.1 材 料
小麦高配对材料CS-PhI由南京农业大学细胞所提供,山西农业大学农学院优质小麦课题组保存。简单重复序列(AAG)5由日本葛莱娜有限公司合成,拟斯卑尔脱山羊草和普通小麦中国春由日本鸟取大学农学部植物遗传育种实验室提供。
用于苗期小麦白粉菌抗谱比较分析的39个携带已知抗病基因品种(系)、2个感病对照(阿夫和Chancellor)和23个不同毒性的小麦白粉菌菌株均由中国农业科学院植物保护研究所周益林研究员提供。
成株期鉴定所用白粉病菌株为混合菌株,具体见文献[15]。
1.2 方 法
1.2.1根尖有丝分裂中期染色体制片
参照郭明慧等[16]的方法进行根尖有丝分裂中期染色体制片。
1.2.2GISH分析
用tetramethyl-rhodamine-5-dUTP标记的拟斯卑尔脱山羊草基因组DNA为探针,普通小麦中国春基因组DNA作封阻DNA,杂交程序参照Cho等[17]的方法。
1.2.3顺序FISH-GISH分析
参照Cho等[17]和温辉芹等[18]的方法进行顺序原位杂交,首先用tetramethyl-rhodamine-5-dUTP标记合成的简单重复序列(AAG)5进行FISH分析,观察、照相后将信号洗脱, 再以1.2.2方法进行GISH分析,用Olympus BX 61荧光显微镜对同一细胞观察、照相。
1.2.4苗期抗白粉病基因推导
试验在中国农业科学院植物保护研究所温室进行,具体参考曹学仁等[19]的方法。
1.2.5成株期白粉病抗性鉴定
试验在山西农业大学东阳试验基地优质小麦课题组白粉病鉴定圃进行,具体参照程天灵等[15]的方法。
2 结果与分析
2.1 分子细胞学鉴定
根尖细胞有丝分裂中期染色体GISH结果表明,CS-PhI染色体数目2 n=42,含一对小麦与拟斯卑尔脱山羊草小片段双末端易位染色体,易位位置为小麦染色体的端部,且易位染色体为一对随体染色体(见图1)。

注:箭头表示小麦-拟斯卑尔脱山羊草易位染色体。
对根尖细胞有丝分裂中期染色体同一制片进行顺序FISH和GISH分析,探针分别为重复序列(AAG)5和拟斯卑尔脱山羊草基因组DNA,GISH时普通小麦中国春基因组DNA作封阻,结果见图2。研究发现,图2-A箭头所示易位染色体在着丝粒附近FISH带型丰富,根据小麦(AAG)5标准带型,进一步确定易位涉及的小麦染色体为6 B。图2-B箭头标示小麦-拟斯卑尔脱山羊草易位染色体,易位的拟斯卑尔脱山羊草染色体两端均有GISH带型(信号相对较弱)。

图2 CS-PhI同一根尖细胞有丝分裂中期染色体顺序FISH-GISH
2.2 白粉病抗性鉴定
2.2.1苗期小种抗性鉴定与抗性基因推导
基因推导结果(表1)表明,CS-PhI对3个小种表现免疫或高抗,对其他小种表现中感或高感。初步看,CS-PhI与Pm4c或Pm3b的抗谱有些相似,但考虑品种的背景不同,因此是否是新的基因还需进行综合分析研究。
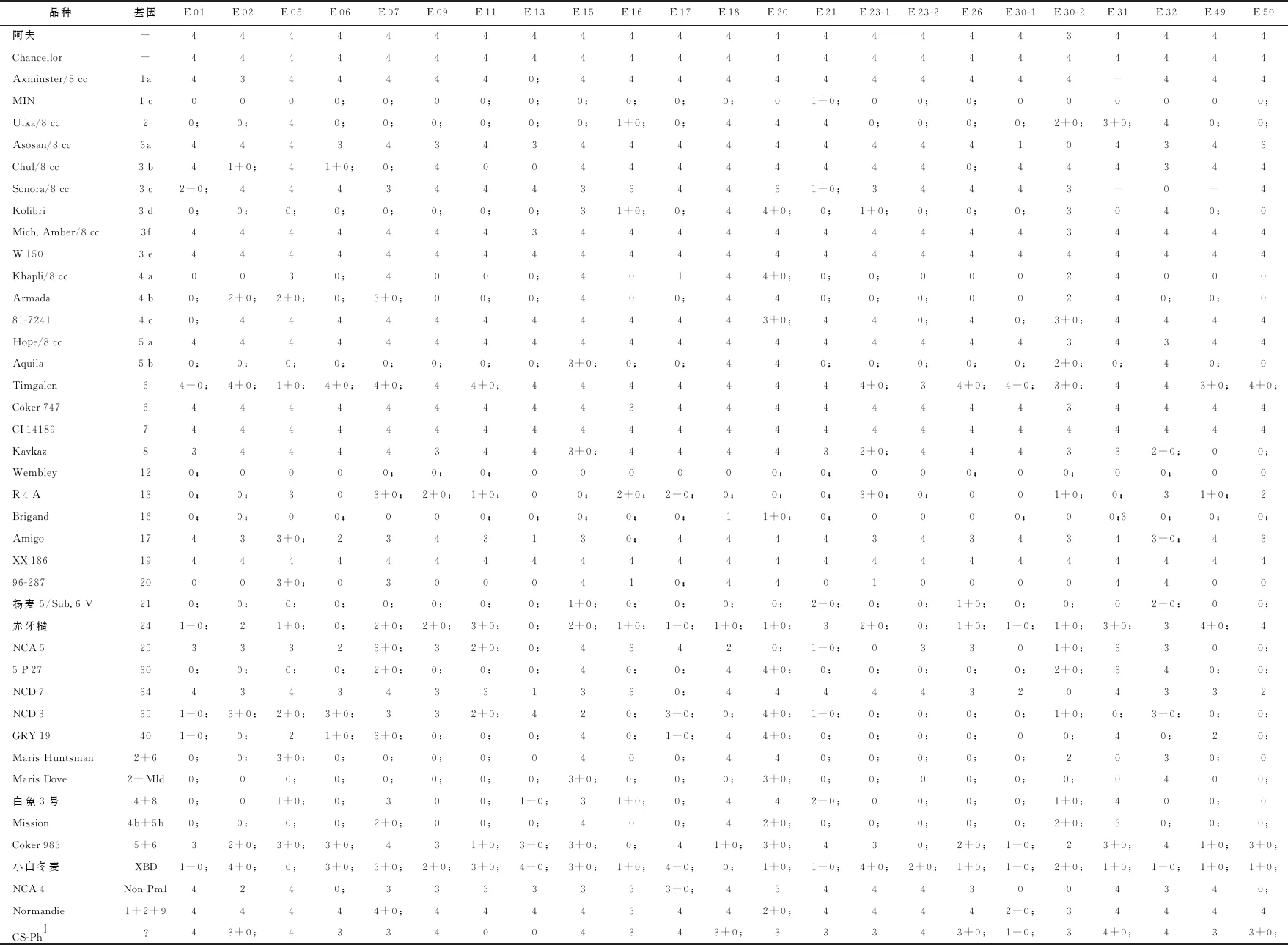
表1 对小麦白粉菌不同菌株的反应型
2.2.2成株期抗性鉴定
成株期白粉病抗病性鉴定结果表明,感病对照京双16为8级,CS-PhI病级为0级,表现免疫。
3 讨 论
以基因组DNA为探针的GISH推动了外源染色体鉴定,GISH和以单链寡核苷酸为探针的FISH技术的紧密结合,促进了染色体的精准鉴定,已广泛用于小麦种质材料分析[20-21]。
在小麦起源中由于S染色体组与B染色体组亲缘关系较近,因此为了保证鉴定结果的可靠性,预备试验中以S基因组为探针,对已知含杀配子染色体(gametocidal chromosome)的小麦-拟斯卑尔脱山羊草易位系CS-Gc1a(大片段易位)和CS-Gc1b(小片段易位)[22]进行准确的GISH鉴定。
本研究根据普通小麦中国春(AAG)5标准染色体分子核型[12-13],结合GISH结果,明确CS-PhI为双末端小片段拟斯卑尔脱山羊草易位系,易位涉及的小麦染色体为6 B,尚不能确定易位的拟斯卑尔脱山羊草染色体为第几条S染色体,因此,CS-PhI中易位染色体为T 6 BS·S/T 6 BL·S。对CS-PhI材料的识别和开展PhI基因的标记研究具有极其重要的价值。已建立了中国春与CS-PhI遗传标记群体,并对F2单株分析染色体减数分裂中期染色体配对情况(含PhI基因会出现多价体),为进一步筛选与PhI基因紧密连锁标记的分子标记奠定基础。
Chen等[8]通过染色体C-分带分析发现,CS-PhI的4 D染色体异常,判断其为小麦4 D与S染色体的易位系。本研究中易位的小麦染色体不是4 D而是6 B,推测可能是所用材料的差异所致。CS-PhI分不同的品系,组合来源均为(中国春×拟斯卑尔脱山羊草)/中国春BC2F3后代单株,GISH鉴定发现在鸟取大学辻本壽教授研究室保存的CS-PhI材料中没有外源基因信号,可能为小麦-拟斯卑尔脱山羊草渐渗系(另文发表)。
目前小麦白粉病在育种和生产上面临着抗源单一化和抗病性容易丧失的严峻现状[23],因此有必要挖掘与利用不同基因资源,其中利用小麦成株抗性是未来实现品种持久抗性的最佳选择[24]。刘成等[25]研究表明,来源于小麦近缘植物的抗白粉病基因有41个,其中包括来自拟斯卑尔脱山羊草的Pm12、Pm32和Pm53。本研究中,CS-PhI表现苗期对绝大多数白粉病生理小种感病、成株期抗病,为成株期抗病优异材料,后期应进行白粉病抗性遗传分析。
CS-PhI株高120 cm左右,颖壳有绒毛,有抽穗迟、晚熟、农艺性状较差,抗寒性弱等缺点,不宜直接作育种亲本,为了利用其成株期高抗白粉病、耐热等优异特性,已通过与长麦6686和长7080等栽培品种杂交改良,培育出农艺性状优良的抗白粉病新种质。

