老年住院2型糖尿病患者合并肌少症的情况及其影响因素
张宁,刘晓红*,陈伟,朱鸣雷,康琳,王秋梅,康军仁
(中国医学科学院北京协和医学院北京协和医院:1老年医学科,2临床营养科,北京 100730)
肌少症是一种与年龄相关的骨骼肌质量下降,及肌力和(或)功能下降的老年综合征,增加衰弱、跌倒、抑郁、认知功能减退及死亡风险等不良结局[1,2],严重影响老年人的生活质量,增加疾病负担。2型糖尿病(type 2 diabetes mellitus,T2DM)患者肌少症的共病率更高[3]。因此,近年来研究认为,应将肌少症作为老年T2DM的共病之一进行筛查和评估[4]。国外报道老年T2DM患者中肌少症患病率为7.0%~29.3%[4,5]。对于老年糖尿病(diabetes mellitus,DM)患者,尤其是高龄患者,评价健康状况更重要的指标是功能状态。国内针对老年T2DM患者合并肌少症的报道较少,且缺乏对老年T2DM患者共病情况、老年综合征情况及综合管理的临床研究。本研究旨在分析老年住院T2DM患者中肌少症的患病情况及其影响因素,探讨基于老年综合评估的老年T2DM患者全人管理措施。
1 对象与方法
1.1 研究对象
连续入选2018年1月至2019年12月于北京协和医院老年医学科住院治疗,且年龄≥65岁的T2DM患者为研究对象。T2DM诊断采用世界卫生组织1999年诊断标准[6]。排除标准:(1)失语、谵妄或因严重认知功能障碍而无法交流;(2)合并帕金森综合征、严重骨关节病影响躯体活动,或正在治疗的肿瘤患者;(3)体内放置金属支架或起搏器;(4)病情不稳定,不同意参与研究,量表信息或评估资料不全者。本研究获得北京协和医院伦理委员会审批(批准文号:S589)。入选者均签署知情同意书。
1.2 方法
建立临床数据库,详细记录研究对象的年龄、性别、身高、体质量并计算体质量指数(body mass index,BMI);记录高血压、慢性肾脏病、焦虑/抑郁等基础疾病情况及糖尿病靶器官病变情况。所有入选患者在住院次日清晨空腹取血,检测白细胞总数(white blood cell count,WBC)、血红蛋白(hemoglobin,HGB)、空腹血糖(fasting blood glucose,FBG)、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、肌酐(creatinine,Cr)、血浆总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、血清白蛋白(albumin,ALB)、前白蛋白(prealbumin,PA)、超敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)等指标。在完成常规检测的基础上进行肌少症筛查及老年评估(comprehensive geriatric assessment,CGA)。评估者均为接受过标准化CGA培训1周的老年科医师。
1.2.1 肌少症评估 肌肉功能评估包括测量握力、步速、5次坐立试验及平衡测试。握力测量采用Jamar手握力计,嘱患者双手各进行2次握力检测,取握力的最大值进行研究。步速测量采用6 m步速测量,计算步速(m/s)。5次起坐时间测试为患者坐于高43 cm无扶手的椅子上,双手交叉于胸前,双脚着地,背部不倚靠椅背。在听到开始命令后,以最快速度完成5次起立与坐下动作。记录患者完成5次动作的时间,测试数值越小,表明从坐到站动作能力越好。平衡测试为测量全足距站立,站立时间<12 s为不能完成测试[7]。根据2014年亚洲肌少症工作组(Asian working group of sarcopenia,AWGS)制定的亚洲肌少症诊断标准进行诊断[8]。(1)步行速度切点:6 m日常步行速度评估≤0.8 m/s;(2)握力切点:男性<26 kg,女性<18 kg。存在上述(1)和(或)(2)情况时,进一步采用生物电阻抗法(韩国Biospace公司Inbody720型身体成分测试仪)测量肌肉质量,计算四肢骨骼肌指数(appendicular skeletal muscle index,ASMI)。ASMI=四肢骨骼肌量(kg)/身高2(m2)。ASIM<7.0 kg/m2(男性)或<5.7 g/m2(女性)时诊断为肌少症。
1.2.2 其他老年评估 (1)应用Katz日常生活能力量表(Katz index of independence in activities of daily living,Katz ADL)[9]评估患者的基本日常生活活动,包括如厕、进食、穿衣、洗澡、梳洗及行走 6 项内容;(2)应用Lawton工具性日常生活活动能力量表(Lawton instrumental activities of daily living scale, Lawton IADL)量表[10]评估患者的工具性日常生活活动能力,包括使用交通工具、做饭、服药、 洗衣、打电话、理财、购物及做家务 8 项内容;(3)应用Charlson共病指数[11](Charlson comorbidity index,CCI)评估患者的共病情况;(4)核查患者长期用药,评估是否存在多重用药(polypharmacy),即同时使用≥5种药物(包括非处方药、中药、保健品);(5)采用微营养评估简表(mini nutritional assessment short form,MNA-SF)评估患者的营养状况(≤7提示营养不良,8~11分提示营养风险)[12];(6)询问患者1年内跌倒史,是否合并尿失禁、焦虑、抑郁及居住情况。
1.3 统计学处理
2 结 果
2.1 患者一般资料、老年评估指标及血清学指标情况
本研究共纳入资料完整、年龄≥65岁的老年T2DM住院患者225例,其中男性占52.4%(118/225),中位年龄70岁(65~93岁),中位住院时间11 d。肌少症患者59例(肌少症组),非肌少症患者166例(非肌少症组)。患者一般资料、老年评估指标及血清学指标情况详见表1。
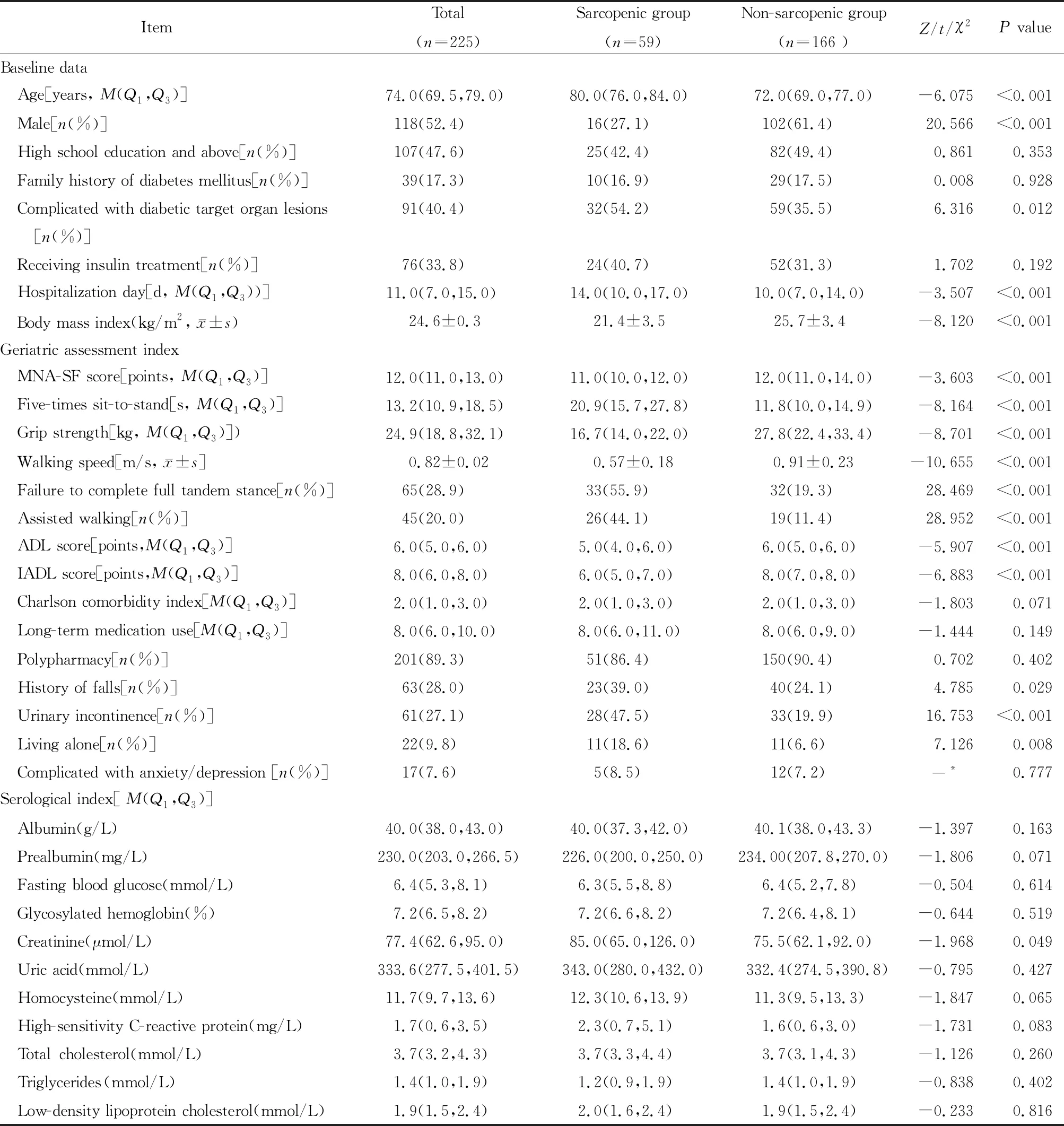
表1 2组患者一般资料和老年评估及血清学指标比较
与无肌少症组比较,肌少症组具有以下临床特征:(1)年龄更大、男性比例及BMI水平较低(P均<0.05);(2)合并糖尿病靶器官病变的比例更高、住院时间更长(均P<0.05);(3)MNA-SF分值较低,既往有跌倒史、合并尿失禁、需要辅助行走的比例更高(均P<0.05);(4)基本日常生活活动(activities of daily living,ADL)、工具性日常生活活动(instrumental activities of daily living,IADL)分值、手握力及步速明显低于无肌少症组(均P<0.05);(5)5次起坐时间明显延长,不能完成全足距测试的比例明显高于无肌少症组(P<0.05);(6)血肌酐水平较高(P<0.05),空腹血糖、糖化血红蛋白、血白蛋白及前白蛋白等其他血清学指标的差异均无统计学意义(均P>0.05)。
2.2 肌少症在不同性别及年龄段T2DM患者中的分布情况
肌少症在65岁≤年龄<70岁,70岁≤年龄<75岁,75岁≤年龄<80岁及≥80岁T2DM患者中的患病率分别为7.1%,14.3%,29.4%及56.4%,患病率随年龄增长显著增加,差异有统计学意义(P<0.001)。肌少症在不同性别、年龄段的患病率详见表2。

表2 肌少症在不同性别及年龄段T2DM患者中的分布情况
2.3 老年T2DM患者合并肌少症的多因素 logistic 回归分析
将肌少症组与无肌少症组患者的一般资料进行单因素回归分析,结果显示,影响老年T2DM患者合并肌少症的相关因素包括年龄、性别、合并糖尿病靶器官病变、住院时间、BMI、跌倒史、合并尿失禁、独居、需要辅助行走、MNA-SF评分、ADL评分、IADL评分、5次起坐时间、不能完成全足距测试及血肌酐水平(均P<0.05)。将单因素分析中与肌少症相关的因素进一步进行多因素logistic 回归分析,结果显示:低BMI(OR=0.716,95%CI0.609~0.842,P<0.001)和需要辅助行走(OR=4.391,95%CI1.167~16.512,P=0.029)是老年T2DM患者合并肌少症的影响因素(表3)。

表3 老年T2DM患者合并肌少症的多因素logistic回归分析
3 讨 论
近年来,肌少症对DM、慢性心力衰竭、冠心病等心血管及代谢性疾病老年患者生活质量及预后的影响越来越受到关注[5,13,14]。本研究结果显示,26.2%的住院老年T2DM患者合并肌少症。根据2014年亚洲肌少症工作组诊断标准,英文文献报道的肌少症在老年T2DM患者中的患病率为7.0%~28.8%[15-17]。肌少症在DM患者中的患病率明显高于血糖正常人群[18]。近期的一项meta分析入选1 832例T2DM患者,其中1 159例患者合并肌少症,同时入选4 694名血糖正常者作为对照。结果显示,T2DM患者中肌少症的患病率显著高于血糖正常人群(OR=1.55,95%CI1.25 ~1.91,P<0.001)[19]。
本研究还发现,合并肌少症的老年T2DM患者不仅合并糖尿病靶器官病变的比例更高,有跌倒史、尿失禁、躯体功能减退(IADL、ADL下降,需要辅助行走及不能完成全足距测试)、独居的比率也显著升高,住院时间更长。同时,本研究中,高达89.3%的老年T2DM患者存在多重用药。提示在临床工作中,对老年T2DM患者管理血糖及DM并发症的同时,还应通过老年评估识别上述问题,通过包括老年科医师、营养师、康复师及临床药师等在内的老年跨学科团队查房,制定相应的营养支持、药物重整、康复训练及中长期照料等方案,对合并肌少症的老年T2DM患者进行协同管理。
本研究中,合并肌少症的T2DM患者中位年龄明显高于无肌少症患者,且肌少症的检出率随增龄而明显升高。近期12篇关于老年T2DM合并肌少症患者的回顾性分析显示,合并肌少症的老年T2DM患者中位年龄为73.6岁,而无肌少症患者的中位年龄为67.2岁,合并肌少症患者年龄显著高于无肌少症患者[20]。本研究中,女性患者肌少症的检出率明显高于男性。肌少症在男性还是女性T2DM患者中的患病率更高,研究结论不一致。回顾近3年发表的19项老年T2DM患者合并肌少症相关的临床研究,其中3项研究提示男性患者肌少症患病率明显高于女性[5,16,18];2项研究显示女性肌少症的患病率显著高于男性[21,22];其余14项研究则显示,不同性别T2DM患者中肌少症的患病率无显著差异[ 15,17,23]。性别对老年T2DM患者发生肌少症的影响,有待今后更大样本量的临床研究及高质量荟萃分析明确。
本研究结果显示,低BMI及需要辅助行走是老年T2DM患者合并肌少症的影响因素。何清华等[24]对北京地区1 125例≥50岁T2DM患者的横断面研究显示,BMI较低(OR=0.241, 95%CI0.138~0.421)是肌少症患病的相关危险因素之一。Cui等[25]对132例≥65岁T2DM患者的横断面分析显示,较高的BMI值是老年T2DM患者合并肌少症的保护性因素(OR=0.365, 95%CI0.236~0.661)。吴丽娟等[26]对亚洲地区老年T2DM患者肌少症患病率和影响因素的meta分析显示,低BMI(OR=-2.35, 95%CI-1.08~-5.11)亦是老年T2DM患者发生肌少症的危险因素之一。本研究结果与上述研究结果一致。
T2DM患者发生肌少症可能有以下原因:(1)糖代谢异常加速蛋白质分解代谢,导致肌肉质量减少和功能下降;肌肉质量下降加重胰岛素抵抗,胰岛素抵抗又进一步抑制肌肉蛋白合成[27]。(2)糖代谢紊乱增加炎症细胞因子和活性氧自由基生成,促进糖基化反应,加重T2DM的神经及肌肉病变[28]。长期高血糖促进骨骼肌内晚期糖基化终末产物(advanced glycosylation end products,AGEs)蓄积,而AGEs水平升高与握力、腿部伸展力量下降及步速减慢密切相关[29]。(3)营养相关问题。Okamura等[30]研究显示,合并肌少症老年T2DM患者的总热量摄入显著低于无肌少症患者(1499和1786 kCal/d);校正年龄、性别、运动量、BMI等因素后,热量摄入不足是患者合并肌少症的风险因素(OR=0.86,95%CI0.78~0.95;P=0.001)。另一项研究显示,合并肌少症老年T2DM患者ω-3脂肪酸的摄入量明显低于无肌少症患者(2.6和3.0 g/d)[31]。(4)运动不足。多项临床研究显示,合并肌少症的T2DM患者活动量明显低于无肌少症患者[32]。de Freitas等[18]研究显示,步行>5 401 步/d可使老年T2DM患者肌少症的患病风险下降70%。(5)肌肉间脂肪组织浸润。肌肉间脂肪组织(intermuscular adipose tissue,IMAT)浸润与多种疾病状态下骨骼肌力量下降和身体躯体功能减退有相关性,并与胰岛素抵抗、亚临床动脉粥样硬化及代谢综合征相关,且与胰岛素敏感性呈负相关[33]。Sachs等[34]研究显示,IMAT可能是调节骨骼肌对胰岛素敏感性的重要因子,并可能是改善胰岛素抵抗的新治疗靶点。
本研究中,合并肌少症的患者营养相关指标(MNA-SF评分)明显低于无肌少症患者,故需要关注伴有肌肉功能下降的老年T2DM患者的营养状况。此外,老年T2DM患者肌少症、衰弱及营养不良存在重叠现象。故应基于老年评估结果,为老年T2DM患者制定个体化血糖管理方案,同时纠正引起上述老年综合征的可逆因素。
本研究存在一定的局限性。(1)样本量小,今后应进一步扩大样本量,并随访肌少症对老年T2DM患者预后及生活质量的影响。(2)本研究仅为单中心研究,入选患者可能存在选择偏倚,因此,本研究获得的肌少症的患病比例有待更大样本的多中心研究验证。(3)本研究为观察性研究,未能提出针对老年T2DM人群合并肌少症的干预措施。基于本研究结果,肌少症在住院老年T2DM患者中的患病率较高,而临床医师对此认识尚不足。因此,我们建议对于低BMI、躯体功能下降的老年T2DM患者,应筛查肌少症并进行相应干预。

