姜黄素通过调控TLRs/NF-κB 信号通路对EAE 小鼠凋亡的影响及其机制
刘梦兰,谢 阳,曾春蓉,李作孝
(西南医科大学附属医院神经内科,泸州四川 646000)
多发性硬化(multiple sclerosis,MS)的主要疾病特征包括炎性细胞浸润、中枢神经系统脱髓鞘,其致残率高,病因不明。目前有病毒感染、自身免疫性反应、遗传、环境等多种假说,自身免疫性反应得到了普遍认可,但免疫抑制剂的使用并没有很好地延缓MS 患者病情的恶化[1]。随着近年来研究的深入,细胞凋亡、细胞自噬、线粒体功能障碍、星型胶质细胞增生等均被认为与MS 的发病相关,以上研究方向也越来越受到研究者们的重视。通过对MS 病人的尸检证实,新病灶出现时,细胞凋亡是最早的病理改变之一。细胞凋亡出现后才有炎症细胞浸润、吞噬斑块的形成、轴突的损伤等多种MS 典型的病理表现[2]。而在MS 的多条通路中,TLRs/NF-κB 信号通路是经典的免疫通路,TOLL 样受体(toll-like receptors,TLRs)是启动主动免疫的关键,细胞信号级联反应可因TLRs 被抗原激活后触发,继而激活核转录因子κB(NF-κB)通路,最终启动自身免疫反应[3]。在细胞内众多核转录因子中,NF-κB 是最重要的因子之一,对细胞凋亡和炎性反应都具有重要调节作用。目前公认转录NF-κB 在细胞凋亡过程中起到了关键作用,其机制是多种炎症因子、代谢应激、化学反应等激活NF-κB 信号通路后,导致NF-κB 从细胞浆向细胞核内移位,从而引起细胞凋亡[4]。但目前尚无确切关于NF-κB 信号通路被激活后引起细胞凋亡从而引起机体的自身免疫反应最终导致MS 发生的相关报道。本研究通过对使用某种药物使TLRs/NF-κB信号通路被抑制,减少细胞凋亡对脊髓神经细胞的损伤破坏,从而对实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)小鼠产生保护作用。
姜黄素是植物姜黄的干燥根茎及中药姜黄的天然提取物,具有抗炎、抗氧化、抗肿瘤及抗凋亡等多方面的药理作用[5],对神经系统、消化系统、肿瘤等方面都具有一定研究价值[6,7]。在既往的研究中,姜黄素常与炎症相联系,在近期的研究中,姜黄素对细胞的抗凋亡作用才被逐渐重视起来。有报道称,姜黄素可通过下调NF-κB 信号因子保护EAE 小鼠神经[8],但该保护作用的机制是否通过减少细胞凋亡实现文中尚未提及。近年来,中医中药发展日益壮大,国家亦大力提倡与支持,许多中药提取物虽具有一定疗效,但缺乏有效理论数据支撑。因此,本研究通过对EAE 小鼠腹腔注射姜黄素,探讨细胞凋亡、TLRs/NF-κB 信号通路与自身免疫性反应的关系,并探讨姜黄素是否通过上述通路对小鼠神经系统起保护作用,为临床治疗MS 提供更多实验依据。
1 材料与方法
1.1 实验材料、试剂
本研究选用45 只实验用C57BL/6 雌性小鼠,武汉恒意赛生物科技有限公司[SCXK(鄂)2020-0018,SYXK(鄂)2017-0065],鼠龄6~8周,体重17~20 g,购买后饲养于西南医科大学忠山校区中心实验室动物房中,已获得动物伦理批准,编号2020696。饲养室温22~26 ℃,每12 h 明暗交替一次,给予足够食料与饮水,定期更换动物垫料保持清洁,对于动物的饲养、取材、保存组织、处死等操作严格按照实验室规范进行。实验全过程符合《实验室动物饲养和操作条例》。MOG35-55(国泰生物),结核杆菌H37Ra(BD 公司),百日咳毒素(GLPBIO 公司),福氏完全佐剂(美国Sigma 公司),姜黄素(武汉恒意赛生物科技有限公司);PBS 溶液(武汉阿斯本生物技术有限公司),蛋白酶K(Roche 公司),DAPI 染液(武汉阿斯本生物技术有限公司),TUNEL 试剂盒(Roche 公司),TLR4 抗体(武汉恒意赛生物科技有限公司),NF-κBp65 抗体(武汉恒意赛生物科技有限公司),髓样 分 化 因 子88(myeloiddiferentiation factor 88,MyD88)(武汉恒意赛生物科技有限公司),Bcl-2 抗体(Mouse,IF),Bax 抗体(武汉恒意赛生物科技有限公司)。
1.2 实验方法
1.2.1 动物造模及分组处理 将45 只小鼠随机分为空白组、EAE 组、姜黄素组,每组15 只。EAE 组及姜黄素组制备EAE 模型。首先将MOG35-55 多肽用生理盐水稀释成5 mg/mL,然后加入相同体积(1∶1)的完全弗氏佐剂和一定量的结核菌素使之互相混合形成油包水乳剂,最终使水乳剂中结核杆菌H37Ra 浓度达4 mg/mL,接下来在实验小鼠脊柱两侧分别选4 个点皮下注射0.1 mL 的试剂,并且将百日咳毒素剂量为500 ng/只,于实验小鼠免疫注射的第0 天(0 h)、第2 天(48 h)进行2 次腹腔内注射。自造模当日起空白组与EAE 组腹腔注射生理盐 水1 mL·kg-1·d-1,姜黄素组小鼠分别以100 mg·kg-1·d-1连续腹腔注射,每日同一时间(上午9 时)由同一位实验员分别对各组小鼠的活动、进食、毛发分布情况、体重、四肢瘫痪情况、尾巴活动情况等进行相应记录,以Benson 5 分评分标准每天对小鼠进行1 次神经功能障碍评分。自造模当天开始给药至发病高峰期,处死小鼠取材。
1.2.2 HE 染色观察小鼠脊髓组织病理变化 将发病高峰期小鼠取出,充分麻醉后暴露心脏,先用温热的生理盐水进行灌注至肝脏发白,然后用4%多聚甲醛灌流(约30 min)后取出脊髓组织,行常规石蜡包埋,于腰膨大处连续切片,制作3~4 μm 石蜡切片,将复水完毕后置于蒸馏水中的石蜡切片轻轻甩干,使用HE 染色试剂盒中苏木素染核5 min,用洗瓶中的蒸馏水轻轻冲洗,如镜下观察核着色过蓝,则滴加1% 盐酸酒精分色2 s,迅速水洗后,滴加0.5%氨水行返蓝染色1 min,水洗,75%乙醇快冲过组织,勿洗,随后滴加1%醇溶性伊红染液30 s,水洗,使用100%乙醇对组织进行脱水1 min,于通风橱中晾干,二甲苯透明10 min 后,于通风橱中晾干,最后滴加中性树胶后,用盖玻片封片,光镜下观察脊髓组织病理改变。
1.2.3 TUNEL 染色观察小鼠细胞凋亡情况以及计算其凋亡阳性细胞率 37 ℃下胰蛋白酶K 工作液处 理 组 织25 min,试 剂1(TdT)50 μL+试 剂2(dUTP)450 μL 混 匀,制 备TUNEL 反 应 混 合 液,PBS 漂洗3 次,玻片干后,滴加50 μL TUNEL 反应混合液于标本上,加盖玻片37 ℃下暗湿盒中反应1 h,PBS 漂洗3 次,滴加50 μL DAPI 染液于标本上,同样条件下反应30 min,PBS 漂洗3 次,滴加抗荧光淬灭封片剂封片,荧光显微镜下观察并拍照。
1.2.4 免疫荧光检测各组小鼠凋亡相关蛋白Bcl-2、Bax 变化 将之前制备好的石蜡切片置于烘箱中(65 ℃)烘片2 h,脱蜡至水,PBS 洗3 次,并在组织周围用免疫组化笔画圈。以PBS 配置成的0.5% TritonX-100 对 组 织 行 破 膜 处 理10 min 后,PBS 缓 冲 液润洗3 次,每次5 min;滴加5%羊血清在室温下封闭60 min;轻甩干玻片上的封闭液后,于脊髓组织上滴加50 μL 的目标一抗(Bcl-2、Bax,1∶50),放入避光湿盒中于4 ℃冰箱中过夜;第二日取出湿盒中组织切片,PBS 缓冲液洗净后,滴加浓度为1∶50 的荧光二抗(FITC 标记的羊抗兔IgG)后,再次放入避光湿盒中,于37 ℃培养箱中静置1 h;PBS 缓冲液润洗3 次,每次5 min,将DAPI 染核试剂滴加到组织上,孵育10 min;倾去切片上多余的DAPI 染液,取适量抗荧光淬灭剂滴加于组织上并覆盖,封片后荧光显微镜下观察。
1.2.5 Western Blot 检测各组小鼠脊髓组织TLR4、NF-κBp65、MyD88 蛋白 将分离出的脊髓腰膨大组织用PBS 缓冲液反复清洗2~3 次,清洗后去除血污并将组织剪碎放置在匀浆器中,加用RIPA 裂解液并将总蛋白进行提取,提取蛋白的浓度均采用BCA 浓度测定试剂盒完成,经SDS-PAGE 电泳,于80 V 电泳30 min 后(当蛋白行至分离胶,并可见marker 清楚分层),切换电压至120 V 电泳2 h,配置转膜液Trans buffer,将转好的膜放置TBST 润洗5 min×3 次,5%脱脂奶粉封闭1 h 以结合PVDF膜上无关的蛋白反应位点,TBST 润洗5 min×3 次,采用牛血清白蛋白配置的一抗稀释液,孵一抗,于4 ℃恒温中孵育过夜,回收抗体,TBST 反复冲洗3 次,5 min/次,冲洗后加入已稀释的二抗,室温条件下孵育30 min,最后用化学发光底物A 液与B 液1∶1 混合后孵育PVDF 膜并曝光,据不同光强度而调整对应的曝光条件进行显相和定影,扫描胶片并存档后应用Alpha Ease FC 软件处理系统对目标带相应的光密度值进行分析,该结果即蛋白表达水平。
1.3 统计学处理
应用SPSS20.0 统计学分析软件对实验相关数据进行分析。计量资料使用均数加减标准差(±s)表示。组间比较均采用ANOVA 单因素方差分析,两两比较应用LSD-t检验。P<0.05 即具有统计学意义。
2 结果
2.1 姜黄素对EAE小鼠脊髓组织病理变化的影响
光镜下观察,空白组小鼠脊髓组织形态正常,EAE 组小鼠发病高峰期可见脊髓组织内大量小血管充血,血管周围可见炎症细胞浸润,典型者可围绕在小血管周围形成“袖套”样改变。姜黄素组炎性细胞减少,袖套样现象少见,炎性细胞浸润减少。见图1。
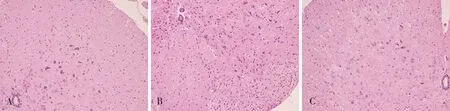
图1 各组小鼠脊髓组织切片病理观察(HE 染色,×200)Fig 1 Pathological changes of HE staining in diffirent groups(HE staining,×200)
2.2 姜黄素对小鼠细胞凋亡的影响
荧光显微镜下,空白组小鼠被TUNEL 染色后荧光标记的凋亡细胞数量少,Merge 图中DAPI 染色细胞与凋亡细胞重合少;与空白组比较,EAE 组小鼠被荧光标记的凋亡细胞数明显增多,Merge 图中DAPI 染色细胞与凋亡细胞重合增多;与EAE 组比较,姜黄组小鼠凋亡细胞减少,Merge 图中DAPI 染色细胞与凋亡细胞重合较EAE 组减少。见图2。
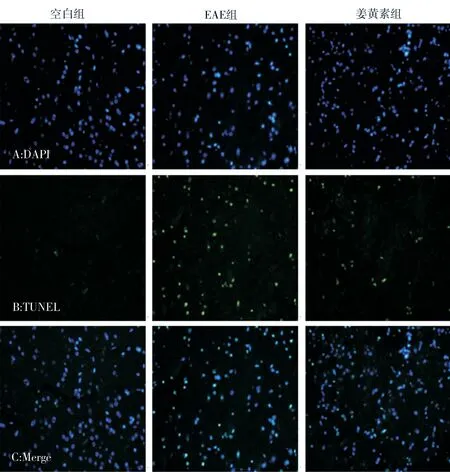
图2 各组小鼠发病高峰期时脊髓组织(TUNEL 染色,×400)Fig 2 TUNEL staining in diffirent groups at the peak period(Tunel staining,×400)
与空白组比较,EAE 组和姜黄素组小鼠经TUNEL 染色的凋亡细胞均明显增多。差异具有统计学意义(P<0.01)。说明在实验性自身免疫性脑脊髓炎发病过程中存在细胞凋亡现象。与EAE 组比较,姜黄素组凋亡细胞数低,说明姜黄素有减少EAE 小鼠脊髓细胞凋亡的作用。见表1。
表1 各组小鼠脊髓细胞凋亡细胞数的比较(±s)Tab 1 Comparison of positive cell rate of spinal cord neurons in each group

表1 各组小鼠脊髓细胞凋亡细胞数的比较(±s)Tab 1 Comparison of positive cell rate of spinal cord neurons in each group
注:与空白组比较,aP <0.01;与EAE 组比较,bP<0.05。
凋亡细胞的数量(个/视野)4.63±3.22 39.22±3.13a 19.47±3.64ab 67.28<0.01组别空白组EAE 组姜黄素组n555 FP
2.3 姜黄素对EAE 小鼠凋亡相关蛋白的影响
免疫荧光双标法荧光显微镜下,与空白组相比,EAE 组凋亡相关蛋白Bcl-2 的表达下降,Bax 的表达上升,初步推断EAE 小鼠发病高峰期存在着明显的细胞凋亡现象;与EAE 组相比,姜黄素组荧光显微镜下显示凋亡相关蛋白Bcl-2 的表达上升,Bax 的表达下降,因此姜黄素可抑制凋亡蛋白产生,对EAE 小鼠起抗凋亡作用。见图3。
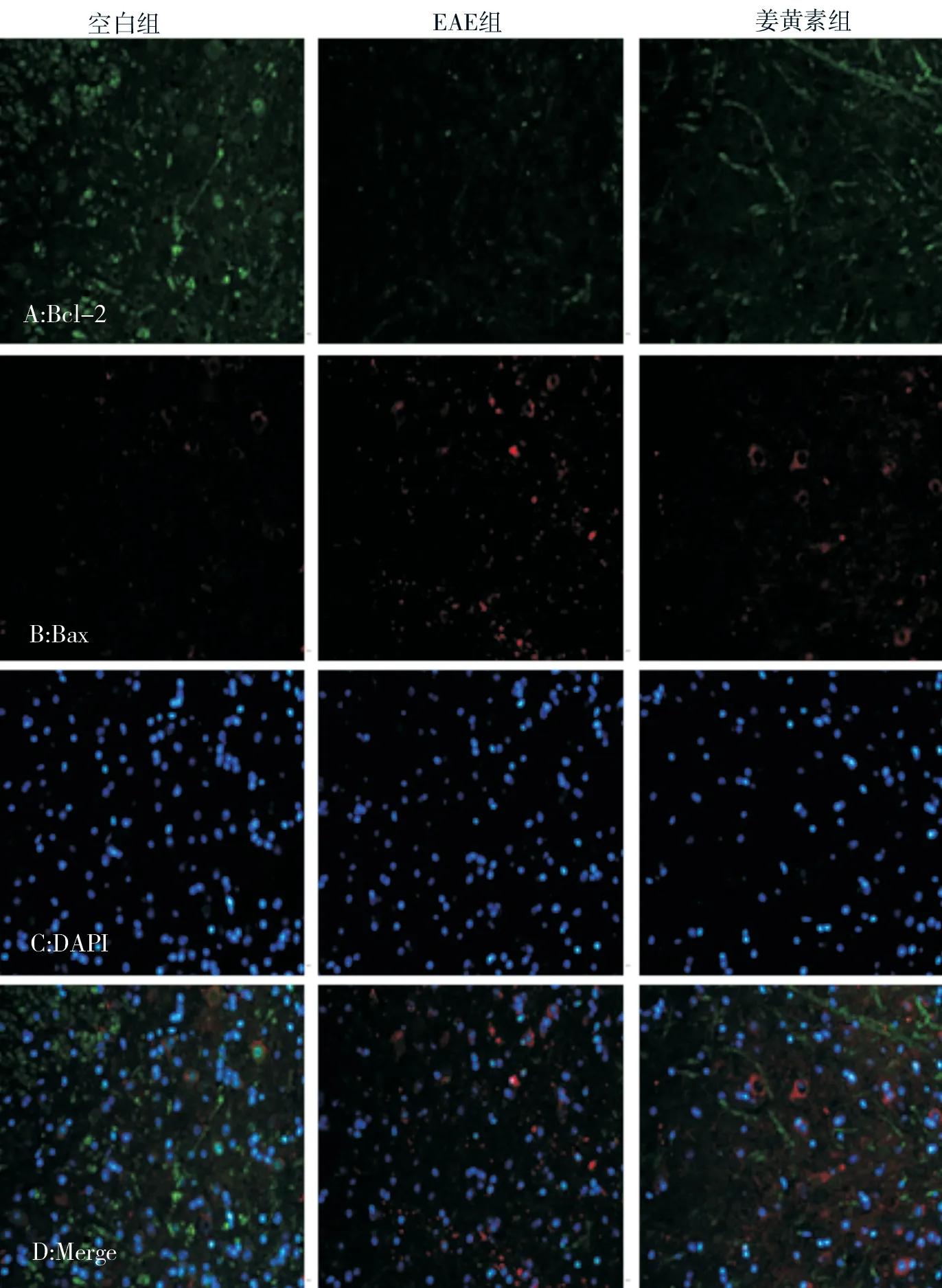
图3 免疫荧光双标法荧光显微镜下各组小鼠脊髓组织中Bcl-2 与Bax 表达情况(×400)Fig 3 Expression of Bcl-2 and Bax in spinal cord tissue of mice in each group under fluorescence microscope with double immunofluorescence method(×400)
2.4 姜 黄 素 对EAE 小 鼠TLRs/NF- κ B 信 号通路的影响
与空白组比较,EAE 组小鼠脊髓组织中TLR4、NF- κ Bp65、MyD88 蛋 白 水 平 升 高。差 异 具 有 统 计 学 意 义(P<0.05);EAE 组 小鼠与姜黄素组小鼠相比,姜黄素组小鼠脊髓 组 织 中TLR4、NF- κ Bp65、MyD88 蛋 白 水平降低,差异具有统计学意义(P<0.05)。见图4 和图5。
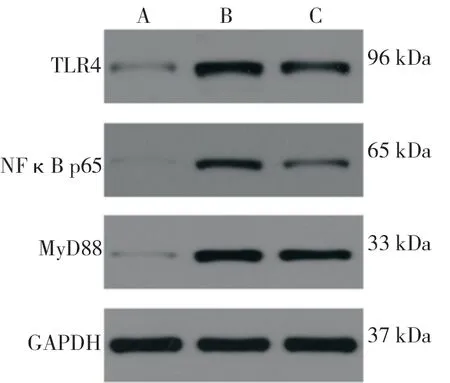
图4 各组小鼠脊髓组织中TLR4、NF-κBp65、MyD88蛋白条带Fig 4 Bands of TLR4,NF-κBp65,and MyD88 protein in spinal cord tissue of mice in each group

图5 各组小鼠脊髓组织中TLR4、NF-κBp65、MyD88 蛋白表达水平比较Fig 5 Comparison of TLR4,NF-κBp65,and MyD88 protein levels in spinal cord of mice in each group
3 讨论
MS 的发病及病理改变十分复杂,因此临床上具有发病症状多、发病时间长等特点,典型的病理改变包括中枢神经系统炎性细胞浸润、白质脱髓鞘、轴突破坏等,既往研究认为MS 患者中枢神经系统损伤的形成多由T 淋巴细胞介导下的慢性脱髓鞘改变引起,但通过MS 患者尸检证实,细胞凋亡是最早出现的病理改变之一,新病灶的出现先伴随细胞凋亡,随后再出现T、B 淋巴细胞浸润、髓鞘断裂、髓鞘崩解、轴突损害等特征性的病理组织学改变[9,10]。在EAE模型中,TLRs/NF-κB 信号通路是启动炎症调控、细胞凋亡的重要信号通路。TLRs 先与特异性配体识别并与MD2 和CD14 结合,使白介素受体相关激酶-1 与髓样分化因子88 连接和磷酸化。MyD88 作为TLRs 信号通路中重要的衔接蛋白,被磷酸化后将信号有序传导致下游通路,激活下游的NF-κB,使机体出现相应变化,最终启动自身免疫反应[11]。细胞凋亡是机体的一种程序性死亡,与线粒体功能紊乱相关,线粒体细胞膜损伤导致细胞色素C 释放,钙离子内流,ATP 生成障碍,导致凋亡发生[12]。而NF-κB 可激活Bax 蛋白,因此NF-κB 对细胞凋亡具有重要调节作用[13]。而在细胞凋亡级联反应中,Bcl-2 和Bax是最具代表性的凋亡相关基因。Bcl-2 是重要的抑制细胞凋亡调节因子,它通过抑制线粒体释放细胞色素C 等物质抑制凋亡发生[14]。与Bcl-2 相反,Bax 作为Bcl-2 家族成员具有促进凋亡的作用。Bax 激活后可以使下游的效应元件caspase 家族对毗邻的天冬氨酸依次有序的切割活化,促进细胞色素C 的释放,启动细胞凋亡[15],NF-κB 在体内有RelA(p65)、RelB、cRel(Rel)、p50 和p52 五种形式,这些具有共同的N-末端和DNA 结合域/二聚体域的转录因子一般情况下以同源和异源二聚体存在于胞浆内,NF-κB 激活后 诱 导IκB 基 因 磷 酸 化,IκB 基 因 磷 酸 化 后 失 去 对NF-κB 的抑制作用,NF-κB 遂从胞浆向细胞核内转位,与上述二聚体结合,激活下游凋亡蛋白的转录,产生细胞凋亡现象[16-18]。随着大家对凋亡认识的逐渐深入,凋亡已被证实与多种系统疾病相关,包括结缔组织病、动脉粥样硬化、帕金森病、阿尔茨海默病等多种炎症性疾病和退行性疾病的动物模型中,细胞凋亡均被证实与病因相关。
在脓毒血症、糖尿病、肿瘤等动物模型及细胞分子研究中,使用姜黄素干预后,细胞凋亡现象均受到抑制。Zhang 等[19]的多项研究表明,姜黄素可以阻断TLRs/NF-κB 通路的转导。推测姜黄素是通过抑制TLRs/NF-κB 信号通路的传导,使Bax 蛋白转录减少,Bcl-2 蛋白转录增多,抑制细胞凋亡,减轻神经元损伤,从而起保护作用。为验证推测,笔者做了以上相关研究。
本研究结果显示,TUNEL 染色中,与空白组比较,EAE 组和姜黄素组小鼠经TUNEL 染色的凋亡细胞均明显增多,说明在实验性自身免疫性脑脊髓炎发病过程中存在细胞凋亡现象。与EAE 组比较,姜黄素组凋亡阳性细胞数少,说明姜黄素有减少EAE 小鼠脊髓神经元细胞凋亡的作用。本研究对TLRs/NF-κB 信号通路中的相关蛋白及凋亡相关蛋白进行检测,结果显示姜黄素组中TLR4、NFκBp65、MyD88 条带光密度值低于EAE 组,荧光显微镜下与EAE 组相比凋亡相关蛋白Bcl-2 的表达增加,Bax 的表达减少;EAE 组TLR4、NF-κBp65、MyD88条带光密度值高于空白组及姜黄素组,荧光显微镜下凋亡相关蛋白Bcl-2 的数量低于空白组及姜黄素组,Bax 的数量高于空白组及姜黄素组;空白组TLR4、NF-κBp65、MyD88 条带光密度值低于EAE组及姜黄素组。由此可以得出姜黄素通过抑制TLRs/NF-κB 信号通路的传导,抑制细胞凋亡,减少凋亡对脊髓神经细胞的损伤破坏,减轻神经变性,从而对EAE 小鼠脊髓神经细胞起保护作用。
本实验探讨了TLRs/NF-κB 信号通路与凋亡的关系,而TLRs/NF-κB 信号通路同时还是调控炎症反应的重要通路,在MS 的发病机制中是否存在凋亡与炎症细胞因子共同作用引起神经细胞破坏,还需要更进一步的研究证明。
作者贡献度说明:
刘梦兰:实验设计、实施、执笔;谢阳:实验实施;曾春蓉:实验评估;李作孝:实验设计和审校。

