不同水稻品种幼苗响应碱胁迫的生理差异及胁迫等级构建
路旭平,李芳兰,石亚飞,张娟伟,杨文伟,罗成科,田蕾,李培富
宁夏大学农学院/宁夏优势特色作物现代分子育种重点实验室,宁夏 银川 750021
土壤盐碱化是导致耕地面积减少的重要原因之一,对农业的可持续发展产生了负面的影响。据报道,中国盐碱地主要分布在东北松嫩平原、黄淮海平原、西北干旱半干旱区和滨海等地(Wang et al.,2017;罗成科等,2019);面积达0.99亿公顷,约占全世界盐碱地面积的10.3%,且呈逐年增加的趋势(冷春旭等,2020)。水稻(Oryza sativa L.)是中国三大粮食作物之一,中国超过60%的人口以稻米作为主粮(姚栋萍等,2019)。水稻属中等盐敏感的作物(Flowers et al.,2008),利用种植水稻来改良盐碱地,可以使土壤表层的盐分逐渐下沉,改良土壤结构(冷春旭等,2020);并且水稻根系具有分泌有机酸和吸收环境中盐分的作用,可以中和碱胁迫引起的高pH并改善土壤板结情况,使土壤结构变得疏松,提高土壤蓄水能力(梁银培等,2017)。因此,合理有效地开发和利用盐碱地,对保障国家的粮食安全具有重要意义。
研究表明,土壤盐碱化包括两种不同的类型,即中性盐(NaCl和 Na2SO4)和碱性盐(NaHCO3和 Na2CO3)引起的两种不同类型的盐胁迫,植物对此有不同的响应和耐盐机制(Guo et al.,2020)。由中性盐引起的胁迫称为盐胁迫,对植物的主要伤害是由渗透胁迫和离子毒害引起的(刘建新等,2020);由碱性盐引起的胁迫称为碱胁迫,主要是由于高pH值使土壤中营养元素固化,严重干扰植物根系对矿质营养的吸收,导致植物体内营养失衡,新陈代谢紊乱,破坏离子平衡;同时碱胁迫具有与盐胁迫相同的渗透胁迫和离子毒害(Guo et al.,2017;Zhang et al.,2017)。
植物遭受碱胁迫时,由于具有较高pH值,使植物遭受盐分和高pH值双重损伤,碱胁迫对植物造成的伤害远大于盐胁迫(徐宁等,2017)。高pH会严重阻碍植物对水和营养物质的吸收,造成渗透胁迫;干扰植物细胞内的电荷平衡和pH内稳态,诱导细胞产生活性氧,降低膜脂透性,破坏细胞结构完整性,导致生理代谢紊乱,抑制植物生长发育(穆阳杰等,2020)。国内外有关水稻耐盐碱研究主要集中在盐胁迫(黄洁等,2020),对碱胁迫下水稻体内反应机理和调节机制的研究较少(赵怀玉等,2020),关于碱胁迫对水稻幼苗生理生化特性的影响缺乏系统性的研究,依据生理生化指标计算胁迫指数并确定胁迫等级的方法更为少见。因此本研究以碱敏感水稻品种和耐碱品种为供试材料,在水稻苗期进行碱胁迫处理,通过比较分析供试水稻的叶绿素含量、活性氧代谢、渗透调节物质积累和抗氧化防御等生理指标,进一步明确不同水稻品种在碱胁迫下的生长和生理差异,并根据生理指标划分水稻苗期碱胁迫等级,以期为“以稻治碱”和水稻耐碱机理提供依据。
1 材料与方法
1.1 试验材料
供试材料为2个不同耐碱性的水稻品种,即碱敏感品种“中花 11”(ZH11)和耐碱品种“宁粳52”(NG52),供试水稻种子由宁夏大学宁夏优势特色作物现代分子育种重点实验室提供。
1.2 试验设计
选取大小一致、籽粒饱满的水稻种子,蒸馏水浸泡1 h,75%的乙醇浸泡15 s,15%的NaClO消毒30 min,蒸馏水润洗6次后用滤纸吸干水分。将消毒后的水稻种子置于长×宽×高为100 cm×50 cm×10 cm,共 32孔的育苗盘中,放置于人工气候箱(HP1000GS)中进行培养,培养条件为16 h/8 h(光照/黑暗),温度28 ℃/25 ℃(白天/夜间)。种子萌发4 d后,选取长势一致幼苗转移到剪去管底的96孔PCR板上,每板48株,将转移到PCR板上各材料置于长×宽×高为21 cm×15 cm×5.2 cm水培盒中进行培养。水稻移栽2 d后加入1/2国际水稻所(IRRI)水稻专用营养液,5 d 后加入全营养液,以后每隔3 d更换700 mL水稻营养液,国际水稻所水稻专用营养液配方的质量浓度为(mg·L−1):NH4NO3114.3、NaH2PO4·2H2O 50.4、K2SO489.3、CaCl2110.8、MgSO4·7H2O 405、NaSiO3·9H2O 568、MnCl2·4H2O 1.8 、 Na2MoO4·2H2O 0.126、H3BO41.145、ZnSO4·7H2O 0.044、CuSO4·5H2O 0.039、FeSO4·7H2O 9.93。幼苗生长至第28天进行碱胁迫处理。
试验选用两种碱性盐(NaHCO3和Na2CO3)混合设置 3个碱水平:10、20、30 mmol·L−1;每组处理下,将两种碱性盐(NaHCO3、Na2CO3)按照不同物质的量比例分别(9∶1、5∶5、1∶9)混合,形成 3个pH环境:pH 8.65、pH 9.55和pH 10.50,依次记为A、B、C处理;共模拟出9种碱胁迫环境(表1),其中10A、10B、10C处理相当于轻度碱化土,20A、20B、30A处理相当于中度碱化土,20C、30B、30C处理相当于重度碱化土(杨佳佳等,2011)。处理液为700 mL含NaHCO3和Na2CO3的营养液,以仅含营养液的处理为对照,每个处理3次重复,连续胁迫处理3 d后采集样品测定各项指标。
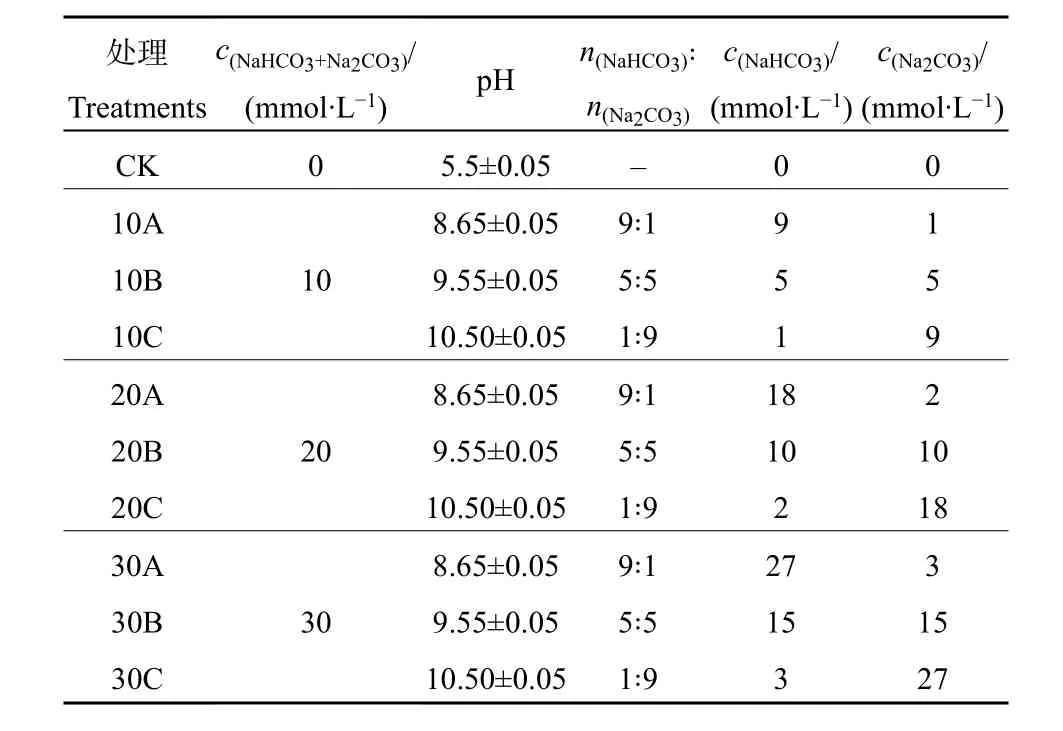
表1 各处理碱组成和pHTable 1 Alkali composition and pH of each treatment
1.3 测定项目与方法
1.3.1 生长指标的测定
叶片相对含水量(RWC):取处理3 d后的幼苗叶片,称量其鲜重(mf)并记录,叶片浸泡于蒸馏水中过夜,吸干表面水分后称量其饱和重(mt),将饱和叶片放入烘箱中105 ℃处理15 min,75 ℃烘干至恒重,称量其干重(md),计算叶片相对含水量:w(RWC)=(mf−md)/(mt−md)×100%
1.3.2 生理指标的测定
叶绿素含量的测定采用乙醇提取法(罗姗姗等,2019),计算叶绿素 a含量(chlorophyll a,Chla)、叶绿素b含量(chlorophyll b,Chlb)、总叶绿素含量(chlorophyll,Chl)和叶绿素 a/b(chlorophyll a/b,Chla/b);
游离脯氨酸(proline,Pro)含量采用酸性茚三酮比色法测定(邹琦,2000);采用苯酚法测定可溶性糖含量(soluble sugar,SS)(邹琦,2000);可溶性蛋白(soluble protein,SP)含量采用考马斯亮蓝G-250染色法(邹琦,2000)。
丙二醛(malondialdehyde,MDA)含量采用硫代巴比妥酸法测定(Zhang et al.,2017);脂氧合酶(lipoxygenase,LOX)活性的测定参考Huang et al.(2010)的方法;超氧阴离子(O2·-)产生速率采用对氨基苯磺酸法测定(Zhang et al.,2017);H2O2含量采用碘化钾法测定(Zhang et al.,2017)。
粗酶液的制备参考Niu et al.(2017)的方法,超氧化物歧化酶(superoxide dismutase,SOD)采用氮蓝四唑显色法测定(Niu et al.,2017);过氧化氢酶(catalase,CAT)活性采用紫外比色法测定(Niu et al.,2017);过氧化物酶(peroxidase,POD)活性采用愈创木酚法测定(Wang et al.,2013)。
还原型抗坏血酸(ascorbic acid,ASA)和还原型谷胱甘肽(reduced glutathione,GSH)测定参照Wang et al.(2013)的方法。
1.4 数据统计与分析
运用Microsoft Excel 2016软件整理数据,SPSS 24.0软件进行统计分析和主成分分析,差异显著性定义为 P<0.05,用平均值±标准误(±SE)表示 3次重复测定结果;运用GraphPad Prism 8作图。
2 结果与分析
2.1 碱胁迫对水稻叶片叶绿素含量的影响
由图1A可知,碱水平和pH均显著影响ZH11的叶绿素a含量(P<0.001),且碱水平和pH对叶绿素 a含量具有显著的交互作用(P=0.015),在30C处理时叶绿素a含量最低,较对照(CK)降低82.12%。NG52的叶绿素a含量的主效应分别受碱水平和 pH影响,但碱水平和 pH的交互作用对NG52的叶绿素a含量无显著影响(P=0.289),叶绿素a含量在30C处理下较CK下降61.56%。对比各处理下的两种材料发现,在CK时ZH11和NG52叶绿素 a含量差异不显著,但在 10A、10B、10C和30C处理时存在显著差异(P<0.05)。
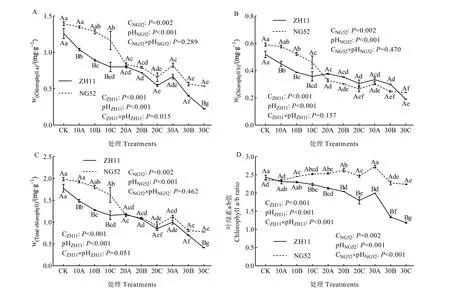
图1 碱胁迫对水稻叶片叶绿素含量的影响Fig. 1 Effects of alkali stress on chlorophyll contents of rice leaves
由图1B可得,碱水平和pH对ZH11的叶绿素b含量的主效应具有显著影响(P<0.001,P<0.001),但碱水平和pH的交互作用对ZH11的叶绿素b含量无显著影响(P=0.157)。碱水平和pH对NG52的叶绿素b含量的主效应具有显著影响(P=0.002,P<0.001),但碱水平和pH的交互作用对NG52的叶绿素 b含量无显著影响(P=0.470)。ZH11和NG52的叶绿素b含量在30C处理时下降至最低点,分别较CK降低63.29%和59.50%。比较两种材料叶绿素b含量可得,在10A、10B和10C处理时,NG52叶绿素b含量显著高于ZH11(P<0.05),而在其他处理时无显著差异。
由图1C可知,碱水平和pH对ZH11的总叶绿素含量的主效应具有显著影响(P<0.001),但碱水平和pH的交互作用对ZH11的总叶绿素含量无显著影响(P=0.051)。碱水平和pH对NG52的总叶绿素含量的主效应具有显著影响(P=0.002,P<0.001),但碱水平和pH的交互作用对NG52的总叶绿素含量无显著影响(P=0.462)。ZH11和NG52的总叶绿素在30C处理时降至最低点,降幅分别为76.63%和60.94%。对比两种材料在各处理下的叶绿素含量发现,在CK处理下,ZH11和NG52叶绿素含量差异不显著;但在 10A、10B、10C和30C处理时,NG52叶绿素含量显著大于 ZH11(P<0.05)。
分析图1D可得,ZH11的叶绿素a/b的主效应受碱水平和pH显著影响(P<0.001),碱水平和pH对叶绿素a/b具有显著的交互作用(P<0.001)。碱水平和pH对NG52的叶绿素a/b的主效应具有显著影响(P=0.002,P=0.001),碱水平和 pH的交互作用对 NG52的叶绿素 a/b具有显著影响(P<0.001)。ZH11和NG52的叶绿素a/b在30C处理较CK分别降低51.30%和5.07%;在30A处理时,NG52叶绿素a/b显著增加(P<0.05),较CK增加15.43%。对比两种材料发现,在CK时ZH11和NG52叶绿素a/b无显著差异,但从10C至30C处理时,NG52叶绿素a/b显著大于ZH11(P<0.05)。
综合分析图1A、C、D发现,在30A处理下ZH11和NG52的叶绿素a含量、总叶绿素含量和叶绿素 a/b较20C处理均有增加,说明当碱水平大于20 mmol·L−1时,低碱水平和高pH的交互作用对水稻叶绿素的影响大于高碱水平低 pH的交互作用。
2.2 碱胁迫对水稻叶片相对含水量和渗透调节物质含量的影响
由图2A可知,碱水平和pH对ZH11和NG52叶片相对含水量的主效应均具有显著的影响,且碱水平和pH的交互作用对ZH11和NG52叶片相对含水量具有显著影响(P=0.001,P=0.004)。ZH11和NG52叶片相对含水量在30C处理较CK分别降低了41.18%和29.53%。分析两种材料叶片相对含水量发现,在CK时ZH11和NG52叶片相对含水量无显著差异,但随着胁迫程度的增加,在30A、30B和30C处理时,NG52叶片相对含水量显著大于ZH11(P<0.05)。

图2 碱胁迫对水稻叶片相对含水量和渗透调节物质的影响Fig. 2 Effects of alkali stress on relative water content and osmotic adjustment substances of rice leaves
分析图2B可知,碱水平和pH对ZH11和NG52的Pro含量主效应均具有显著的影响(P<0.001)。碱水平和pH的交互作用对ZH11的Pro含量具有显著影响(P=0.004),对NG52的Pro含量无显著影响(P=0.695)。ZH11和NG52的Pro含量在30C处理时达到最大值,分别较 CK增加 326.83%和368.99%。比较两种材料在各处理下的 Pro含量可得,在CK时ZH11和NG52的Pro含量差异不显著;在10B、10C、20A、20B和30C处理时,NG52的Pro含量显著高于ZH11(P<0.05)。
由图2C可得,碱水平和pH对ZH11和NG52的SS含量主效应均具有显著的影响(P<0.001),且碱水平和pH的交互作用对ZH11和NG52的SS含量具有显著影响(P<0.001)。ZH11和NG52的SS含量在30C处理时达到最大值,分别较CK增加49.49%和77.40%。比较各处理下两种材料的SS含量发现,在CK时ZH11的SS含量显著大于NG52(P<0.05),但随着胁迫程度的增加,NG52的 SS含量的增幅逐渐大于ZH11,其中在10C、30A、30B和30C处理时显著大于ZH11(P<0.05)。
分析图2D可得,碱水平和pH对ZH11和NG52的SP含量主效应均具有显著的影响(P<0.001)。碱水平和pH的交互作用对ZH11和NG52的SP含量具有显著影响(P=0.001,P=0.007),ZH11和NG52的SP含量在30C处理时达到最大值,分别较CK增加54.67%和129.00%。对比各处理下两种材料的SP含量发现,在CK时ZH11的SP含量是NG52的1.60倍,但在30C处理时ZH11的SP含量是NG52的1.08倍。
综合分析图2A、B、C、D发现,ZH11和NG52的相对含水量在30A处理下较20C处理均有增加,SS含量在 30A处理下较 20C处理显著降低(P<0.05),Pro和SP含量30A处理与20C处理相比无显著差异。
2.3 碱胁迫对水稻叶片脂质过氧化和活性氧含量的影响
分析图3A可得,碱水平和pH均显著影响ZH11和NG52的MDA含量(P<0.001),且两者的交互作用也显著影响 ZH11和 NG52的 MDA含量(P=0.014,P=0.047)。ZH11和NG52的MDA含量在 30C处理时升高至最大值,较 CK分别增加86.32%和50.02%。对比各处理下两种材料的MDA含量发现,在CK时,ZH11和NG52 MDA含量差异不显著;但随着胁迫程度的增加,ZH11 MDA含量均大于NG52,除20B和30A处理外,其余各处理ZH11 MDA含量均显著高于NG52(P<0.05)。

图3 碱胁迫对水稻叶片脂质过氧化和活性氧含量的影响Fig. 3 Effects of alkali stress on lipid peroxidation and reactive oxygen species of rice leaves
由图3B可知,碱水平和pH均显著影响ZH11和NG52的LOX活性(P<0.001),但两者的交互作用未显著影响 ZH11和 NG52的 LOX活性(P=0.775,P=0.144)。ZH11和NG52的LOX活性在30C处理时增幅分别为277.92%和191.55%。分析两种材料在各处理下的LOX活性发现,ZH11和NG52 LOX活性在CK时差异不显著;但随着胁迫程度的增加,从10B—30C处理ZH11 LOX活性均显著大于NG52(P<0.05)。
分析图3C可得,碱水平和pH均显著影响ZH11和NG52的O2·-产生速率(P<0.001),且两者的交互作用对 ZH11和 NG52的 O2·-产生速率具有显著影响(P=0.004,P=0.007)。ZH11和NG52的O2·-产生速率在30C处理时升高至最大值,增幅分别为161.70%和130.39%。比较各处理下两种材料的O2·-产生速率发现,在整个胁迫期间,ZH11的O2·-产生速率均显著高于NG52(P<0.05)。
由图3D可得,碱水平和pH均显著影响ZH11和NG52的H2O2含量(P<0.001),且两者的交互作用对ZH11和 NG52的 H2O2含量具有显著影响(P=0.001,P<0.001)。ZH11和NG52的H2O2含量在30C处理时升高至最大,增幅分别为291.40%和124.06%。分析各处理下两种材料的H2O2含量发现,ZH11和NG52的H2O2含量在CK时差异不显著;但随着胁迫程度的增加,从10C到30C处理ZH11的H2O2含量均显著大于NG52(P<0.05)。
综合分析图3A、B、C、D发现,ZH11和NG52的O2·-产生速率和H2O2含量以及ZH11的MDA含量和LOX活性在30A处理下较20C处理显著降低(P<0.05),NG52的MDA含量和LOX活性在30A处理与20C处理相比无显著差异。
2.4 碱胁迫对水稻叶片抗氧化酶活性的影响
由图4A可知,碱水平和pH均显著影响ZH11和NG52的SOD活性(P<0.001),两者的交互作用对NG52的SOD活性具有显著影响(P=0.001),对ZH11的SOD活性无显著影响(P=0.081)。ZH11和 NG52的 SOD活性在 30C处理下增幅分别为99.71%和 145.61%。分析两种材料在各处理下的SOD活性发现,在CK时ZH11的SOD活性显著大于 NG52(P<0.05),但随着胁迫程度的增加,NG52的SOD活性的增幅逐渐大于ZH11,其中在20C、30B和30C处理时显著大于ZH11(P<0.05)。

图4 碱胁迫对水稻叶片抗氧化酶活性的影响Fig. 4 Effects of alkali stress on antioxidant enzyme activities of rice leaves
分析图4B可知,碱水平和pH对ZH11和NG52的 POD活性的主效应均产生显著影响,两者的交互作用对ZH11和NG52的POD活性无显著影响(P=0.281,P=0.305)。ZH11和NG52的在30C处理时较CK增幅最大,分别为17.60%和37.30%。比较各处理下两种材料的 POD活性得,在各个处理下,NG52的POD活性均显著大于ZH11的POD活性(P<0.05)。
由图4C可知,碱水平和pH均显著影响ZH11和NG52的CAT活性,两者的交互作用对NG52的CAT活性具有显著影响(P=0.005),对 ZH11的CAT活性无显著影响(P=0.775)。ZH11和NG52的CAT活性在30C处理时较CK增幅最大,分别较较CK增加79.25%和116.22%。分析各处理下两种材料的CAT活性发现,在CK时ZH11的CAT活性显著大于 NG52(P<0.05),随着胁迫程度的增加,ZH11和NG52的CAT活性差距逐渐减小,在20A和30A时达到无显著差异水平。
综合分析图 4A、B、C发现,ZH11和 NG52的SOD活性以及ZH11的POD活性在30A处理下较 20C处理显著降低(P<0.05),ZH11和 NG52的CAT活性以及NG52的POD活性在30A处理与20C处理相比无显著差异。
2.5 碱胁迫对水稻叶片还原型抗坏血酸(ASA)和还原型谷胱甘肽(GSH)含量的影响
分析图5A可知,碱水平和pH均显著影响ZH11和NG52的ASA含量(P<0.001),两者的交互作用对 ZH11和 NG52的 ASA含量具有显著影响(P<0.001,P<0.001)。ZH11和NG52的ASA含量在30C处理时增至最大,分别较CK增加83.33%和126.95%。比较两种材料在各个处理下ASA含量发现,在CK时ZH11的ASA含量显著大于NG52(P<0.05),随着胁迫程度的增加,ZH11和 NG52的ASA含量差距逐渐减小,从20B至30C处理时两种材料的ASA含量无显著差异。
由图5B可知,碱水平和pH均显著影响ZH11和NG52的GSH含量(P<0.001),两者的交互作用对NG52的GSH含量具有显著影响(P<0.001),对ZH11的GSH含量无显著影响(P=0.056)。ZH11和NG52的GSH含量在30C处理时增至最大,分别较CK增加32.12%和61.61%。分析各个处理下两种材料的GSH含量发现,在CK时ZH11的GSH含量显著大于NG52(P<0.05),但从10A至30C处理时 NG52的 GSH含量显著大于 ZH11(P<0.05)。
综合分析图5A、B发现,ZH11和NG52的GSH含量以及ZH11的ASA含量在30A处理下较20C处理显著降低(P<0.05),NG52的ASA含量在30A处理与20C处理相比无显著差异。
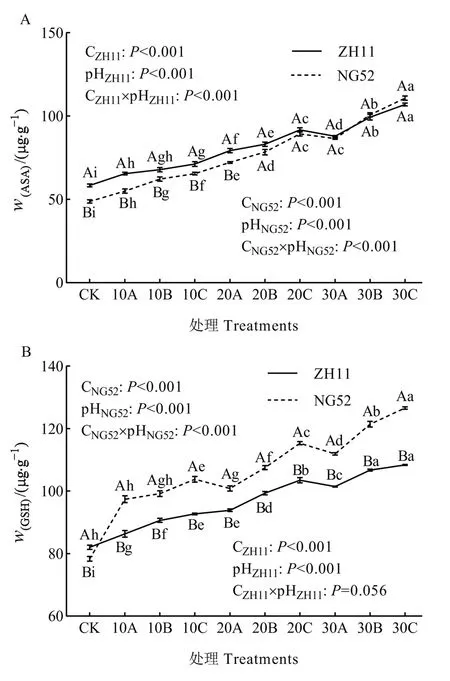
图5 碱胁迫对水稻叶片ASA和GSH含量的影响Fig. 5 Effects of alkali stress on ASA and GSH contents of rice leaves
2.6 水稻幼苗受害等级的建立
2.6.1 主成分分析及生理参数的选择
对所有生理指标进行主成分分析(表 2)。在ZH11中提取出1个主成分,特征根为15.787,累计贡献率为92.867%。在NG52中共提取出2个主成分,第1主成分主要包括Chla、Chlb、Chl、RWC、抗氧化酶、脂质过氧化、活性氧、渗透调剂物质、ASA和 GSH,特征根为 14.901,累计贡献率为87.653%。第 2主成分以 Chla/b为主,特征根为1.321,累计贡献率为95.422%。因此,两种材料提取出的主成分均可以描述所有指标,但由前文可知,许多指标反映结果相关性较高、重叠性较大,为简化计算,综合各指标得分的绝对值,在叶绿素含量、抗氧化酶、脂质过氧化、活性氧、渗透调剂物质和非酶类抗氧化物质等6类生理指标中,挑选Chla、SOD、MDA、H2O2、SS、ASA 作为受害等级划分的判定依据。
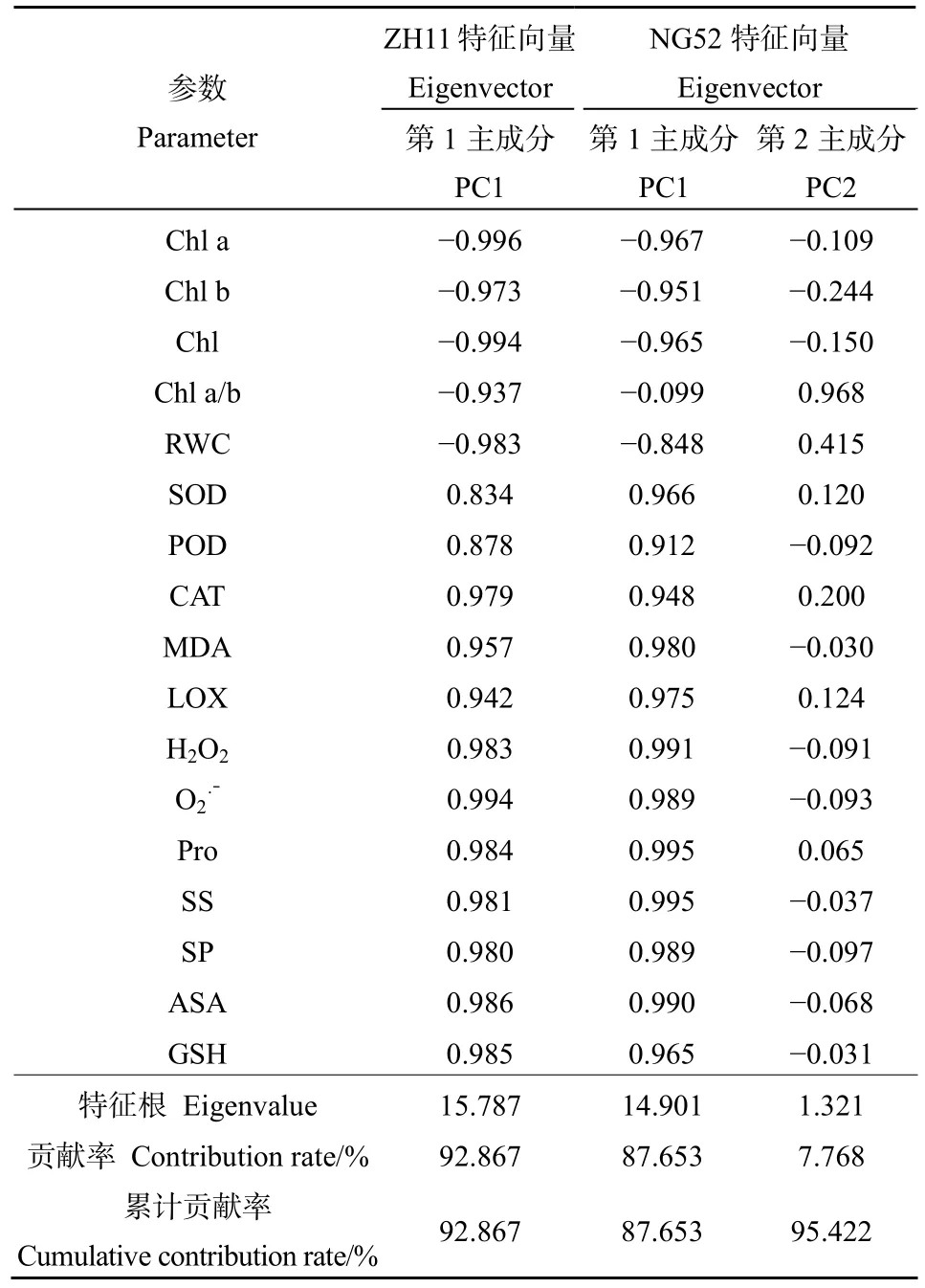
表2 两种水稻叶片生理参数的主成分分析Table 2 Principal component analysis of physiological parameter in rice leaves
2.6.2 已选生理参数权重的确定和受害等级构建
将Chl a、SOD、MDA、H2O2、SS、ASA等6个指标进行极值标准化,然后用熵权法求得各指标权重如表3所示。

表3 Chla、SOD、MDA、H2O2、SS和ASA的权重Table 3 Weight coefficient of Chla, SOD, MDA, H2O2, SS and ASA
参考徐超等(2021)的方法引入碱胁迫指数Z,公式如下:
Z=(ZA×|ACK−A|/ACK+ZB×|BCK−B|/BCK+ZC×|CCK−
C|/CCK+ZD×|DCK−D|/DCK+ZE×|ECK−E|/ECK+ZF×|
FCK−F|/FCK)×10
式中:
Z——碱胁迫指数;
ZA、ZB、ZC、ZD、ZE、ZF——Chl a、SOD、MDA、H2O2、SS、ASA的权重;
ACK、BCK、CCK、DCK、ECK、FCK——对照下Chl a、SOD、MDA、H2O2、SS、ASA的值;
A、B、C、D、E、F——分别碱胁迫下Chl a、SOD、MDA、H2O2、SS、ASA的值。
根据上述公式计算出碱胁迫指数变化规律如图6所示,水稻正常生长时,其碱胁迫指数为0。随着碱水平和pH的增加,碱胁迫程度逐渐加重。根据Z值的变化规律,把水稻受害等级划分为正常、轻度、中度、重度和特重度 5个胁迫等级。即当0≤Z<1为正常水平,当1≤Z<4为轻度胁迫,当4≤Z<7为中度胁迫,当7≤Z<10为重度胁迫,当10≤Z为特重度胁迫。
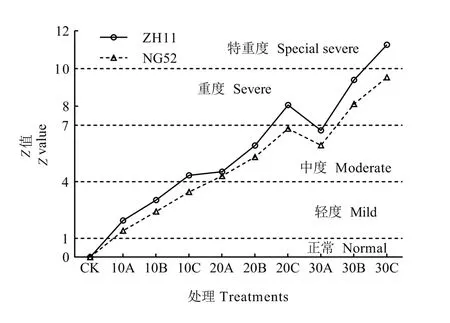
图6 水稻受害等级的划分Fig. 6 Classification of injury grades in Rice
根据上述划分的等级得出各个处理所对应的碱胁迫等级(表4)。对ZH11来说,10A和10B处理为轻度胁迫,10C、20A、20B和 30A处理为中度胁迫,20C和30B处理为重度胁迫,30C处理为特重度胁迫。对NG52来说,10A、10B和10C处理为轻度胁迫,20A、20B、20C和 30A处理为中度胁迫,30B和30C处理为重度胁迫,无特重度胁迫。

表4 碱胁迫指数在不同处理下的变化规律Table 4 Changes of alkali stress index with different treatments
3 讨论
3.1 不同水稻品种幼苗响应碱胁迫的生理差异
盐碱胁迫引起的渗透胁迫不仅影响叶绿素的合成,同时也加速已合成叶绿素的降解(Huang et al.,2019)。盐碱胁迫引起的高 pH,破坏了离子稳态,使与叶绿素合成有关离子如Fe2+、Mg2+、Cu2+等沉淀,进而打破了叶绿素合成与分解的动态平衡,导致叶绿素含量降低(高立杨等,2020)。叶绿素含量是体现植物光合速率的重要生理参数(Izadi-Darbandi et al.,2018)。在本研究中,碱胁迫减少了Chl a、Chl b和Chl的含量,并且随着胁迫程度的增加而显著降低,这可能是因为碱胁迫降低了叶绿素合成酶的活性,或是破坏了叶绿素的结构使其降解,这与贾旭梅(2019)和 Huang et al.(2019)的研究结果一致。此外,在碱敏感品种“中花11”中,Chl a/b在胁迫期间整体上呈现下降趋势;而耐碱品种“宁粳52”的Chl a/b呈现先升高后降低的趋势,这可能是因为在胁迫初期,碱胁迫引起的Chl b含量的下降程度高于Chl a,即Chl a/b的比值增加,随着胁迫程度的增加,Chl a/b的比值开始降低,可能是不同耐碱材料响应碱胁迫的不同生理策略,这与贾婷婷等(2018)在盐胁迫下沙枣(Elaeagnus angustifolia)中Chl a/b的变化趋势相同。在本研究中,Chl a和Chl含量以及Chl a/b的比值在30A处理下较20C处理有显著升高,且在随后的处理下又开始降低,说明20C处理的胁迫程度大于30A处理,即20C处理对水稻幼苗叶绿素含量的损伤大于30A处理。
相对含水量用于体现植物在不同环境条件下的含水量和渗透调节能力,相对较高的水分含量可以维持蛋白质的结构稳定(Ravikumar et al.,2014)。渗透胁迫是植物遭受盐碱胁迫时最先引发的次级盐害,积累溶质来进行渗透调节是缓解盐碱胁迫的主要途径;目前,细胞内合成的有机溶质主要有脯氨酸、可溶性糖、可溶性蛋白和甜菜碱等(Deinlein et al.,2014)。在本研究中,碱胁迫下两种水稻叶片相对含水量均有降低,脯氨酸、可溶性糖和可溶性蛋白含量均持续增加;其中“中花11”相对含水量降幅大于“宁粳52”,脯氨酸、可溶性糖和可溶性蛋白含量的增幅均小于“宁粳52”,可见,耐碱材料是通过积累较多的渗透调节物质来减缓含水量的降低,这与曹齐卫等(2015)在黄瓜(Cucumis sativus)中的研究结果类似。此外,水稻叶片相对含水量在30A处理下较20C处理显著升高,可溶性糖含量在30A处理下较20C处理有显著降低,说明30A处理对水稻含水量和渗透调节物质的影响大于20C处理。
植物在盐碱胁迫下,由于气孔关闭,叶片内CO2浓度降低,导致植物光合作用被抑制,碳同化受阻,为保持光合电子传递链的正常运行,O2被直接还原为O2·-,最终引起体内包括过氧化氢(H2O2),羟基自由基(OH-),超氧自由基(O2·-)和单线性氧(1O2)在内的活性氧(ROS)不断积累(Baxter et al.,2014;Ye et al.,2021)。大量积累的ROS可作用于细胞膜上的蛋白质和磷脂双分子层,致使膜上多聚不饱和脂肪酸(Polyunsaturated fatty acids,PUFAs)发生降解。脂氧合酶(LOX)催化膜上PUFAs的氧化反应,导致膜脂过氧化,丙二醛(MDA)是PUFAs过氧化的产物(Doderer et al.,1992)。在本研究中,MDA、LOX和H2O2含量以及O2·-产生速率均随碱胁迫程度的增加而增加,说明碱胁迫对引起的氧化损伤对水稻的生长产生了影响;碱敏感品种“中花11”MDA、LOX和H2O2含量以及O2·-产生速率增幅大于耐碱品种“宁粳52”,说明耐碱性水稻品种通过降低细胞膜脂质过氧化和产生更少的ROS来提高植株的耐碱性,这与Kumar et al.(2020)的研究结果相似。此外30A处理下的MDA、LOX和H2O2含量以及O2·-产生速率较20C处理显著降低,说明30A处理下水稻受伤害程度较轻。
植物在清除 ROS的过程中会启动由多种抗氧化酶和非酶类抗氧化剂组成的抗氧化防御系统,其中酶类的抗氧化剂被认为是清除 ROS最直接、最有效的途径(Apel et al.,2004),SOD是抵抗ROS的第一道防线。SOD 催化 2O2·-+2H+→H2O2+O2的反应,H2O2进一步被POD和CAT分解(Qin et al.,2018;钟嘉文等,2021)。抗坏血酸(ASA)是主要的抗氧化剂,可以直接淬灭ROS(Tuteja et al.,2010)。在不同的抗氧化反应,ASA供给电子并通过清除O2·-和OH-保护植物细胞膜(Hasanuzzaman et al.,2014)。谷胱甘肽(GSH)是另一种重要的抗氧化剂,可以通过谷胱甘肽过氧化物酶(Glutathione peroxidase,GPX)和谷胱甘肽巯基转移酶(Glutathione S-transferase,GST)酶清除ROS或有毒化合物,从而提高植物对逆境耐受性(SzalaI et al.,2009)。本研究结果表明,随着碱胁迫程度的增加,SOD、POD和CAT活性以及ASA和GSH含量均持续增加,碱敏感品种“中花11”SOD、POD和CAT活性以及ASA和GSH含量增幅小于耐碱品种“宁粳52”,说明耐碱性水稻品种通过合成更多的抗氧化酶和抗氧剂来清除ROS,进而提高自身的耐受性,Zhang et al.(2017)的研究也得出了相似的结论。此外,SOD和POD活性以及GSH含量在30A处理时显著降低,暗示30A处理下植株合成较少的ROS,进而致使SOD和POD活性以及GSH含量相对较低。
3.2 水稻应答碱胁迫的阶段性变化及受害等级构建
安玉艳等(2012)提出植物在应对不同程度的逆境胁迫时存在阶段性变化,在不同的阶段着重点不同。王慧等(2017)研究发现柽柳(Tamarix chinensis Lour.)总有机碳和营养元素在不同程度的盐碱胁迫阶段差异较大,其中在中度盐碱胁迫阶段总有机碳和全钾含量最高,及在此阶段植株主要通过增加总有机碳和全钾含量来提高对盐碱胁迫的适应性。本研究通过主成分分析提取6个关键指标,将碱胁迫伤害划分为正常(0≤Z<1)、轻度(1≤Z<4)、中度(4≤Z<7)、重度(7≤Z<10)、特重度(10≤Z)5 个等级。在 10C(10 mmol·L−1、pH 10.50)、20C(20 mmol·L−1、pH 10.50)、30C(30 mmol·L−1、pH 10.50)时,碱敏感水稻ZH11受害等级分别为中度、重度、特重度,而对应的耐碱材料NG52受害等级则为轻度、中度、重度。说明不同碱敏感水稻在不同胁迫阶段会启动不同的防御机制,进而影响水稻的抗碱性。在 20C(20 mmol·L−1、pH 10.50)处理下,两种材料应答碱胁迫的差异较大,因此可作为筛选不同碱敏感水稻的阀值。
本研究结果发现,从10A处理到20C处理阶段,叶绿素(Chla、Chlb、Chl)含量、叶绿素 a/b(Chla/b)和叶片相对含水量呈降低趋势;渗透调节物质(Pro、SS、SP)含量、丙二醛(MDA)含量、脂氧合酶(LOX)活性、活性氧(O2·-和 H2O2)、抗氧化酶(SOD、POD和CAT)活性、还原型抗坏血酸(ASA)和还原型谷胱甘肽(GSH)含量不断升高。在30A处理下,Chl a和Chl含量以及Chl a/b的比值、叶片相对含水量较20C处理有显著升高,可溶性糖、MDA、LOX、H2O2、O2·-产生速率、SOD、POD、GSH较20C处理有显著降低;通过碱胁迫等级的划分发现,碱敏感品种“中花11”20C处理下为重度胁迫,30A为中度胁迫,说明中等碱水平(20 mmol·L−1)高 pH(10.50)组合对水稻的伤害大于高碱水平(30 mmol·L−1)低 pH(8.65)组合,即当碱水平大于20 mmol·L−1时,碱水平和高pH之间有明显的相互作用。Zhang et al.(2020)的研究也发现,在低盐碱水平下,pH值增加对桑树(Morus alba)幼苗叶片光系统Ⅱ(photosystem Ⅱ complex,PSⅡ)的影响很小,但是,在高盐碱水平下,较高的pH值对盐碱胁迫下PSⅡ反应中心的光化学活性产生较大的影响。
4 结论
(1)碱胁迫引起水稻各生理参数的变化,两种水稻品种在碱胁迫程度下会启动不同的防御机制以响应碱胁迫。耐碱品种“宁粳52”通过保持较高叶绿素含量和叶片相对含水量,以及合成较多的渗透调节物质,并提高抗氧化防御系统的能力来清除多余的ROS来增强植株的耐碱性。
(2)运用主成分分析,挑选出 Chla、SOD、MDA、H2O2、SS、ASA等关键指标,通过计算胁迫指数Z,将水稻受害等级划分为正常(0≤Z<1)、轻度(1≤Z<4)、中度(4≤Z<7)、重度(7≤Z<10)、特重度(10≤Z)5个等级。
(3)在低碱水平(10 mmol·L−1)下,pH 对水稻的生理参数和胁迫等级影响较小,但在碱水平大于20 mmol·L−1时,碱水平和高pH有明显的相互作用,对水稻的生理参数和胁迫等级的影响增大。因此,在盐碱地种植水稻时应考虑总盐碱水平和 pH共同对水稻生长的影响。

