生活污水处理中微藻的优选及氮、磷转化研究
张萍,方淳,朱思涵,韩松,李凯,王志康
贵州民族大学生态环境工程学院,贵州 贵阳 550025
微藻是一类光能自养型生物,没有真正根、茎、叶的分化,以单细胞的孢子或合子进行繁殖(胡鸿钧等,2006)。其对环境要求低,生长繁殖快,光合效率高,培养不占耕地(徐凯,2015)。此外,微藻含有丰富的多糖、蛋白质、脂质、虾青素、卡拉胶等物质(江红霞等,2003),在水产养殖、生物能源、食品和医药等领域有广泛的应用前景(刘伟,2006)。然而,微藻在生物能源、食品和医药等领域的应用成本高(于殿江等,2021),这在一定程度上阻碍了微藻产业的发展。为了降低成本,有研究者提出利用污水养殖微藻。胡洪营等(2009)提出了“污水处理与微藻生物能源生产耦合工艺”,此工艺可净化污水并同时获得高价值藻细胞生物质。Prandini et al.(2016)对养猪废水结合沼气净化培养微藻进行研究,发现微生物废水处理与沼气相结合不仅能够加速污染物的去除,同时可促进生物质和生物甲烷的生产。Lu et al.(2015)通过研究小球藻处理肉类加工废水,发现小球藻在混合废水中生长的生物量提高,同时藻细胞蛋白质的合成也得到了促进,远高于传统来源蛋白质。这表明,混合废水可平衡营养物质,提高生物量产量和蛋白质含量。生活污水是指人们日常生活中排出的废水,其富含有机物、氨氮、尿素、磷酸盐等营养物质,尤其适合用于微藻的养殖(Feffer et al.,2009;李扬,2020)。
随着经济的快速发展,城镇化水平不断提高,中国生活污水排放量增加(Chai et al.,2021)。传统市政污水处理多采用两个独立的工艺去除氮、磷(Beuckels et al.,2015),氮、磷排放经常超标(黄添浩等,2019),水体富营养化程度加剧(Liang et al.,2013;秦乐乐等,2020)。然而,微藻在生长过程中能吸收污水中的氮、磷营养盐,在污水氮、磷的去除方面有极大优势(Olguín et al.,2003;Órpez et al.,2008)。同时,某些微藻在特定的培养条件下能选择性地积累蛋白质、油脂等高附加值产品,利用前景广阔(郝晓地等,2020)。基于微藻处理污水,不仅可以实现污水的无害化处理,还考虑了污水的资源化属性,利用污水中的营养元素生产微藻的高价值产品,受到越来越多的关注。
杨福利等(2014)用养殖污水培养小球藻,发现小球藻对污水中氨氮和磷酸盐去除率达 90%以上。Franchino et al.(2013)将3种微藻置于不同稀释度消化液中培养,发现 3种微藻几乎完全去除稀释污水中的氮和磷,但营养物质浓度过高的农业污水会抑制微藻生长。不同微藻对污水耐受性存在差异,因此,寻找合适的微藻和适宜微藻生长的污水浓度是大规模培养的关键。另有文献报道微藻对污水中不同形态氮、磷的去除具有选择性(刘淑坡等,2012;黄静依等,2020)。然而,目前对于不同微藻处理污水过程中涉及的氮、磷形态转化研究有限。
本文在实验室条件下选用斜生栅藻(S.obliquus)、普通小球藻(C. vulgaris)和螺旋藻(Spirulina sp.)3种常用微藻作为研究对象,通过序批式实验,考察微藻在不同浓度模拟生活污水中的生长情况,以及对污水中氮、磷等营养物质的去除情况,探究不同形态氮、磷的变化,旨在明晰微藻去除氮、磷的机理,为处理生活污水提供理论基础。综合考虑微藻生长和对污水中氮、磷去除情况,筛选出处理模拟生活污水的合适微藻,为后续探究菌藻共生去除污水中营养物质提供实验依据和参考。
1 材料与方法
1.1 试剂耗材与仪器
(1)试剂和耗材:K2HPO4·3H2O,C6H12O6,MgSO4·7H2O,EDTA-Na2,CuSO4·5H2O,ZnSO4·7H2O均购自成都金山化学试剂有限公司;CaCl2·2H2O,Na2MoO4·2H2O 购自天津市科密欧化学试剂有限公司;C6H8FeNO7,MnCl2·4H2O均购自上海阿拉丁生化科技股份有限公司;Co(NO3)2·6H2O 购置于广东光华科技股份有限公司;NH4Cl,H3BO3均购置于天津市永大化学试剂有限公司;本研究所用试剂均为分析纯。玻璃纤维滤膜(0.45 μm)为 Whatman公司生产。
(2)主要仪器:UT383迷你照度计(中国优利德),GT10-1型高速台式离心机(北京时代),SHB-Ⅳ双循环水式多用真空泵(郑州长城科工贸),PHB-4型便携式pH计(上海仪电),JPB-607A便携式溶解氧测定仪(上海仪电),YXQ-SG46-280S型手提式压力蒸汽灭菌器(上海博讯),Alpha-1900S型紫外-可见分光光度计(上海谱元),UB203i型正置生物显微镜(重庆澳浦光电),玻璃砂芯漏斗(天津津腾),UPC-I-10T型优普系列超纯水器。
1.2 藻种来源与预培养
实验中所用藻种斜生栅藻(S. obliquus)、普通小球藻(C. vulgaris)和螺旋藻(Spirulina sp.)均购自中国科学院淡水藻种库。3种微藻均采用灭菌BG11培养基(Malihe et al.,2021)于光照培养箱中培养,培养条件为温度 25 ℃,光照强度 2000 lux,光暗比12 h∶12 h。采用无菌空气通气扩培1周左右,取一定体积的扩培藻液以4500 r·min−1的速度离心5 min,弃上清液后加少量培养基悬浮微藻,即可用于实验。
1.3 实验用模拟生活污水
配制低、中、高3种浓度梯度的模拟生活污水用于后续实验。低浓度生活污水中COD、氮、磷质量浓度分别为 100、15、2.5 mg·L−1;中浓度生活污水中 COD、氮、磷质量浓度分别为 250、30、7.5 mg·L−1;高浓度生活污水中COD、氮、磷质量浓度分别为 500、60、15 mg·L−1。3 种浓度模拟生活污水的成分及含量见表1。
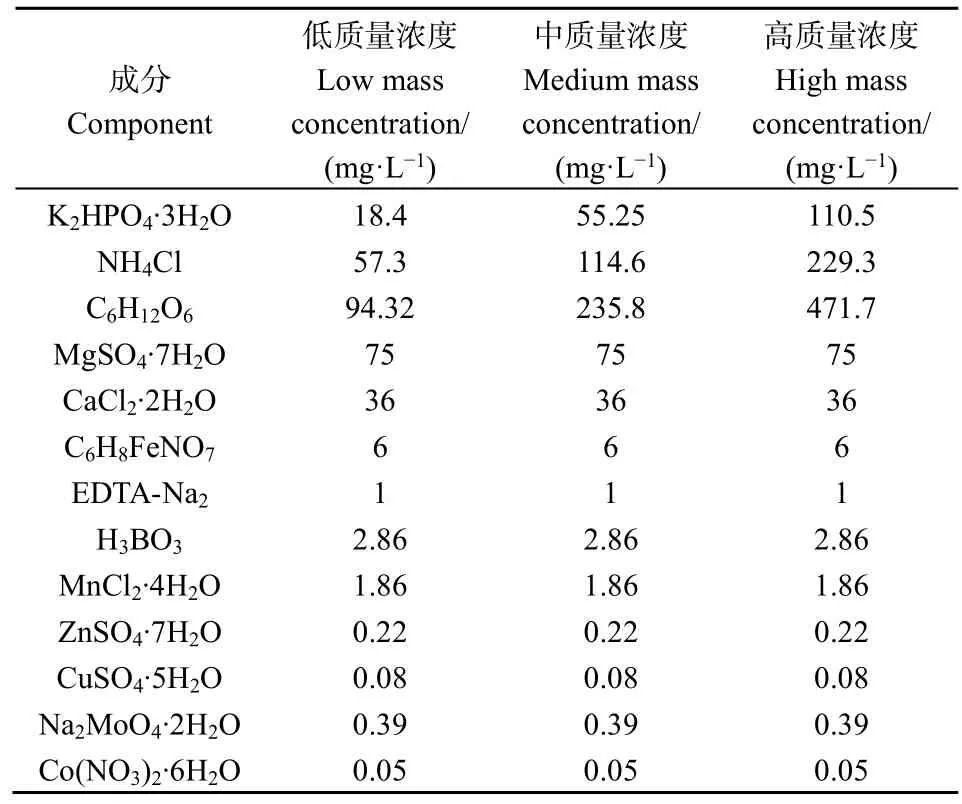
表1 模拟生活污水的成分Table 1 Simulated domestic sewage composition
1.4 实验设计
本实验采用1 L三角瓶进行微藻的序批培养,接种的3种微藻初始OD680值为0.100,实验条件与藻种预培养一致,每天手动摇瓶3次。09:00取样测水样中微藻生物量、溶解氧(DO)、pH值和N、P(营养盐)浓度。
1.4.1 微藻生物量测定
每天取样监测微藻生物量。螺旋藻呈丝状,为保证相同的微藻初始生物量,本文采用光密度法测定污水中微藻生物量,即紫外-可见分光光度计在680 nm处的吸光度值OD680(Santos-Ballardo et al.,2015)。为了能准确反映细胞生物量变化,利用显微镜血球计数板对斜生栅藻和普通小球藻进行计数。
1.4.2 水质指标测定
实验期间每天取 10 mL模拟生活污水进行实验,连续取样9天,在取样期间持续进行补水。测定的理化性质包括DO、pH、总磷(TP)、总氮(TN)、胞内总氮(TCN)、胞内总磷(TCP)、溶解性活性磷(SRP)、溶解性总磷(DTP)、溶解性总氮(DTN)、NH4+-N、NO3−-N、NO2−-N。其中,前4项水质指标直接取原水样测量;其余指标的测定水样均经 0.45 μm玻璃纤维滤膜抽滤处理,滤膜消解抽滤后的滤液用于测 TCP、TCN。所有指标的测定均参照《水和废水监测分析方法》(国家环境保护局,1997)。
1.5 数据处理与分析
N、P相关质量浓度计算为式 (1)—(5),DIN为溶解性无机氮,DON为溶解性有机氮,DOP为溶解性有机磷,其中,NO2−-N 质量浓度很低,忽略不计。去除率(removal efficiency,简称R)为经过微藻处理后,污水氮(磷)质量浓度减少量与初始污水质量浓度的百分比,ρ0为初始质量浓度(mg·L−1),ρt为最终质量浓度(mg·L−1)。利用 Origin 2018对数据进行分析与作图。
2 结果与讨论
2.1 微藻的生物量变化
图1为不同质量浓度模拟生活污水中微藻的生长曲线。0—2天为适应期,3种微藻细胞密度增加较慢;2天后,微藻开始进入对数生长期,斜生栅藻和普通小球藻细胞密度明显高于螺旋藻,分析原因是微藻生长对污水中营养盐吸收利用、适应能力有差异,这与赵秀侠等(2018)研究的结果一致。对数生长期后,微藻细胞密度下降或基本不变,而藻液OD680却在持续增加。梁芳等(2014)通过研究微藻在不同培养时期的藻液吸收光谱,发现OD680值只有在藻细胞稳定期之前才与细胞密度成正比,因此,对数生长期后如果利用OD680值的变化表示细胞密度变化就会产生很大误差。所以,对数生长期后需要结合藻细胞计数(图1b 和图1d)进一步反映微藻生物量情况。
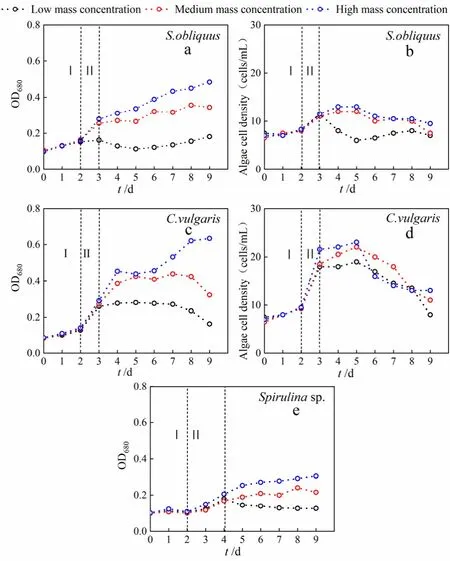
图1 不同质量浓度模拟生活污水中微藻生物量随时间变化Fig. 1 Changes of microalgae biomass in simulated domestic sewage with different mass concentrations over time
3—4天为对数生长后期及稳定前期,对比同一种微藻的生物量,发现中、高浓度模拟生活污水中的微藻生物量高于低浓度模拟生活污水中的微藻生物量,这与周海东(2020)得出的较高浓度污水能促进微藻生物量增加结论一致;而对比同一浓度模拟生活污水中微藻的生物量,会发现普通小球藻生物量累积最高,其次是斜生栅藻和螺旋藻,这与邓祥元等(2013)的研究结果相近。
3种微藻在不同质量浓度模拟生活污水中生长情况如图2所示。斜生栅藻在3种浓度模拟生活污水中均能较好地生长。普通小球藻在低浓度污水中也呈现较好的生长状态,但自第5天,由普通小球藻处理的中、高浓度污水颜色由浅绿色变成黄色,最后发白,说明普通小球藻在氮磷质量浓度过高的污水中耐受性较差、生长周期短,对数生长期后便出现衰亡现象(图2f)。螺旋藻在 3种浓度污水中均无法正常生长,推测导致螺旋藻衰亡的原因是模拟生活污水偏酸性。研究表明,用氨氮作为氮源培养螺旋藻是可行的,但利用氨氮作为氮源值得注意的一点是,螺旋藻适宜在碱性环境下培养(韩佩,2018)。此外,镜检观察到螺旋藻初期为深绿色,藻丝体上藻细胞连接紧密(图 2g);对数生长期藻丝体上出现明显断裂点,成熟藻丝体周围有刚脱离的新生藻丝(图 2h),之后藻丝体颜色变浅、松弛现象明显,老化藻丝(图2i)增多。

图2 低、中、高质量浓度模拟生活污水中各微藻生长情况Fig. 2 Growth of various microalgae in low, medium and high mass concentration simulated domestic sewage
低浓度模拟生活污水中,斜生栅藻和普通小球藻均能较好地生长,且普通小球藻生物量高于斜生栅藻;中、高浓度模拟生活污水中,斜生栅藻生长较好但普通小球藻生长状态较差,后期死亡,螺旋藻在低、中、高浓度的模拟生活污水中,后期均出现死亡现象。
2.2 模拟生活污水pH变化
各实验组pH变化如图3所示。第1—2天,pH均略微降低,但并不显著,由微藻生长曲线可知,微藻处于生长适应期,光合作用较弱,微藻呼吸作用导致pH降低。2天后,微藻开始适应污水环境,微藻生物量显著增加,污水pH急剧下降至4.0左右,这是因为本实验以氨氮为唯一氮源,微藻细胞吸收氨氮后释放H+,导致pH下降(Li et al.,2010;Perez-Garcia et al.,2011;罗龙皂等,2019);实验后期,水体酸化严重,部分污水从深绿色逐渐变为浅绿色甚至白色,这是因为微藻细胞的分解以及微藻衰亡均会导致pH下降(于茜等,2016)。特别地,螺旋藻处理的低浓度生活污水pH值自第5天回升后趋于稳定,且始终高于中、高浓度生活污水的pH,由图 1、2可知,螺旋藻在低浓度生活污水中最先进入衰亡期,推测pH值回升的主要原因是新生藻丝体的产生。
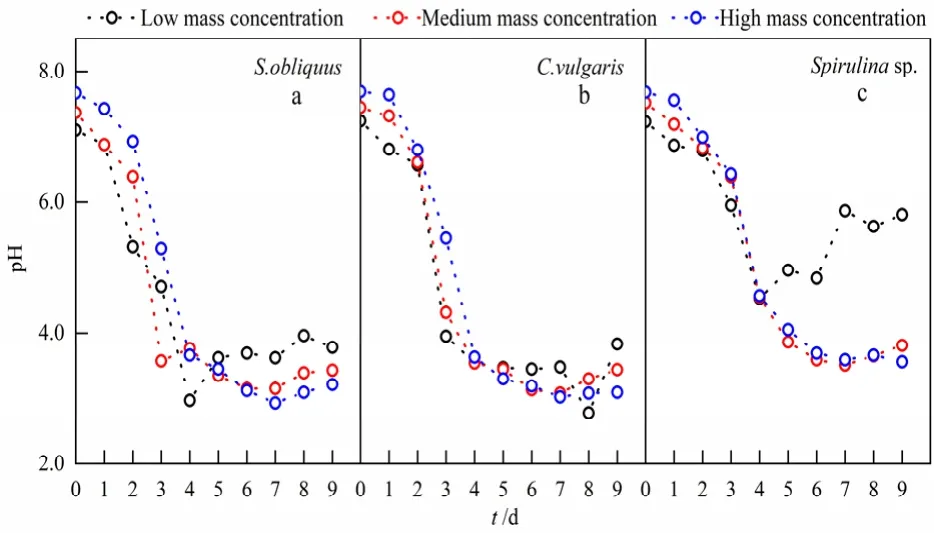
图3 各处理组pH变化Fig. 3 Changes of pH in each treatment group
2.3 3种微藻对模拟生活污水中氮、磷的去除
氮、磷是微藻生长的必需营养物质,因此微藻对污水中的氮、磷营养盐有一定的去除效果。通过污水中 SRP、NH4+-N去除率大小可以表征微藻对氮、磷的吸收与去除效果。微藻去除氮、磷包括两个方面:直接吸收和间接吸收,藻类通过光合作用可同化污水中大量氮、磷等营养物质,将简单的无机物合成可供自身生长繁殖的有机物,从而去除污水中的氮、磷营养盐(Su et al.,2011)。
微藻对磷的去除途径有生物吸收和化学沉淀(余江等,2019)。由于模拟生活污水pH均低于9.0,并未达到9—11的碱性环境,且所配污水未添加钙、镁等金属离子,所以不考虑化学沉淀除磷(黄静依等,2020)。由表2可知,低浓度模拟生活污水中,3种微藻对SRP去除率均高于50%,尤其是斜生栅藻和普通小球藻表现出较强的除磷能力,SRP去除率分别为82.34%(第6天)和85.67%(第7天)。中、高浓度模拟生活污水中,微藻对SRP亦有一定的去除。自实验第2天,微藻进入对数生长期,SRP去除率变化明显,说明微藻对污水中磷的同化作用随微藻生物量增加而增强。4天后,部分实验组SRP去除率降低或基本不变,这是由于实验后期,污水中的磷难以满足微藻生长需求,部分微藻衰亡又重新释放磷。王海英等(2011)指出,实验后期城市污水中TP的去除效果变差,主要是因为污水中磷含量下降,难以维持微藻生长繁殖,与本实验结果一致。实验前期,微藻需要吸收磷进行生长繁殖,故对磷需求较高,之后,污水中的磷逐渐被消耗,难以维持微藻的大量繁殖,故对SRP去除速度减缓。此外,在不同生长阶段,斜生栅藻对污水中SRP的去除效果均较普通小球藻好。有研究发现,普通小球藻对高浓度污水敏感,受到的抑制作用远高于斜生栅藻(章斐等,2015)。可见,斜生栅藻耐污性更强。
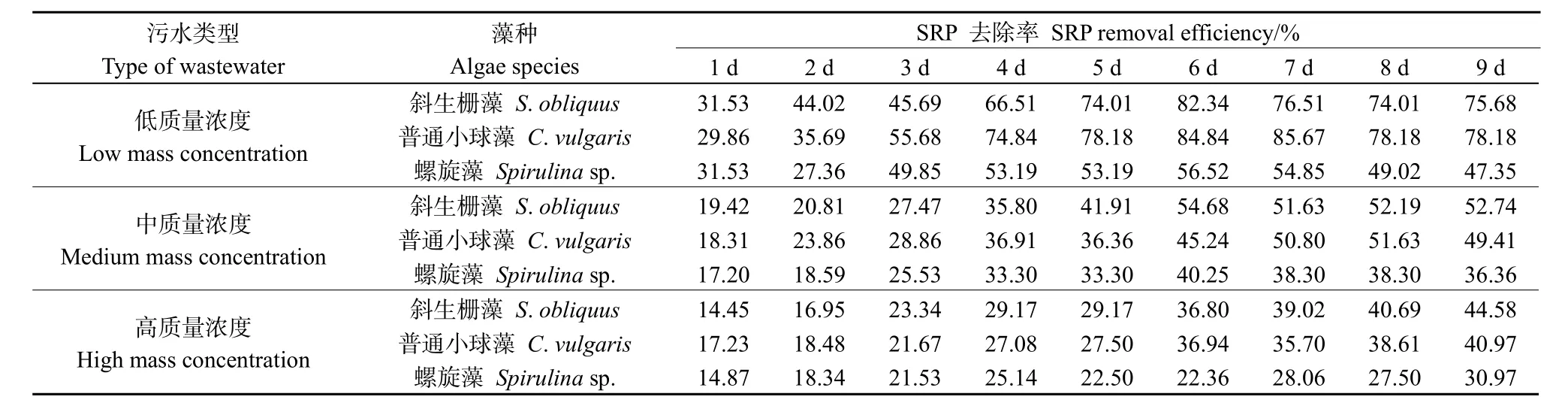
表2 3种微藻对不同质量浓度模拟生活污水中SRP的去除率Table 2 Removal efficiency of SRP from simulated domestic sewage with different mass concentrations by three microalgae
微藻吸收污水中无机氮用于有机氮的合成(脱金华等,2019)。模拟生活污水中的NH4Cl是氮的来源,虽藻细胞表面可能会吸附少量氨离子,但这对整体浓度变化并无太大影响。实验期间,污水处于偏酸性环境中,因此,微藻光合作用引起pH升高促进的氨挥发(Wang et al.,2015;皮永蕊等,2019)并不是除氮的主要方式;此外,模拟生活污水中并不存在氨氧化菌,所以氨氧化也不是脱氮的方式(苟尧,2018)。由此,氨氮去除量主要取决于微藻对氨氮的同化吸收(刘磊等,2014)。
表3中,氨氮去除率出现负值,主要是因为微藻处于适应期,生长受到抑制,其对污水中氨氮吸收较少,中、高浓度污水抑制现象尤为明显;部分处于成熟期的微藻自身释放的蛋白质也会增加氨氮含量(于媛等,2006;姜红鹰等,2017)。总之,NH4+-N去除率呈持续增长状态,说明NH4+-N是微藻易利用的N源(刘磊等,2014)。1—2天,微藻处于适应期,NH4+-N去除效果不明显;2天后,NH4+-N去除率显著增加,此时微藻进入对数生长期,可快速利用NH4+-N进行生长繁殖。相较于中、高浓度模拟生活污水,斜生栅藻、普通小球藻和螺旋藻对低浓度模拟生活污水中NH4+-N去除效果较好,最高可达52.16%(第6天)、61.86%(第5天)、36.00%(第6天)。Aslan et al.(2006)研究发现,氨氮浓度小于 22 mg·L−1且磷酸盐磷浓度小于 7.7 mg·L−1时,氮磷去除率可达最高水平,与本实验微藻能较好地去除低浓度污水中的氮结论一致。数据表明,普通小球藻对模拟生活污水NH4+-N去除效果普遍优于斜生栅藻和螺旋藻。这是因为普通小球藻对NH4+-N的亲和能力更强,对NH4+-N利用率更高(Perez-Garcia et al.,2011)。赵秀侠等(2018)证实了微藻NH4+-N去除效果存在差异,且去除能力从大到小依次为:螺旋藻>小球藻>栅藻。但由于本实验污水的pH值偏酸性,螺旋藻生长状况不佳,NH4+-N去除效果不佳。

表3 3种微藻对不同质量浓度模拟生活污水中NH4+-N的去除率Table 3 Removal efficiency of NH4+-N from simulated domestic sewage with different mass concentrations by three microalgae
2.4 污水中的氮、磷形态变化及微藻作用分析
微藻对污水中氮、磷的去除主要是通过微藻的光合作用,将无机氮、磷营养盐转化成微藻生物体,所以藻体衰亡会释放氮、磷元素,这是污水中氮、磷浓度回升的原因(贾纬等,2021)。
NH4+-N是最易被微藻利用的氮形态,如图 4所示,0—2天,低浓度组斜生栅藻和普通小球藻的TCN质量浓度维持在6.0 mg·L−1和4.0 mg·L−1左右,这与微藻处于适应期有关。斜生栅藻 TCN质量浓度自第3天开始下降,4天后逐渐上升;普通小球藻从第 2天的 4.40 mg·L−1上升至第 5天的 7.89 mg·L−1,后下降至实验结束时的 5.73 mg·L−1。TCN质量浓度增加是因为微藻生物量的增加,而 TCN的减少与微藻衰亡有关。NH4+-N质量浓度降低到最低水平后又有所回升,这可能与衰亡的微藻细胞分解释放含氮有机物有关(Ren et al.,2017)。9天后,低浓度模拟生活污水中NH4+-N质量浓度分别降低了 4.49、4.61、1.22 mg·L−1,斜生栅藻和普通小球藻的 TCN 分别增加了 1.0 mg·L−1和 1.6 mg·L−1,螺旋藻因过早衰亡导致 TCN 减少,TCN变化的差异性和微藻种类有关。整体来看,各浓度组NH4+-N的减少主要是因为微藻将NH4+-N同化为有机氮(Chen et al.,2020)。
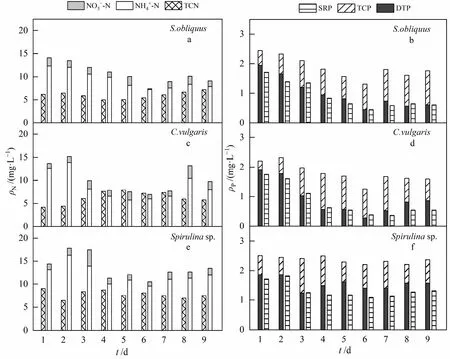
图4 低质量浓度模拟生活污水中氮、磷形态变化Fig. 4 Transformation of nitrogen and phosphorus form in low mass concentration simulated domestic sewage
低浓度模拟生活污水中的SRP质量浓度整体呈先下降后上升再稳定的趋势。1—6天,SRP质量浓度减少,相应的TCP质量浓度逐步增加,特别是对数生长期微藻生物量增加后,SRP质量浓度减少尤为明显;6天后,污水中SRP质量浓度略微上升后近趋于稳定,原因是微藻的衰亡,这与黄静依等(2020)的研究一致。DTP质量浓度变化趋势与SRP一致。普通小球藻(第7天)和螺旋藻(第4天)TCP质量浓度的减少,主要是因为微藻衰亡导致藻细胞内P元素的释放。DOP由衰亡微藻细胞自融产生(张军晓等,2017),斜生栅藻处理的低浓度模拟生活污水中 DOP由 0.237 mg·L−1逐渐减小至 0.003 mg·L−1,第3天和第7天DOP下降速度最快,其余时期变化缓慢,说明处于对数生长期、“二次生长”阶段的斜生栅藻对磷元素的利用更多,这说明微藻除了能利用污水中的磷源,也能吸收微藻细胞释放的磷。实验结束后,斜生栅藻、普通小球藻和螺旋藻 DOP 分别减少 1.104、1.207 和 0.396 mg·L−1,说明低浓度污水中普通小球藻生长状况较好,其次是斜生栅藻。SRP质量浓度分别减少了1.27、1.39、0.62 mg·L−1;TCP 分别增加了 0.66、0.91、0.59 mg·L−1,表明微藻同化作用将污水中溶解态磷向颗粒态磷转化,这与黄静依等(2020)的研究结果一致。
图5、6分别为中、高浓度模拟生活污水中氮、磷形态变化情况。中浓度组NH4+-N质量浓度分别减少了 15.8、10.9、10.3 mg·L−1,TCN 质量浓度分别增加了 6.0、2.0、4.7 mg·L−1;高浓度组 NH4+-N质量浓度分别减少了 24.1、24.8、24.0 mg·L−1,TCN质量浓度相应增加了 11.4、17.1、6.8 mg·L−1。因此,中、高浓度组微藻吸收转化的氮较低浓度组多。就氨可利用性而言,微藻从氮、磷浓度较低的培养基进入氮、磷浓度更高的污水中时,可能会导致更大的吸收率(Alejandro et al.,2010)。实验后期,NH4+-N质量浓度趋于稳定与微藻衰亡有关,可见微藻生长过程中对NH4+-N的消耗有一定的需求,微藻开始衰亡时,NH4+-N并未消耗完全。实验全过程未检测到亚硝态氮的存在,表明微藻脱氮是直接吸收NH4+-N,并非通过硝化和反硝化过程完成。
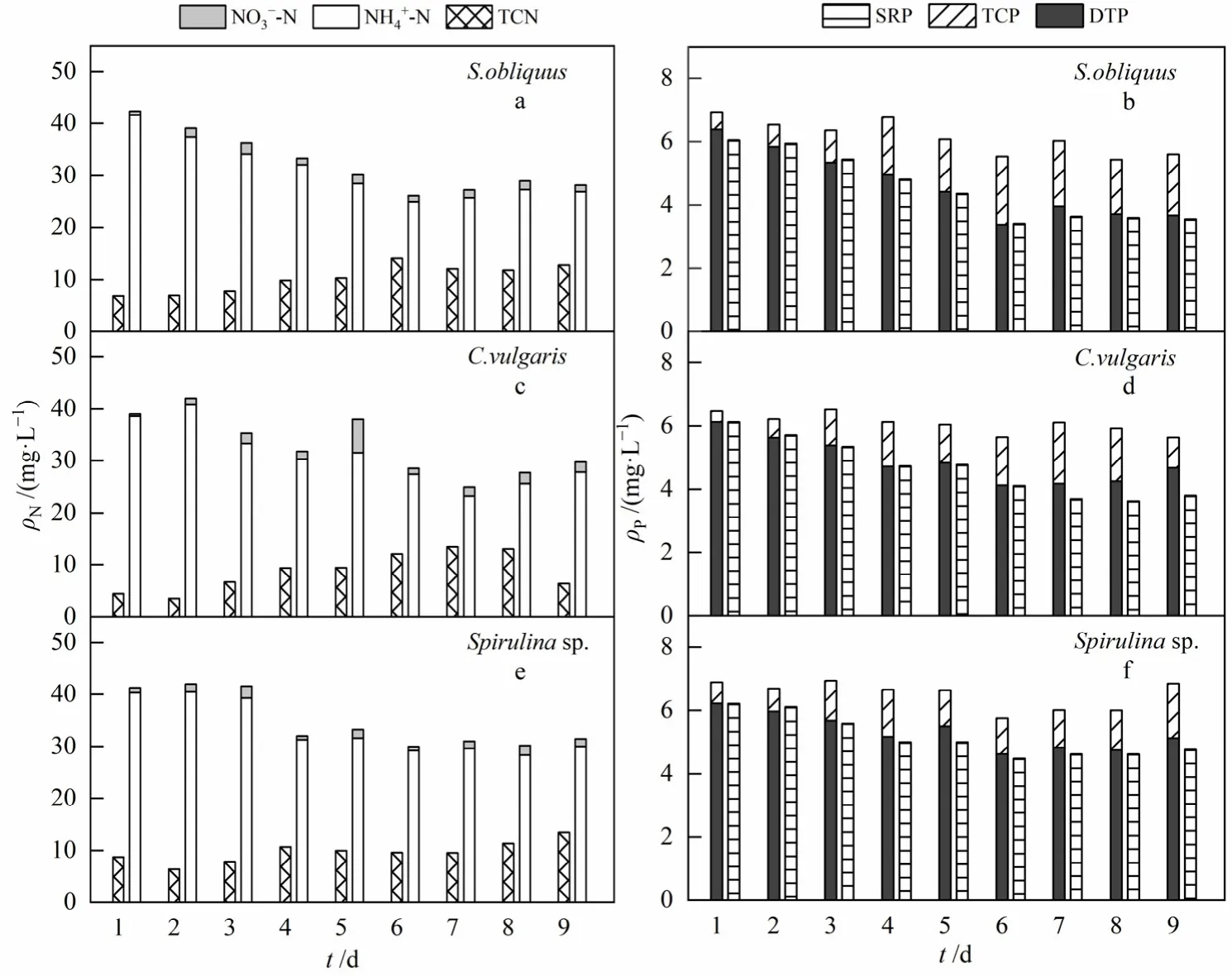
图5 中质量浓度模拟生活污水中氮、磷形态变化Fig. 5 Transformation of nitrogen and phosphorus form in medium mass concentration simulated domestic sewage
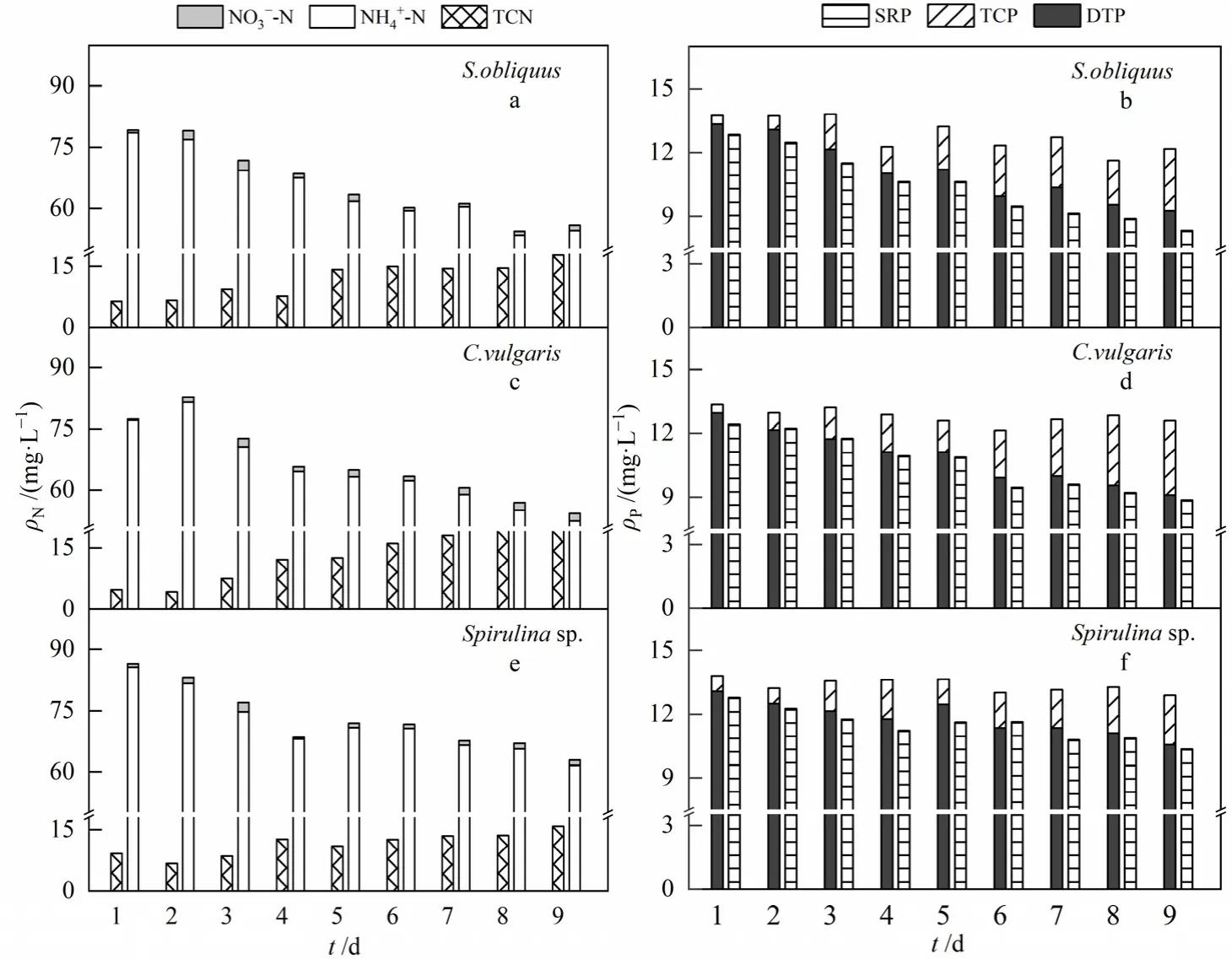
图6 高质量浓度模拟生活污水中氮、磷形态变化Fig. 6 Transformation of nitrogen and phosphorus form in high mass concentration simulated domestic sewage
中、高浓度组模拟生活污水磷形态变化趋势与低浓度组基本一致,不同的是,TCP与 DTP所占比例差异较大,这是因为实验配制的污水浓度不同。中、高浓度组污水磷质量浓度较高,微藻吸收利用的磷会相应增多,过量摄取的磷以聚磷酸盐颗粒的形式储存于细胞内(Cuellar-Bermudez et al.,2016)。在接种普通小球藻和螺旋藻的中浓度组模拟生活污水中,DOP分别从第5天、第7天开始持续增加,9天后,DOP分别增加了0.869 mg·L−1和0.349 mg·L−1;高浓度组污水中DOP变化情况与之相似。说明实验期间较高浓度污水易抑制微藻细胞使其衰亡,不利于微藻的生长(王璐瑶等,2012;常婷等,2019;罗龙皂等,2019)。
3 结论
(1)在研究的3种产业微藻中,斜生栅藻能够适应较高浓度的生活污水,且适应的浓度范围最广;普通小球藻仅能够在低浓度生活污水中生长,且较斜生栅藻生长快;螺旋藻在3种浓度模拟生活污水中生长状况均较差,故生活污水不能用于螺旋藻的培养。
(2)3种微藻对低浓度模拟生活污水处理效果最佳,对SRP去除率均高于50%,斜生栅藻和普通小球藻对SRP去除率高达82.34%、85.67%;斜生栅藻、普通小球藻和螺旋藻对NH4+-N去除率分别为 52.16%、61.86%、36.00%,表明,斜生栅藻和普通小球藻能用于生活污水的脱氮除磷。
(3)微藻光合作用是去除污水中可溶性无机氮和可溶性无机磷的主要途径,通过微藻的光合作用,溶解态氮、磷向颗粒态氮、磷转化。

