高产谷氨酸脱羧酶的菌株筛选及鉴定
■孙 磊 周 成 张 琇 孟 昆 柏映国 涂 涛*
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193;2.北方民族大学生物科学与工程学院,宁夏特殊生境微生物资源开发与利用重点实验室,宁夏银川 750021;3.中国农业科学院饲料研究所,北京 100081)
γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种普遍存在于自然界的四碳非蛋白质氨基酸。它在人体内作为一种抑制性神经递质,具有镇静安神、降血压、抗癫痫哮喘、抗氧化衰老、调节激素分泌等重要的生理功效,因此,它在农牧、食品、工业、医疗等多种产业中都具有广阔的应用前景[1-2]。在畜牧养殖业,研究发现GABA可以有效改善动物机体热应激反应,促进动物的生长生殖,因此可以作为一种新型的饲料添加剂,助推畜牧养殖业绿色健康发展[3-5]。赵红霞等[6]的研究发现,饲料中添加GABA能够提高凡纳滨对虾的摄食率、增重率和抗亚硝酸氮应激的能力;李占占等[7]简述了γ-氨基丁酸的生物学功能及其在养鸡生产中的研究现状、应用前景;国强[8]在仔猪饲粮中添加20 mg/kg GABA 的研究发现可以显著提高仔猪的生产性能,调节其血清中激素的分泌,对仔猪的免疫功能和肠道微生物有一定改善的作用;刘岩等[9]在反刍动物体内研究了γ-氨基丁酸的生理功能及其在奶牛热应激中的应用。
目前GABA的生产制备主要有植物富集、化学合成和微生物发酵的方式,但是植物富集GABA的方法存在植物生长周期长、效率低的缺点,不能满足需求,化学合成的方法又存在着底物腐蚀性、副产物多等弊端[10]。相比较来说,微生物具有生长传代迅速、培养条件简单、生产成本低廉的优势。微生物生产GABA是通过其体内酶——谷氨酸脱羧酶(glutamate decarbox⁃ylase,GAD; EC 4.1.1.15)催化L-谷氨酸(L-glutamate,L-Glu)或谷氨酸钠(monosodium glutamate,MSG)脱羧获得的[11]。随着生物技术的发展,通过构建表达水平高、生产效率高的基因工程菌来进行细胞转化,使得该方法更有希望应用于GABA的工业化生产[12]。田灵芝等[13]从植物乳杆菌扩增获得了GAD 基因lpgad,构建了重组质粒pET-28a-lpgad 后,在大肠杆菌BL21(DE3)中高效诱导其表达,利用菌体转化L-Glu底物,转化率为97.32%;张六六等[14]通过在枯草芽孢杆菌中优化GAD 及辅因子磷酸吡哆醛(pyridoxal 5’-phos⁃phate,PLP)再生基因的串联表达,构建了1 株高产GAD 的重组枯草芽孢杆菌,通过24 h 的全细胞转化得到327 g/L GABA 的产量。因此,利用微生物进行发酵转化生产GABA,逐渐成为具有发展潜力的绿色生产方式[15]。
GAD已从多种生物资源中都得以挖掘和表征,而现如今,以微生物细胞为转化平台并没有大规模实际应用的实例报道,归结原因主要是:①微生物转化生产GABA 的转化率达不到工业生产的要求,转化率低;②后期产物的分离纯化工艺繁琐、耗能大,收益低。因此,挖掘优良的GAD资源,对于后期构建高效率转化性能的细胞平台,实现大规模工业生产GABA具有重要意义。本研究基于现如今产业现状,确定了具体的研究目的:挖掘新颖的GAD 蛋白资源,进行菌株的鉴定,为获得具有产业价值的GAD 资源奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 土样
从宁夏沙坡头采集地表下5 cm左右的沙漠土壤样品,将采集的土样置于无菌自封袋中,保存于-20 ℃冰箱,用于后期的菌株筛选与分离研究工作。
1.1.2 培养基及试剂配制
LB液体培养基:酵母粉5 mmol/L,NaCl 10 mmol/L,蛋白胨10 mmol/L,固体培养基另加15~20 mmol/L;发酵培养基:葡萄糖30.0 mmol/L、蛋白胨30.0 mmol/L、K2HPO40.6 mmol/L、L-Glu 8.0 mmol/L、NaNO33.0 g/L、MgSO4·7H2O 0.5 mmol/L、FeSO4·7H2O 0.01 mmol/L、PLP 0.3 mmol/L,pH 6.0,固体发酵培养基另加琼脂粉15 mmol/L;常见菌株生理生化鉴定培养基:依据东秀珠等[16]的《常见细菌系统鉴定手册》配制;50×TAE电泳缓冲液:称取Tris 242 g,冰乙酸57.1 mL/L,0.5 mmol/L EDTA,pH 8.0;甲基红指示剂:2 mmol/L,纯乙醇溶解;溴甲酚绿指示剂:1 mmol/L,纯乙醇溶解;甲基红-溴甲酚绿指示剂:甲基红和溴甲酚绿指示剂(V/V=1∶3)混合;NaHCO3:40 mmol/L;2, 4-二甲基胺基偶氮苯-4-磺酰氯溶液(4-N, N-dimethylaminoazobenzene-4'-sulfonyl chloride,DABS-Cl):1 mmol/L,纯乙腈溶解。
1.1.3 试剂及试剂盒
乙酸钠、L-Glu 和GABA:纯度≥99%(Sigma),色谱级乙腈、甲醇:纯度≥99%(Thermo Fisher),DABSCl、PLP:纯度≥98%(上海麦克林);Ex Taq DNA 聚合酶购自Vazyme 公司;胶回收试剂盒核酸分子量Marker、细菌基因组DNA 提取试剂盒购自天根生化科技(北京)有限公司。其他所用试剂均为国产分析纯试剂。
1.1.4 试验仪器
PCR 仪、凝胶成像仪均购自美国Bio-Rad 公司;移液器购自德国Eppendorf 公司;酶标仪购自美国BioTek公司;高效液相SHIMADZU 20A检测器购自日本岛津公司;色谱柱ZORBAX SB-C18(150×4.6 mm,5 μm)购自美国Agilent公司;台式离心机和立式高速冷冻离心机购自日本HITACHI 公司;核酸电泳仪、无菌操作台、灭菌锅、水浴锅、恒温摇床、培养箱等为国产仪器。
1.2 试验方法
1.2.1 土样处理
根据梯度稀释法对土壤中的菌株进行分离。分别称取4 g采集的土壤样品3份,放入盛有40 mL无菌生理盐水和玻璃珠的100 mL 三角瓶中,土壤稀释度为10-1。于30 ℃、180 r/min振荡培养30 min。静置沉淀,吸取500 μL 三角瓶中的上清液置于盛有4.5 mL无菌生理盐水的Ep 管中,充分振荡混匀。用灭菌生理盐水按照上述方法进行三次梯度稀释,共得到稀释度为10-1、10-2、10-3、10-4、10-5的土样稀释液,分别涂布于含有50 μg/mL 的卡那霉素、50 μg/mL 氨苄西林、100 μg/mL 氯霉素和无抗的4 种LB 固体培养基中,30 ℃培养箱倒置培养12 h,观察菌株生长情况。
1.2.2 纯化菌种
根据单菌分离法对土样中的菌种进行纯化分离。挑选各培养皿中形态不同且出现频率高的单菌落作为优势菌种进行分离纯化,直至长出形态均一的菌落为止。将获得的菌株以1%的接种量接种于LB培养基中,30 ℃过夜培养后,取400 μL菌液添加到等量的40%的甘油于-80 ℃保存。另外,选择平板和斜面培养基将菌种保存在4 ℃,每周进行一次活化转接。
1.2.3 产GABA菌株的筛选
1.2.3.1 显色法初筛
调节发酵培养基至不同pH,吸取20 μL甲基红-溴甲酚绿指示剂加入到200 μL 发酵培养基中,观察颜色变化。
将4 ℃保存的斜面菌用无菌牙签挑取放入无抗LB 培养基中于30 ℃恒温培养箱活化12 h,然后吸取10 μL 滴加在固体发酵培养基上,置于30 ℃过夜培养。将甲基红-溴甲酚绿指示剂滴加到平板培养基,静置5 min,观察颜色变化。
以1%的接菌量接入液体发酵培养基30 ℃下培养72 h。装液量40 mL/100 mL,摇床转速200 r/min。取2 mL 发酵72 h 后的混合液于12 000 r/min 离心5 min,吸取20 μL 甲基红-溴甲酚绿指示剂加入到200 μL发酵上清液中显色,对比发酵前后颜色变化。
1.2.3.2 HPLC复筛
吸取500 μL发酵液添加到500 μL 80%的乙醇中终止反应,按照邵金良等[17]的测定方法对样品进行HPLC测定。将1 mmol/L的L-Glu和GABA的标准溶液以及上述发酵后样品离心后的上清分别取500 μL,依次加入100 μL的NaHCO3溶液和200 μL的DABS-Cl溶液,混合后于70 ℃反应20 min,后经0.22 μm 的滤膜过滤进行HPLC测定。HPLC检测条件如下:紫外检测波长为436 nm;进样量:10 μL;柱温为30 ℃;流动相流速为1.0 mL/min;流动相A:乙酸钠溶液(0.05 mmol/L),35%;流动相B:乙腈,65%;色谱柱为Agilent ZORBAX SB-C18(150 mm×4.6 mm,5 μm)。
1.2.4 菌株的形态鉴定
将分离纯化的菌株接种于营养琼脂培养基上,30 ℃恒温培养箱中培养12 h,挑取生长状态良好的单菌落置于载玻片上,光学显微镜下观察菌体的形态、颜色、边缘、透明度、表面、有无鞭毛及芽孢着生等。
1.2.5 基因组的提取和16S rDNA的扩增
将获得的菌株以1%的接菌量接到40 mL LB 培养基,于30 ℃培养12 h 后,12 000 r/min 离心1 min,弃上清,收集菌体;采用细菌基因组DNA提取试剂盒分别提取所获菌株的基因组,提取方法参考试剂盒说明书进行;提取基因组后送苏州金唯智生物科技有限公司测序分析。
分别以菌株Z1、Z11、Z20 的基因组DNA 为模板,对菌株的16S rDNA基因片段进行扩增,采用通用的引物,正向引物27F:5’-AGAGTTTGATCCTGGCT⁃CAG-3’和反向引物1492R:5’-GGTTACCTTGTTAC⁃GACTT-3’。PCR 反应体系如下(总体积50 μL):dNTP 4 μL;正方向引物各2.5 μL;基因组DNA 1 μL;TaqDNA 聚合酶0.5 μL;10×Buffer 5 μL;最后ddH2O补齐至50 μL。
PCR 扩增共进行30 个程序循环:94 ℃预变性3 min;94 ℃变性50 s,55 ℃退火50 s,72 ℃延伸3 min;再72 ℃延伸5 min。PCR 产物测序由北京六合华大基因科技有限公司完成。
1.2.6 系统发育分析
将本研究中的3 个谷氨酸脱羧酶的16S rDNA 序列与NCBI 数据库中的序列进行相似性比对,用MEGA 7.0 软件中的ClustalW 进行序列对比后,参数默认;利用邻接(Neighbour-joining)方法构建系统进化树,Bootstrap method的设定值为1 000。
2 结果与分析
2.1 产GABA菌株的筛选
2.1.1 显色法初筛
未进行发酵的发酵培养基在不同pH 下,显示不同的颜色。产GABA 的菌株将底物消耗产生在水溶液中成中性pH的GABA后,培养基pH由酸性转为中性,添加甲基红-溴甲酚绿酸碱指示剂后,培养基呈现绿色或深绿色颜色(图1A)。本研究从沙漠土壤样品中分离到47株菌株,分别接种到发酵培养基培养72 h后,利用甲基红-溴甲酚绿酸碱指示剂显色的方法对GABA产生菌进行初筛。从而初步鉴定出3株具有产GABA能力的菌株,并命名为Z1、Z11、Z20(图1B)。

图1 发酵培养基在酸碱指示剂下的颜色反应
2.1.2 HPLC复筛
利用HPLC 对发酵过后显绿色的菌株进行初筛结果的验证。首先,如图2A 所示,经HPLC 检测,L-Glu 的衍生物在0.8 min 左右出峰,而GABA 的衍生物在4.2 min 出峰,推测2.3 min 左右存在的峰是衍生试剂本身的峰。杂质峰与GABA 衍生物的峰不存在交叉覆盖影响,具有良好的峰形。
HPLC检测发酵上清液后发现3株菌在4.0~4.2 min左右都有GABA吸收峰的出现(图2B),说明经72 h发酵培养后,3株菌都具有将底物转化生成GABA的能力。1 mmol/L GABA的峰面积在1 435 760左右,凭借GABA标准溶液的浓度和峰面积可以计算出菌株Z1、Z11、Z20所产GABA的浓度,分别为0.80、0.85、0.75 mmol/L。Z1、Z11、Z20所产GABA的峰面积与浓度见表1。
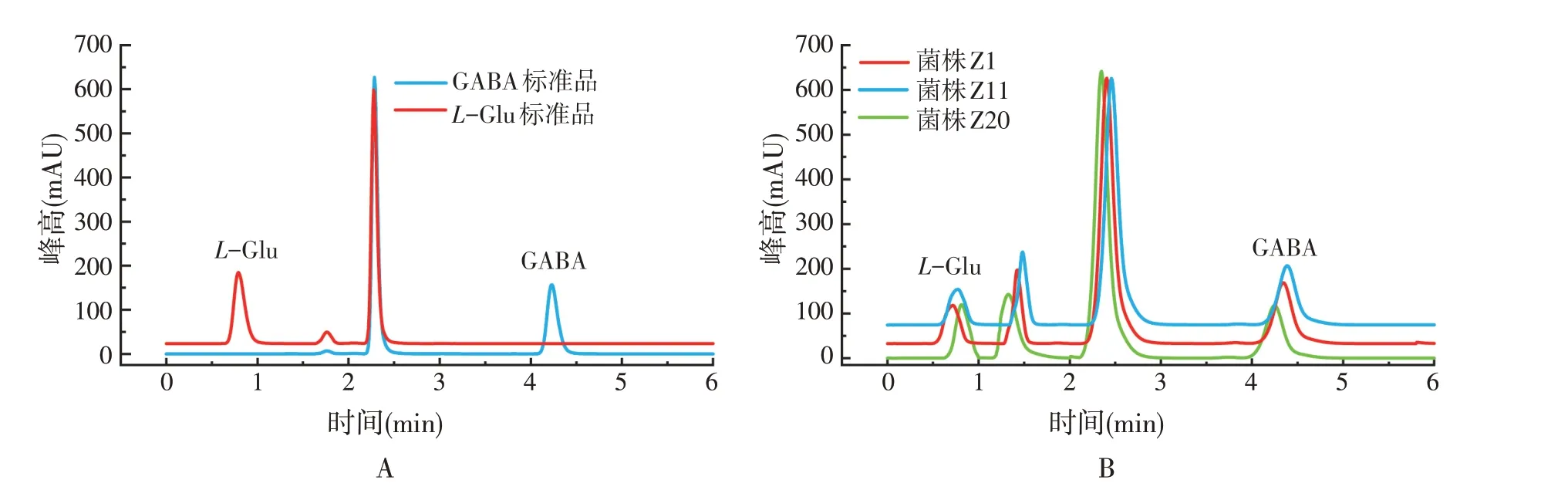
图2 GABA液相色谱
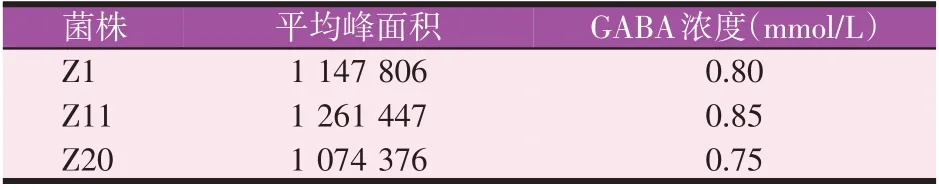
表1 Z1、Z11、Z20所产GABA的峰面积与浓度
2.2 菌株的鉴定
2.2.1 形态鉴定
菌株Z1、Z11、Z20在营养琼脂培养基上呈淡黄色圆形菌落,表面粗糙不透明,边缘整齐,革兰氏染色呈阳性。显微镜下菌体呈杆状,两端钝圆,多成串出现,有椭圆形芽孢,芽孢囊不膨大,中生或次端生。根据形态特征初步判断菌株Z1、Z11、Z20 为芽孢杆菌属(Bacillus sp.)。
2.2.2 16S rDNA序列分析
以菌株Z1、Z11 和Z20 的基因组DNA 为模板,利用通用引物分别对16S rDNA 保守序列进行PCR 扩增,均获得1.5 kb大小的序列,见图3。

图3 16S rDNA的PCR产物电泳图
将纯化后的PCR 产物连接到T 载体,经过菌落PCR验证得到条带大小正确的转化子,测序结果表明三条序列大小均为1.5 kb。三条16S rDNA 序列分别与GenBank 数据库中的16S rDNA 核苷酸序列进行同源比较,结果显示与黄海芽孢杆菌(Bacillus marisfla⁃vi)、水生芽孢杆菌(Bacillus aquimaris)、芽孢杆菌CSS-5、芽孢杆菌NH6 等来源的16S rDNA 核苷酸序列相似性最高,可以达到98%。
2.2.3 序列系统发育分析
将菌株Z1、Z11 和Z20 的16S rDNA 序列与Gen⁃Bank 数据库中的16S rDNA 序列做相似性比对,结果表明3 株菌的16S rDNA 序列均与芽孢杆菌属(Bacillus sp.)相关菌株的16S rDNA 序列的相似性较高,聚为一簇,构建Neighbor-Joining 系统进化树如图4 所示。

图4 Z1、Z11、Z20与芽孢杆菌属相关菌株的系统发育树
结合形态特征和系统发育分析,判定菌株Z1、Z11和Z20均为芽孢杆菌属,并命名为Bacillus sp. Z1、Bacillus sp. Z11和Bacillus sp. Z20,将所得的菌株保存在中国农业微生物菌种保存中心(Agriculture Culture Collection of China,ACCC),保藏号分别为ACCC 61750、61747和61748。
2.3 基因组的提取及分析
基因组测序一般包括提取基因组DNA、打断基因组、末端修复、加接头、纯化DNA 和上机测序。将原始数据去接头、去除低质量数据后获得高质量数据,数据进行组装后,便可以进行下一步的编码基因预测、非编码RNA 的预测,利用NR、KEGG、COG、CAZy 等数据库对预测出的编码基因进行功能注释分析。
2.3.1 基因组组装分析
基因组样本经检测合格用来构建文库,大片段DNA 将被打断为约500 bp 的大小片段进行测序,测序得到的序列利用Velvet、SSPACE、GapFiller 等软件进行拼接组装和补齐。三株菌的基因组测序数据结果统计显示,菌株Z1、Z11和Z20的基因组全长分别为4.3、4.8 和4.8 Mb,G+C 含量分别为48.5%、47.5%和47.4%。结果见表2。

表2 基因组组装分析
2.3.2 基因功能注释
利用NCBI 的NR(Non-Redundant Protein Data⁃base)数据库对芽孢杆菌基因进行注释,同时注释的结果包含了物种信息,可用作物种分类。表3 以Z1、Z11、Z20 每个菌株中的两个基因片段为例,阐释NR数据库的功能注释作用。

表3 NR数据库的注释信息
KEGG(Kyoto encyclopedia of genes and genomes,KEGG)数据库将生物代谢通路划分为细胞过程(Cel⁃lular processes)、遗传信息处理(Genetic information processing)、新陈代谢(Metabolism)等6类。通过该数据库注释分析,有助于查看相应基因参与的生物通路和生物功能。菌株Bacillus sp. Z1、Bacillus sp. Z11 和Bacillus sp. Z20的基因主要参与碳水化合物、氨基酸、辅因子和维生素的新陈代谢、信号转导、外源物质的转运等代谢通路。
NR 数据库对基因片段进行注释时,发现菌株Z1的6~84 基因片段、Z11 的7~249 片段和Z20 的8~237片段均与来源于苏云金芽孢杆菌(Bacillus thuringi⁃ensis)的GAD 具有87%的对比相似度,KEGG 对其功能注释为具有催化活性的谷氨酸脱羧酶。三个谷氨酸脱羧酶的序列长度均为1 470 bp,编码489 个氨基酸和1 个终止密码子,理论分子量55 ku。使用SignalP-5.0 在线软件进行分析其序列中不含信号肽片段。三条基因序列的相似性较高,gadz1 与gadz11的序列相似性为97.3%,具有58 个不同碱基;与gadz20 之间有103 个不同的碱基,序列相似性为94.5%;gadz11 和gadz20 之间具有106 个碱基的差别,序列相似性为94.5%。将上述3 个谷氨酸脱羧酶的序列信息分别提交至GeneBank 数据库,注册号分别为:MW 703457、MW 703456和MW 703455。
3 讨论
γ-氨基丁酸在多个行业都具有重要的应用价值。相较于反应条件苛刻、能耗高、副产物污染环境的化学生产方式,以及受限于植物生长周期长、效率低等弊端的植物富集提取,利用微生物发酵生产GABA 更具有开发的优势。依靠微生物体内的谷氨酸脱羧酶将L-Glu 脱羧转化生成GABA,该方法反应条件更温和,且微生物生长传代迅速[18-20]。根据不同工业的应用需求,会有不同的菌株应用于生产,比如产GABA 的乳酸菌和米曲霉可以分别应用于乳制品和酒品中以增加产品中GABA的含量,使产品更具有保健价值[21-23]。
GAD为胞内酶,其活性的检测通常需要经过细胞收集破碎、粗酶液提取、酶反应、底物减少或产物增加等繁琐的步骤,因此,建立快捷准确的GAD活性检测方法具有重要意义。目前对微生物氨基酸脱羧酶的鉴定中,通常是在培养基中添加溴甲酚紫、甲基红和相应氨基酸,氨基酸脱羧后根据体系pH会发生变化,根据培养基颜色是否变绿可以进行判断[16]。杨胜远等[24]建立了一种pH指示剂法用于快速筛选GAD活性的基因,并且与纸层析法和LC/MS 检测到的结果相似。本研究中,利用GAD 脱羧反应前后的pH 变化,通过酸碱指示剂从土壤中筛选出产GABA 的疑似菌株,并用HPLC 的方法对初筛的结果进行了验证。HPLC检测GABA具有灵敏度高、准确性大的优点,本研究中选择DABS-Cl作为衍生试剂,获得的GABA衍生物性质稳定,在436 nm处有明显的紫外吸收峰,且出峰时间短,有利于后续试验的进行。
本研究通过菌落形态鉴定和16S rDNA 序列比对,将3 株筛选到的产GABA 的菌株鉴定为芽孢杆菌属。并通过基因组测序分析,获得了编码GAD 的基因序列。虽然芽孢杆菌作为一种新型的具有潜在药用价值化合物的产生菌,自1971 年便首次报道可以产GABA,但实际上利用芽孢杆菌进行生物转化生产GABA并没有突出优势,性质最具突出性的GAD多是来源于或异源表达于大肠杆菌[25-27]。因此,本研究中获得的GAD编码序列能否在大肠杆菌中进行异源表达,并实现后续GABA 的高效生物转化,需要进一步的研究。
4 结论
本研究从宁夏沙漠土壤样品中,筛选到了3株产GABA的菌株,经过菌落形态鉴定和16S rDNA序列比对分析鉴定菌株Z1、Z11和Z20均为芽孢杆菌属,并命名 为Bacillus sp. Z1、Bacillus sp. Z11 和Bacillus sp.Z20,保藏于中国农业微生物菌种保存中心,保藏号分别为ACCC 61750、61747 和61748。针对3 株菌的全基因组进行测序发现,每株菌含有1个谷氨酸脱羧酶基因,丰富了谷氨酸脱羧酶的基因资源,为构建高效生物转化γ-氨基丁酸GABA工程菌提供了有效素材。

