注射用左旋泮托拉唑钠的遗传毒性研究
高 梅,马 会,曹 冲,英 永,张岱州*
(1. 山东省药学科学院 山东省化学药物重点实验室,山东 济南 250101;2. 山东师范大学 生命科学院,山东济南 250014)
泮托拉唑是质子泵抑制剂,研究表明,泮托拉唑能有效抑制胃酸分泌,主要用于治疗幽门螺杆菌感染,十二指肠溃疡,胃溃疡,中、重度反流性食管炎等[1-2]。左旋泮托拉唑钠是泮托拉唑钠的 -构型光学异构体钠盐,在中性和弱酸性条件下相对稳定,与消旋体泮托拉唑钠相比,左旋泮托拉唑钠具有代谢半衰期长、血浆蛋白结合率高、生物利用度高、疗效好、毒副作用低等特点[3-5],因此开发左旋泮托拉唑钠不同制剂具有较大的社会和经济意义。目前对左旋泮托拉唑钠的制剂研究、药效学、毒理学研究较多[6-12],但未见对其遗传毒性的研究。本研究根据《药物遗传毒性研究技术指导原则》[13],选用Ames试验、体外哺乳动物细胞染色体畸变试验、体内微核试验3项标准试验组合,评价了注射用左旋泮托拉唑钠的遗传毒性,以期为临床安全用药提供参考依据。
1 仪器与材料
1.1 试验系统
鼠伤寒沙门菌TA97a、TA98、TA100、TA 1 5 3 5和TA 1 0 2购自美国M O L E C U L A R TOXICOLOGY,INC。中国仓鼠肺细胞(CHL细胞)购自中国科学院上海生命科学研究院。SPF级昆明小鼠50只,雄性,体重30~40 g,北京维通利华实验动物技术有限公司提供,实验动物生产许可证号:SCXK(京)2016-0006,试验在屏障环境动物实验设施内进行,实验动物使用许可证号:SYXK(鲁)2018 0031。
1.2 主要仪器
AUY220电子天平(日本岛津有限公司);SPX-250B-Z生化培养箱(上海博迅实业有限公司医疗设备厂);HFsafe-1500TE生物安全柜(上海力申科学仪器有限公司);BC-J160S CO2细胞培养箱(上海博迅实业有限公司医疗设备厂);尼康80i生物显微镜(Nikon公司)。
1.3 药品与试剂
注射用左旋泮托拉唑钠;4-硝基喹啉-N-氧化物(Sigma);2-氨基芴(Sigma);1,8-二羟基蒽醌(Sigma);环磷酰胺(Sigma);丝裂霉素C(Roche);叠氮钠(山东西亚化学股份有限公司);RPMI Medium 1640 basic培养基(Gbico);新生牛血清(浙江天杭生物科技有限公司);肝微粒体酶(S9)(Molecular Toxicology, Inc)。
2 方法与结果
2.1 方法[13-15]
2.1.1 Ames试验 选用组氨酸营养缺陷型鼠伤寒沙门菌TA97a、TA98、TA100、TA1535和TA102 5种菌株组合,对其分别进行基因型特性鉴定,鉴定合格后用于试验。试验设计5个剂量,高剂量组有一定的细菌毒性,给药剂量分别为5000,2500,1250,625,312.5 μg/皿,每组3个平行皿,同时设溶媒对照组和阳性对照组。试验在加S9和不加S9平行条件下进行,S9在S9混合液中的浓度为10 %(v/v),采用标准平板掺入法,加药后37 ℃培养箱培养48 h后观察结果并计数。
2.1.2 体外哺乳动物细胞染色体畸变试验 采用中国仓鼠肺细胞,荧光显微镜检查无支原体污染,核型检查畸变率<5 %。CHL细胞接种于25 cm2细胞培养瓶,置37 ℃、5 % CO2培养箱中培养。加和不加S9条件下,受试物分别染毒6 h,高、中、低剂量分别为200,100,50 μg/ml,不加S9条件下,受试物染毒24 h,高、中、低剂量分别为140,70,35 μg/ml,同时设相应的溶媒对照组和阳性对照组。各组收获前3~4 h加入秋水仙碱溶液,制备染色体标本。油镜下各组至少观察300个分散良好的分裂中期相细胞,记录含有结构畸变染色体的细胞数,计算畸变率。
2.1.3 小鼠骨髓微核试验 采用昆明小鼠,给药起始年龄6~8周龄,雄性,受试物高、中、低剂量分别为140,70,35 mg/kg,同时设立溶媒对照组、阳性对照组(环磷酰胺,50 mg/kg)。溶媒对照组、受试物各剂量组静脉注射给予相应给药制剂,阳性对照组腹腔注射给药,均给药1次,给药24 h后及给药后48 h前分别采样制备骨髓涂片。每只动物至少计数500个骨髓嗜多染红细胞以确定未成熟红细胞[嗜多染红细胞(PCE)]占总红细胞[未成熟红细胞和正染红细胞(NCE)]的比例。每只动物至少计数4000个未成熟红细胞以测定未成熟红细胞的微核率。
2.1.4 数据处理 试验数据进行平均数和标准差的计算,以均值±标准差(±s)表示,用SPSS软件统计分析。P>0.05表示差异无统计学意义,P<0.05表示差异有统计学意义。
2.2 结果
2.2.1 Ames试验 在加S9和不加S9条件下,溶媒对照组中各试验菌株回复突变菌落数均在正常范围内,阳性对照组各菌株回变菌落数均高于溶媒对照组(P<0.05),表明试验系统可靠。注射用左旋泮托拉唑钠5000 μg/皿对菌株有显著毒性作用(P<0.05),2500 μg/皿有轻微毒性作用(P<0.05),1250,625和312.5 μg/皿无抑菌作用(P>0.05)。各剂量组回变菌落数与溶媒对照组相比均无显著性增加,且未呈现浓度依赖性增加,表明注射用左旋泮托拉唑钠无诱导鼠伤寒沙门菌基因突变作用,鼠伤寒沙门菌回复突变试验为阴性。结果见表1。
表1 注射用左旋泮托拉唑钠鼠伤寒沙门菌回复突变试验结果(±s,n=3)

表1 注射用左旋泮托拉唑钠鼠伤寒沙门菌回复突变试验结果(±s,n=3)
注:*P<0.05 vs 溶媒对照组
组别 剂量/μg·皿-1 S9 回变菌落数TA97a TA98 TA100 TA102 TA1535溶媒对照组 / - 109.3±9.1 27.7±4.7 110.7±11.6 251.3±17.2 10.7±1.5+ 109.7±9.9 28.7±5.5 112.7±10.5 264.3±14.2 14.3±2.5阳性对照组 / - 389.3±48.2* 318.3±21.0* 1261.3±151.2* 1189.3±75.6* 1144.0±144.2*+ 1293.3±189.7* 1269.3±136.1* 1234.7±114.4* 829.3±60.0* 344.0±34.9*注射用左旋 312.5 - 108.3±12.7 24.0±3.5 109.3±7.5 259.7±15.0 9.3±1.5泮托拉唑钠 + 114.0±7.9 25.0±4.4 1.0±8.2 265.0±16.5 13.7±3.1 625 - 107.7±9.0 25.7±3.2 109.7±13.4 256.7±11.2 11.3±2.5+ 112.0±13.0 24.0±4.6 110.7±13.4 253.3±20.7 13.0±2.0 1250 - 108.3±9.9 23.0±3.0 118.0±17.8 248.0±15.0 11.3±2.3+ 111.7±13.0 28.3±5.9 117.0±14.4 260.7±24.4 12.7±2.1 2500 - 96.0±7.0 19.3±3.1* 76.3±12.7* 250.0±18.5 8.0±1.0+ 100.3±10.4 23.3±3.3 84.7±7.5* 258.0±18.7 8.3±1.5*5000 - 60.7±9.1* 13.0±2.0* 25.0±4.6* 210.0±12.8* 3.7±0.6*+ 62.3±4.9* 14.3±2.1* 28.0±5.0* 212.7±14.4* 4.3±1.2*
2.2.2 体外染色体畸变试验 在加S9和不加S9条件下,染毒6 h和24 h,溶媒对照组染色体畸变数均<5 %,阳性对照组丝裂霉素、环磷酰胺诱发产生的畸变率均>20 %,溶媒对照组畸变率与阳性对照组比较有显著性差异(P<0.05),表明试验系统可靠。在加S9和不加S9条件下,注射用左旋泮托拉唑钠在50,100,200 μg/ml剂量下作用6 h;在不加S 9条件下,3 5,7 0,140 μg/ml剂量作用24 h,各剂量染色体畸变率均<5 %,与相对应的溶媒对照组比较无显著性差异(P>0.05),且未呈现剂量反应关系,表明注射用左旋泮托拉唑钠无诱导CHL细胞染色体畸变作用,体外染色体畸变试验结果判定为阴性。结果见表2。
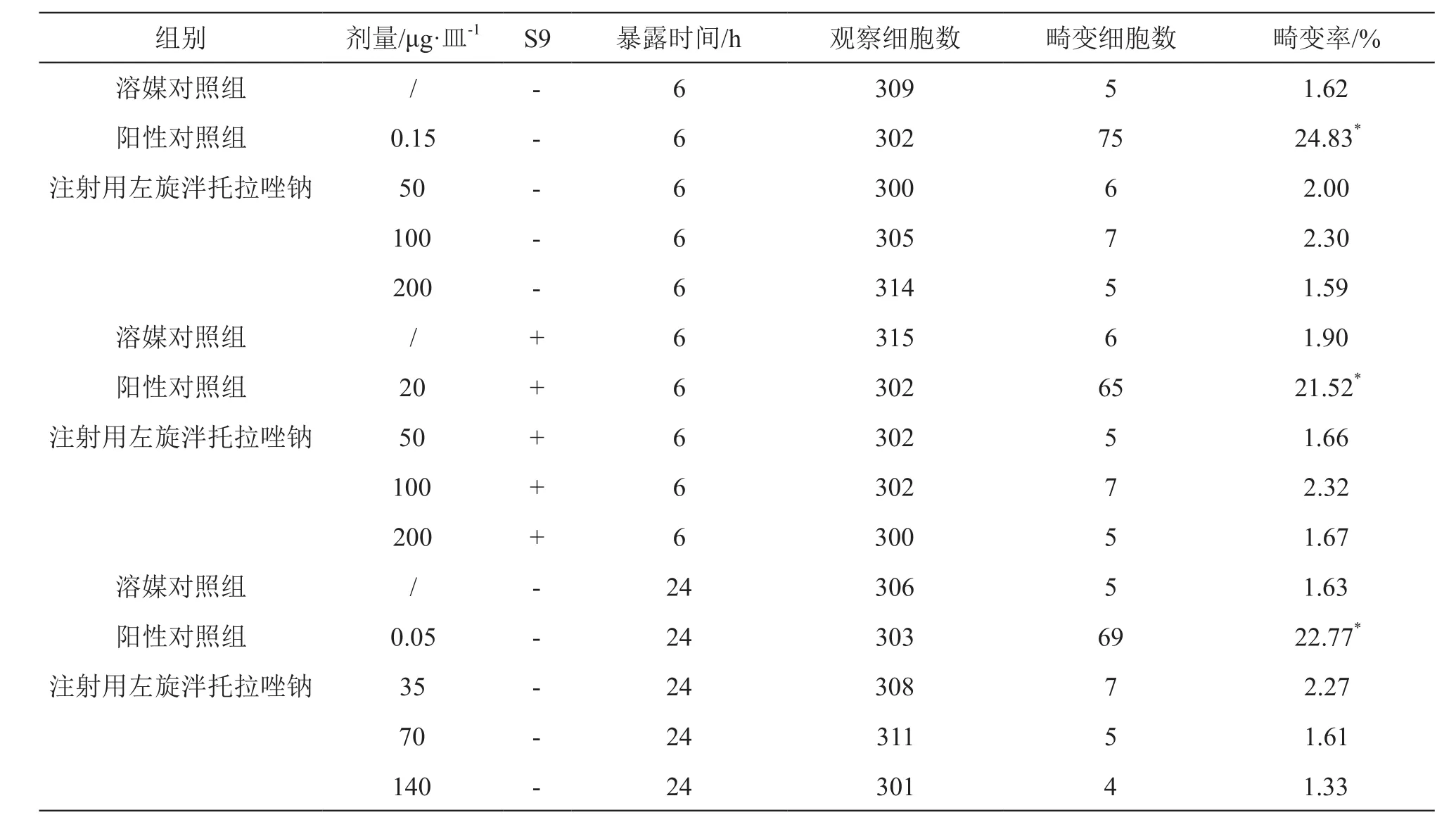
表2 注射用左旋泮托拉唑钠体外染色体畸变试验结果
2.2.3 小鼠体内微核试验 阳性对照组的PCE/(PCE+NCE)比值与溶媒对照组比较无显著性差异(P>0.05),MNPCE高于溶媒对照组,有显著性差异(P<0.05),表明试验系统可靠。35,70,140 mg/kg剂量下,小鼠PCE/(PCE+NCE)比值与溶媒对照组比较,均无显著性增加(P>0.05),表明对骨髓细胞的造血功能未产生抑制作用。各剂量组MNPCE分别与溶媒对照组比较,均无显著性差异(P>0.05),表明注射用左旋泮托拉唑钠在35~140 mg/kg剂量范围内无诱发小鼠骨髓细胞嗜多染红细胞微核率增高的作用,小鼠体内微核试验结果为阴性。结果见表3。
表3 注射用左旋泮托拉唑钠体内微核试验结果( ±s,n=5)

表3 注射用左旋泮托拉唑钠体内微核试验结果( ±s,n=5)
注:*P<0.05 vs 溶媒对照组
组别 剂量/mg·kg-1 PCE/(NCE+PCE) MNPCE/%第一次采样 第二次采样 第一次采样 第二次采样溶媒对照组 / 0.63±0.02 0.62±0.02 0.16±0.05 0.18±0.07阳性对照组 50 0.66±0.03 0.65±0.03 2.56±0.48* 2.43±0.33*注射用左旋泮托拉唑钠 35 0.62±0.02 0.61±0.02 0.18±0.05 0.16±0.04 70 0.64±0.02 0.63±0.03 0.17±0.04 0.19±0.05 140 0.65±0.04 0.64±0.02 0.18±0.07 0.18±0.06
3 讨论
药物遗传毒性研究是药物非临床安全性评价的重要内容,目前我国药物遗传毒性研究技术指导原则推荐遗传毒性试验组合应包含:细菌回复突变试验,哺乳动物细胞体外试验(体外中期相染色体畸变试验或体外微核试验,或体外小鼠淋巴瘤TK基因突变试验)和/或体内试验(微核试验、骨髓中期相细胞染色体畸变试验)。因此,本研究采用Ames试验、CHL细胞体外染色体畸变试验、小鼠体内微核试验3项标准试验组合,体内和体外试验相结合,对注射用左旋泮托拉唑钠遗传毒性进行评价。
本研究的Ames试验,采用国内评价常用的5种菌株TA98、TA100、TA1535、TA97a和TA102[16-17],5种菌株均为氨酸营养缺陷型鼠伤寒沙门菌,对菌株进行基因型、回变菌落数鉴定,鉴定合格后用于试验,根据受试物毒性和评价要求,为充分暴露受试物毒性,采用有一定细菌毒性的剂量作为高剂量,余下以2倍间距设立不同剂量组,同时设立对应的溶媒对照组和阳性对照组,试验在加S9和不加S9 平行条件下,对受试物有无诱导基因突变的作用进行研究。染色体畸变试验,指导原则推荐可采用哺乳动物或人的细胞进行试验。因CHL细胞易在体外建立细胞系,成纤维样贴壁生长,且自发突变率低,便于染色体分析[18],被广泛用于染色体畸变试验,因此体外染色体畸变试验采用CHL细胞。试验前检查细胞核型及有无支原体污染,在不同代谢活化条件、不同染毒时间下对受试物能否诱导染色体损伤进行了研究,同时设立不同试验条件下对应的溶媒和阳性对照组。小鼠体内微核试验选用的昆明小鼠,有较多的背景数据,也是微核试验常用的的动物种属[19-20]。根据评价要求,所采用的高剂量组有一定的毒性症状,如给药后步态不稳、自发活动减少、俯卧不动等,研究了受试物不同剂量下对哺乳动物是否有致微核升高的作用。结果表明,在本实验条件和剂量范围内,Ames试验、CHL细胞体外染色体畸变试验、小鼠体内微核试验,3项试验结果均为阴性,未发现注射用左旋泮托拉唑钠潜在的遗传毒性作用。

