HBV/HCV相关肝细胞癌抗病毒治疗专家共识(2021年更新版)
中华医学会肝病学分会肝癌学组
据世界卫生组织(WHO)的国际癌症研究机构(International Agency for Research on Cancer,IARC)数据显示,在原发性肝癌(primary liver cancer,PLC)中,肝细胞癌(HCC)占比80%以上,PLC的发病率居恶性肿瘤的第6位,死亡率居第3位。2020年,全球有90.57万新发病例,83.02万死亡病例;其中,我国肝癌发病例数占全球的45.27%,死亡数占全球47%[1]。据该机构预测,至2040年,肝癌的新发病例及死亡病例将进一步增加[2]。
乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)感染是HCC发生的重要病原学及疾病进展因素。我国近年发布的《慢性乙型肝炎防治指南(2019版)》[3]和《原发性肝癌诊疗规范(2019版)》均强调了HBV/HCV相关HCC患者管理中抗病毒治疗的重要性。为规范HBV/HCV相关HCC抗病毒治疗在临床实践中的应用,中华医学会肝病学分会肝癌学组多次召开专题讨论会,依据病毒相关HCC 抗病毒治疗的循证医学证据,综合多数反馈专家建议,曾先后制定了《HBV/HCV相关性肝细胞癌抗病毒治疗专家建议(2013年)》[4]和《HBV/HCV相关性肝细胞癌抗病毒治疗专家共识(2014年)》[5]。本版在以往专家建议/共识基础上,对近年新证据结果进行分析,经数十位专家多次会议讨论,最终形成新一版共识更新。本共识主要受众为肝病专科及感染科和这些科室以外从事与肝癌诊疗工作相关的临床医生及社区服务中心、基层医疗机构等相关工作人员。本共识对最终临床决策制定提供具有参考价值的推荐意见,临床实践中尚需结合具体情况综合评价做出临床决策。
本次更新重点从HCC二级/三级预防层面强调抗HBV/HCV治疗对HCC发生或复发的影响。本共识的证据质量和推荐意见分级采用评估、制订和评价(GRADE)分级系统(表1)。
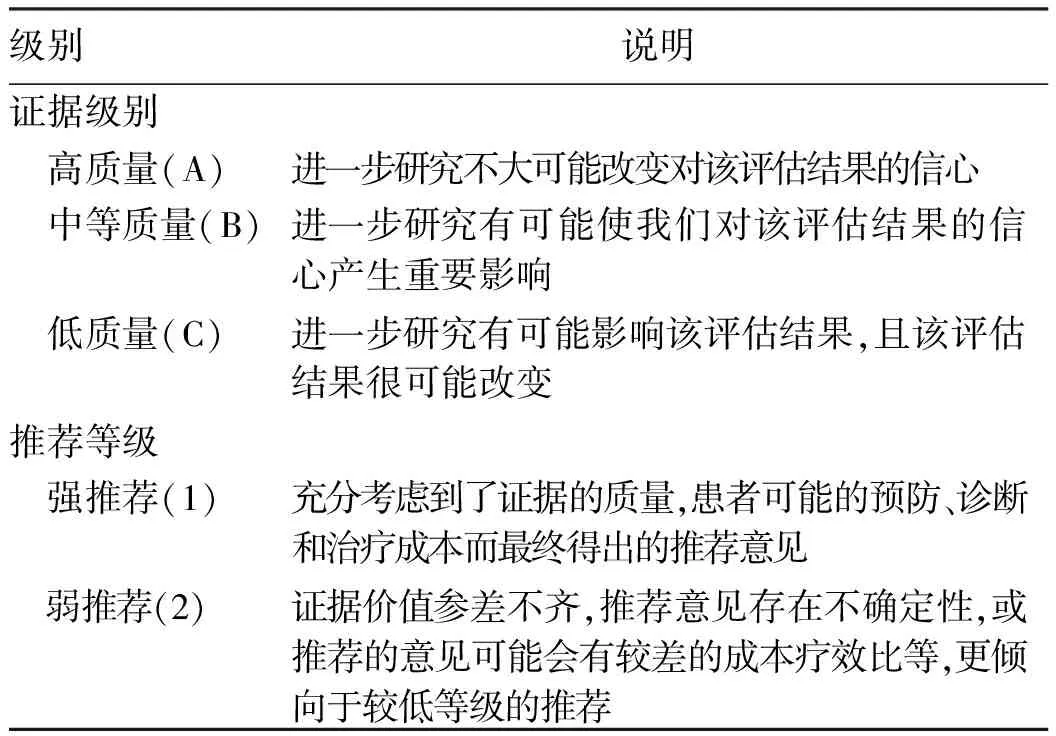
表1 推荐意见的证据等级和推荐等级
在前述共识基础上,本共识采用以下HCC“分级预防”定义:HCC一级预防,防止可导致HCC发生的危险因素对普通人群初始侵害的措施;HCC二级预防,对于已具有慢性肝病背景(本共识主要关注HBV/HCV慢性感染)患者的HCC危险因素所采取的控制措施,目的是减少/延缓HCC发生;HCC三级预防,对已经发生HCC的患者除抗肝癌手术等治疗以外,通过抗病毒治疗等措施,减少HCC复发,保障HCC综合治疗效果,延长患者生存期的措施。
推荐意见1:HBV/HCV慢性感染是发生HCC的重要病因,通过抗病毒治疗将慢性乙型肝炎(CHB)患者体内的HBV复制抑制至最低水平或达到功能性治愈,将慢性丙型肝炎(CHC)患者体内的HCV清除以达到治愈,均可明显减少HCC发生,是HBV/HCV相关HCC二级预防最有效的手段(1A);抗病毒治疗是HBV/HCV相关HCC发生后有效的基础治疗措施之一,可减轻肝炎病毒对肝脏的损害,减轻甚至逆转肝纤维化或肝硬化,延缓肿瘤病情进展,减少HCC复发,保护肝功能,保障其他综合治疗效果,提高总生存率,是三级预防的重要手段之一(1B)。
1 HBV相关HCC
1.1 流行病学及危险因素
HBV感染呈世界性流行,WHO估算全球有约2.96亿慢性HBV感染者;全球每年约有82万人死于 HBV 感染相关疾病,其中HBV相关肝硬化和HCC死亡分别占52%和38%。 2018年数据[6]显示,中国大陆由于HBV感染造成的HCC新发病例高达250 000例,占全球HBV感染造成的肝癌新发病例的69%,CHB患者HCC年龄标准化发病率(ASIR)为11.7/100 000人年,我国HCC由HBV引起的比例高达84%[3]。
CHB患者抗病毒治疗可减少HCC发生。在已知CHB患者发生HCC的风险预测中,肝硬化和高病毒载量是主要的HCC发生危险因素,HCC家族史、饮酒、吸烟、糖尿病等是HCC发生的促进因素。基于患者HCC家族史、HBsAg定量和HBV DNA水平、HBeAg状态等建立REACH-B、mPAGE-B、mREACH-B及aMAP等预测模型[7-10],可协助计算亚洲CHB患者未来进展到HCC的风险比。针对这些危险因素的防控措施中,抗病毒治疗与HBV DNA、HBeAg、HBsAg等危险因素的控制直接相关。按抗HBV应答顺序,CHB患者的抗病毒治疗应达到以下目标:(1)HBV DNA达到检测不到水平;(2)保持丙氨酸转氨酶(ALT)长期在正常范围内;(3)实现HBeAg阳性CHB患者HBeAg阴转/血清学转换;(4)HBsAg水平降低或消失,或HBsAg血清学转换。达到上述指标可将HBV相关HCC的发生率降到最低水平,但仍有部分患者发生HCC,尤其是已进展至肝硬化的患者。
1.2 HBV相关HCC二级预防中的抗病毒治疗
1.2.1 核苷(酸)类似物(NUCs)对HBV相关HCC的二级预防 目前抗HBV药物中NUCs是一类作用机制明确且效果肯定的药物,通过降低CHB患者的HBV载量可以显著降低HBV相关HCC的发生率。在证实拉米夫定(Lamivudine,LAM)对HBV相关HCC的二级预防作用后[11],至今已有大量研究证实NUCs预防HCC的有效性。来自中国的27个研究的Meta分析[12]显示,3165例NUCs治疗的CHB患者和未行抗病毒治疗的10 896例CHB患者对照,HCC的危险因素分别为:高HBV载量、HCC家族史、男性以及未进行抗病毒治疗。系统性回顾总结LAM、阿德福韦酯(Adefovir dipivoxil,ADV)、恩替卡韦(Enticavir,ETV)和替比夫定(Telbivudine,L-dT)等不同种类NUCs对HCC的预防作用,其中包括1个随机对照研究和7个队列研究,证实NUCs的应用可以显著减少HCC的发生[13]。 亚太肝病学会(APASL) 2017年有关肝癌管理的指南[14]指出,CHB患者长期有效的抗病毒治疗可作为HBV相关HCC发生的二级预防措施。本共识中所谓一线NUCs是指现阶段推荐使用的高效高耐药屏障的NUCs,即ETV、富马酸替诺福韦酯(Tenofovir disoproxil fumarate,TDF)、丙酚替诺福韦(Tenofovir alafenamide,TAF)和艾米替诺福韦(Tenofovir amibufenamide,TMF)[15-16]。
ENUMERATE研究[17]回顾了646例CHB患者,其中亚裔540例,肝硬化61例。经过ETV治疗随访4年,共17例被诊断出HCC,8例来自肝硬化组(13.1%),9例来自非肝硬化CHB组(1.5%)。与REACH-B模型预测的HCC发生率相比,非肝硬化ETV治疗组的HCC发生率明显下降,随访4年标准化发生率(SIR)下降63%(SIR=0.37; 95%CI:0.166~0.82);包括肝硬化患者在内的所有患者的灵敏度分析显示,在8.2年的最长随访时间内,HCC发病率明显低于预测,SIR为0.56(95%CI:0.35~0.905)。634例TDF治疗的HBV慢性感染者,其中152例为肝硬化。经过384周的观察随访共有14例(4例在随访第1年)诊断为HCC,其中9例为HBeAg阴性,6例为基线肝硬化患者,12例为男性。与REACH-B模型预测的HCC发生率相比,非肝硬化TDF治疗组的HCC发生率明显下降,384周时下降60%(SIR=0.40; 95%CI:0.199~0.795)[18]。
不同品种的高效高耐药屏障NUCs药物在HCC预防方面是否存在差异?在一项真实世界研究[19]中,355例初治CHB患者经过4年随访共有17例患者诊断HCC,其中7例来自ETV组(183例),10例来自TDF组(172例),2组之间HCC发生率并无差异。另一项研究[20],582例CHB患者,ETV组406例,TDF组176例,平均随访57.1个月,ETV组诊断新发HCC共31例,TDF组7例,两组之间没有统计学差异(P=0.068)。
2019年,韩国发表的大样本国家层面回顾性研究[21]分析了ETV和TDF在预防HCC发生的差异。研究者建立了24 156例的全国队列及2701例的医院队列,结果发现队列中TDF组HCC发病率远低于ETV组(0.64/100人年 vs 1.06/100人年),多因素调整分析结果提示,TDF比ETV可更明显降低HCC的发生(HR=0.61; 95%CI:0.54~0.70)。倾向性匹配(propensity score-matched,PSM)分析结论支持上述说法。同年,来自韩国4所医科大学教学医院的2897例初治CHB患者,分别为ETV组1484例及TDF组1413例。随访后共发生240例(8.3%)HCC,ETV组 1、3和5年HCC累计发生率分别为1.0%、4.8%和 9.3%,TDF组分别为1.0%、4.7%和7.7%,两组比较并无统计学差异(P=0.516);多因素分析得出的两组之间的调整后危险比(adjusted hazard ratio,aHR)为0.975(95%CI:0.747~1.272;P=0.852)。应用PSM和逆处理概率加权法(inverse probability of treatment weighting,ITPW)得出的HR分别为1.021(P=0.884)和0.998(P=0.988),均提示两组之间对于HCC的预防效果没有差别[22]。上述报道在学术界引发热议[23-24]。肝硬化是影响HCC发生的最主要混杂因素,由于所有的研究均为回顾性研究,对CHB患者的肝硬化背景的评判标准可能存在差异,造成研究结果的偏移。近来多数研究报告[25-28]表明,ETV与TDF治疗CHB降低HCC发生率无差异,Choi等[29]最近的Meta分析也支持这种观点。
经过NUCs抗病毒治疗,HBV呈现低水平复制,对HCC发生的影响近年引发关注。根据目前检测手段的不断进展,提出新的HBV检测节点:维持病毒学应答组(MVR)患者HBV DNA水平持续性低于12 IU/mL;低水平病毒组(LLV)患者HBV DNA持续性或间歇性在12~2000 IU/mL波动。通过5年随访,LLV组HCC发生率明显高于MVR组(P=0.016),肝硬化组差异更为明显[30]。对CHB患者的抗病毒治疗应该最好将HBV DNA降到高灵敏度检测方法测不出更好,而非102~103IU/mL这种检测下限。目前,HBV定量中存在一个灰色区域,即在可检测下限(lower limit of detection,LLoD)之上同时又在可定量下限(lower limit of quantification,LLoQ)之下的无法精确定量的部分。在治疗78周的患者如果HBV DNA仍可检测到(20~200 IU/mL),肝纤维化仍呈进展趋势(OR=4.84;95%CI:1.30~17.98;P=0.019),其中部分患者也可进展到HCC[31]。现有LLoD可达5.9 IU/mL(血清)或4.8 IU/mL(血浆),LLoQ可达10 IU/mL,近年来已经出现了灵敏度更高的检测试剂,检测下限更低。临床医师应在临床实践中重视HBV低水平复制,并在适当节点选择高灵敏度检测方法。
NUCs,尤其是目前的一线NUCs在HBV相关HCC的二级预防中发挥重要作用,有充分证据证明,应用NUCs可显著减少HBV相关HCC的发生,如未达到功能性治愈(临床治愈),应坚持有效的长期抗病毒治疗而不要随意停药。
1.2.2 干扰素(IFN)对HBV相关HCC的二级预防 虽然IFN类在抑制HBV DNA复制方面无法与高效高耐药屏障、低副作用的NUCs相比,但其在防治HBV相关HCC方面仍具有独特的作用。近年来有证据表明,IFN类尤其是聚乙二醇IFN(PEG-IFN)可以较NUCs更好的预防HBV相关HCC的发生。
中国台湾地区回顾性队列研究[32]显示,330例治疗前接受肝活检的CHB患者,分别接受PEG-IFN或NUCs治疗,以是否发生HCC为研究终点。抗病毒过程中尽量维持血清HBV DNA低于2000 IU/mL;每3个月检查1次HBV DNA 水平,若发生病毒学突破,则进行序列分析,加用或换用其他有效药物进行挽救治疗。根据年龄匹配的PEG-IFN组和NUCs组各120例,PEG-IFN组HCC发生率低于NUCs组(P=0.031),而且HBV相关肝硬化患者应用PEG-IFN的预防效果更好;在这个基础上,又匹配PEG-IFN组和ETV组各52例,PEG-IFN组HCC发生率明显低于ETV组(P=0.022)。在该研究中,虽然样本量、对比的NUCs种类都存在一定争议,但该研究显示了应用PEG-IFN可以更好地预防HCC的发生。另有回顾性研究[33]纳入1112例CHB患者,IFN组430例,NUCs组682例,应用PSM方式予以配对。结果显示IFN组和NUCs组10年HCC累计发生率分别为2.7%和8.0%(P<0.001);以IFN为基础的治疗较NUCs组HCC的发生率更低(HR=0.15;95%CI:0.04~0.66;P=0.012)。在对HBeAg阳性CHB患者的前瞻性队列观察[34]也证明了这种趋势的存在,研究共纳入444例患者,215例为PEG-IFN组,229例为ETV组,经过PSM配对,2组各119例。结果显示,应用PEG-IFN的CHB患者HCC发生率低于ETV组,尽管无统计学差异(P=0.36),但明显低于REACH-B模型推算出的HCC发生率(P=0.038)。
近年来,回顾性研究和Meta分析提出IFN类,尤其是PEG-IFN可以较NUCs更好地减少HBV相关HCC的发生,但由于应用PEG-IFN的研究病例数远少于NUCs类,该结论需进一步前瞻性研究证实。目前对于PEG-IFN联合NUCs的抗病毒治疗,因经济效益比不显著(除基因型A外),未被主流学会指南推荐。但从HBV相关HCC二级预防角度,一线NUCs降低HBV DNA水平,PEG-IFN降低HBsAg水平,两者联合或序贯治疗在二级预防方面具有较好的经济效益比,未来尚需进一步前瞻性队列研究验证。
1.2.3 抗病毒治疗在HBV相关HCC的二级预防的时效因素
抗病毒治疗在HBV相关HCC的二级预防方面获得了一定的证据支持,但也有研究[35]质疑抗病毒治疗预防作用的有效性。因此,在临床实践中需要有具体可操作指标评估抗病毒治疗对HCC预防的有效性。指标可分为2个部分:预防HBV相关HCC有效的指标和达成这些指标所需的理想时间。
经过抗病毒治疗所要达到的预防HBV相关HCC有效指标可分为2类人群:一是经过治疗达到HBsAg消失或功能性治愈(临床治愈)的少数CHB患者,二是大部分经过治疗后至少获得HBV DNA持续在常规检测下限以下的患者。完成IFN疗程的CHB患者4年后有8%达成HBsAg消失(基因型A型居多);而以ETV或TDF治疗5年的HBsAg消失率很低[36]。如果CHB患者获得HBsAg清除,HBV相关HCC的发生率更低[37],但仍有一定的HCC发生率,而并非完全消除HCC风险。在获得HBsAg消失的CHB患者群中,HCC年发生率仍可达0.55%,其中大于50岁或合并肝硬化患者风险更高[38]。对于未获得HBsAg消失的CHB患者,具体指标以HBV DNA小于LLoD[30]、HBsAg小于1000 IU/mL[39]和ALT低于正常值上限(ULN)[40]作为较为满意的替代指标,长期稳定达到这种程度者HBV相关HCC的发生率较低。由于国内无法出具低于LLoD的报告,也可考虑以高灵敏度的LLoQ为备选指标,以HBV DNA持续小于10~20 IU/mL而不是小于500 IU/mL为预防HCC发生的重要指标之一。近期有研究[41-42]提出HBV RNA水平可以作为肝内炎症、纤维化程度的指标,其可能对HCC的发生发展起作用,尚需要进一步研究。
上述主要指标达成需要一定的时效性,原则上是越早越好。从绝对年龄层面,小于50岁患者更易发生HBsAg清除;在CHB自然史中,相较于肝硬化形成后,HBsAg清除更易发生于慢性肝炎阶段[38]。抗病毒治疗有效时间的差异对HBV相关HCC的预防作用也将产生影响[40]。以ALT复常为指标,在NUCs治疗6个月内即获得ALT复常的CHB患者,HCC发生率显著低于6~12个月、12~24个月、24个月以上的复常组,aHR分别为1.40、1.74和2.45(P<0.001),并且是独立于肝硬化的危险因素。因此,在NUCs治疗的初期12个月ALT复常是减少HCC发生的重要指标[40]。
近年来,前述回顾性研究和极少数前瞻性研究以HCC发生为终点,揭示了PEG-IFN和NUCs的应用能够起到HBV相关HCC的二级预防作用,但证据等级仍有待于提高。在临床实践中,在高覆盖的NUCs治疗中合理选择患者规范联合应用PEG-IFN是目前在探索的方案。通过联合应用抗病毒药物,结合更为严格的监测指标,强调达成替代指标的时效性,必要时及时调整治疗方案,努力使更多的CHB患者切实达到HCC二级预防的目的。
推荐意见2:对CHB患者予以积极有效的抗病毒治疗是防范HBV相关HCC发生的重要二级预防措施(1A)。对于CHB患者的抗病毒治疗,建议选择一线NUCs或PEG-IFN治疗(1A),并根据患者对药物的应答情况及时调整治疗方案。
推荐意见3:对正在进行抗病毒治疗的CHB患者,评估HBV相关HCC二级预防效果的替代指标为:HBV DNA小于高灵敏度检测方法的下限,HBsAg阴转以及ALT长期在ULN以下(2B)。
推荐意见4:对于具有HCC高风险的CHB患者,以一线NUCs为基础进行抗病毒治疗,无PEG-IFN应用禁忌证可考虑PEG-IFN联合NUCs治疗(2A)。对于正在使用NUCs治疗的患者,如未能达到相关指标(HBV相关肝硬化患者在24周内或非肝硬化CHB患者在48周内实现推荐意见3)可考虑换用或合用其他一线抗HBV药物,密切随访,必要时进一步调整优化治疗方案;对于有功能性治愈前景的CHB患者可选择联合PEG-IFN治疗(2A),以增强抗病毒效果,最大程度减少HBV相关HCC的发生。
推荐意见5:对于CHB患者的抗病毒治疗,其主要目标是应尽可能利用目前药物和治疗方案争取达到HBsAg清除,即功能性治愈,进一步降低HCC发生率(1A)。对于通过抗病毒治疗达到HBsAg消失的肝硬化患者(临床治愈),仍需定期随访监测HCC的发生(1B)。
1.3 HBV相关HCC三级预防中的抗病毒治疗
HBV相关HCC的三级预防是指应用综合措施防止HCC复发并延长总体生存期而采取的措施,包括对症治疗和康复治疗。HCC复发分为早期(术后2年内)或晚期复发(术后2年后)。早期复发多由原发灶转移所致,侵袭性肿瘤的血管浸润导致肝内复发或肝癌切除术中肿瘤转移。晚期复发多因肝硬化基础上新发肿瘤所致。
HCC复发的主要宿主因素为:年龄大于40岁、男性、酗酒、基线高甲胎蛋白(AFP)水平、低血小板计数、低白蛋白水平、肝硬化高Child-Pugh评分、初始肿瘤直径大等[14,43]。HBV相关HCC复发的主要病毒学因素为:血清高病毒载量和HBeAg阳性。术前基线血清HBV DNA高载量(>2000 IU/mL,OR=22.3)是HCC术后复发的重要危险因素[44]。HBV相关HCC主要死亡原因除肿瘤因素外,还与慢性肝功能衰竭、消化道出血、肝性脑病等肝病终末期事件相关,而这些肝病终末期事件与HBV复制有关。因此,对于HBV相关HCC患者应用抗病毒治疗不仅有助于降低HCC治疗后复发率,而且有助于保护肝功能,保障其他综合治疗效果,提高患者的总体生存率。
NUCs的应用可能减少HCC复发;IFN类应用并不降低无复发生存率,但可能增加患者总体生存率;对于可以切除病灶的HBV相关HCC患者,以IFN类为基础的抗病毒治疗可以减少HCC复发率且提高生存率。HBV相关HCC患者,若HBsAg阳性,建议应用ETV、TDF、 TAF或TMF进行抗病毒治疗。因此,应重视HBV相关HCC患者综合管理中抗病毒药物的合理应用。
1.3.1 NUCs在HBV相关HCC三级预防中的作用 HBV DNA水平是HCC复发的重要危险因素,应用NUCs抗病毒药物是直接且安全性良好的重要基础治疗。在HCC手术切除、射频消融(radiofrequency ablation,RFA)、肝移植、经肝动脉化疗栓塞术(transarterial chemoembolization,TACE)、放射治疗、分子靶向治疗、免疫治疗以及FOLFOX4方案系统化疗等进行前后均需要给予抗病毒治疗。
HBV相关HCC患者接受根治性治疗后予以抗病毒治疗可以减少HCC复发。Meta分析表明,对可切除HBV相关HCC患者给予抗病毒治疗,NUCs可减少HCC术后复发并改善预后。来自15项研究的8060例患者,NUCs对1年和3年复发有保护性作用,1年复发和3年复发的相对危险度(relative risk,RR)分别为 0.41(95%CI:0.28 ~ 0.61;P<0.000 01)和0.63(95%CI:0.43 ~0.94;P=0.001),5年的总生存期(overall survival,OS)和无疾病生存期(disease free survival,DFS)均明显增高[45]。另一项Meta分析包括9009例患者,其中2546例给予抗病毒治疗,6463例未给予抗病毒治疗,抗病毒治疗可显著提高OS (HR=0.58;95%CI:0.51~0.67;P<0.001)和无复发生存期(recurrence-free survival,RFS)(HR=0.68;95%CI:0.63~0.74;P<0.001);在抗病毒组的亚组分析显示,基线高病毒载量组(>20 000 IU/mL)抗病毒治疗可显著延长OS(HR=0.69;95%CI:052~0.92;P=0.01)和RFS(HR=0.58;95%CI:0.49~0.70;P<0.001),获益度更大[46];在基线低病毒载量组(<20 000 IU/mL)抗病毒治疗对OS和RFS无显著延长。中国大陆地区202例HBV DNA高载量HCC中期患者,手术后分为抗病毒组(LAM)和未抗病毒组。抗病毒组3年和5年OS高于未抗病毒组(P=0.019);抗病毒组1、3、5年RFS高于未抗病毒组(P=0.002);抗病毒组的HCC复发率明显低于未抗病毒组(P<0.01);术后抗病毒可减少HCC复发(HR=0.882; 95%CI:0.712~0.938;P=0.042)[47]。一项早期单中心前瞻性研究[48]证实了抗病毒治疗对HCC复发的影响。研究纳入根治术后200例患者,分为2组,一组给予ADV抗病毒治疗,另一组不予抗病毒治疗。随访发现两组之间1、3、5年的RFS和OS有显著差别(P=0.026和P=0.001)。进一步研究[49]纳入根治术前HBV DNA<2000 IU/mL的HCC患者200例,一组给予L-dT抗病毒治疗,一组不予预防性抗病毒治疗,随访60个月发现两组之间1、3、5年的RFS和OS均有显著差别(P=0.016和P=0.004)。虽然这两个研究应用的NUCs并非目前推荐的一线药物,但属于三级预防中少有的前瞻性研究,为抗病毒治疗在HCC三级预防的作用提供了强有力的临床证据。
目前有证据表明,一线NUCs药物对于HBV相关HCC的三级预防作用更强。607例根治性治疗的HBV相关HCC患者,其中261例为未抗病毒组,90例为非一线药物抗病毒组,256例为一线药物抗病毒组(ETV或TDF)。发现三组的RFS分别为29.4、25.1和88.2个月,一线药物抗病毒组获益度最高(P<0.001, log-rank test)[50]。233例肝硬化背景手术切除的HBV相关HCC患者,107例采用TDF,126例采用ETV治疗,TDF组的DFS明显长于ETV组(P<0.05),多因素研究发现,TDF是降低HCC发生的主要因素(HR=0.35; 95%CI:0.33~0.84)[51],TDF较ETV更好地减少HCC复发。1695例BCLC分级0或A级HBV相关HCC患者,根治术后分别采用ETV(n=813)或TDF(n=882),经过PSM配对后进行多因素分析。结果表明,TDF组较ETV组有更低的HCC复发率(HR=0.82; 95%CI:0.68~0.98;P=0.03)和病死/肝移植率(HR=0.62; 95%CI:0.44~0.88;P=0.01),TDF是HBV相关HCC早期(HR=0.79;P=0.03)或晚期(HR=0.68;P=0.03)复发的独立保护因素[52]。也有研究[53]认为,ETV组和TDF组对于改善HBV相关HCC根治性治疗后预后的疗效无统计学差异。替诺福韦(TFV)类药物是否较ETV更显著降低HBV相关HCC术后复发率尚需更多的大样本临床研究进一步证实。
TACE是HCC常用的非手术治疗方法。TACE治疗可引起HBV再激活的原因主要有[54-55]:(1)化疗药物直接激活HBV DNA复制;(2)化疗药物和栓塞对肝脏局部微环境和免疫产生影响;(3)化疗药物通过血液循环或动-静脉分流到达体循环。HBeAg阳性、高HBV DNA载量以及多次TACE治疗是HBV相关HCC患者HBV再激活的独立危险因素[56-57]。109例HBV DNA<2000 IU/mL的HBV相关HCC患者,23例(21.1%)TACE术后出现HBV再激活,其中HBeAg阳性患者再激活率为55.6%,HBeAg阴性患者为18%(P=0.019)[56]。研究认为,对于可检出HBV DNA且HBeAg阳性的患者,TACE治疗可引起HBV再激活,需要提前/及时抗病毒治疗。98例基线HBV DNA<2 IU/mL的HBV相关HCC患者前瞻性对照研究发现,ETV抗病毒组(51例)HBV再激活率为5.9%,明显低于未抗病毒组(47例)的23.4%(P<0.05)。与HBV无激活组相比,HBV再激活组TACE治疗后5 d ALT、总胆红素水平明显升高(P<0.05)。多因素分析显示,HBeAg阳性、肿瘤数目超过3个、未抗病毒治疗是HBV再激活的关键因素[57]。因此,对于HBV相关HCC,即便基线HBV DNA低于检测下限,仍需积极进行抗病毒治疗。
接受TACE治疗的HBV相关HCC患者,无论病毒载量如何,只要HBsAg可测出,都应给予积极抗病毒治疗,同时需综合考虑患者肝功能状况和肝硬化程度。对肝功能Child-Pugh A级、肝硬化程度较轻的患者,可在TACE治疗的同时进行抗病毒治疗;对肝功能Child-Pugh B级、肝硬化程度较重的患者,建议给予改善肝功能、抗病毒治疗1~2周再行TACE治疗。抗病毒治疗首选一线NUCs,原则上终身服药,切忌随意停药、换药。需加强HBV相关HCC患者TACE治疗后抗病毒治疗管理,及时发现HBV再激活,以保护患者肝功能,减少经化疗栓塞治疗后的肝硬化失代偿事件发生率,减少HCC复发及多源性生长的风险,最终提高患者的总体生存率。
肝移植是HBV相关HCC的根治性治疗手段。一项Meta分析评估了基于给予NUCs方案的肝移植受者的临床结局,并探讨了不同的预防方案,共纳入25项研究(n=2327),HBV复发率为1.01%(95%CI:0.53%~1.59%);HBV病毒血症或丁型肝炎病毒重叠感染对HBV复发无显著影响(P=0.23及0.71)。一线NUCs与乙型肝炎免疫球蛋白(HBIG)无限期联合治疗的复发率低于一线NUCs单药治疗(P<0.001),与一线NUCs联合有限疗程HBIG的复发率相似(P=0.48)。研究认为,有效的NUCs抗病毒治疗提供了令人满意的对HBV抗病毒预防作用,并改善了肝移植受者的长期预后;一线NUCs与HBIG的有限组合是终身双重治疗的替代方案[58-59]。同时,如移植后出现CHB复发,应密切监测HCC复发[60]。
1.3.2 IFN在HBV相关HCC三级预防中的作用 IFNα是较强的免疫调节剂,既具有抗病毒作用,又具有抗肿瘤作用[56,61],因而被推荐用于HCC的综合治疗手段之一[4-5]。
Meta分析[62]证实IFN在HCC系统性治疗中的意义,但并非所有HBV相关HCC患者均可通过应用IFN类而获益,只有HCC确诊时,病灶小于3 cm者可经过附加的IFN类治疗减少HCC复发率(RR=0.50;95%CI:0.35~0.72;P<0.001)。系统性回顾分析[63]结果则认为,IFN类联合TACE使得患者明显获益,但手术切除后应用IFN类并未明显减少复发率和病死率。228例HBV相关HCC患者经手术切除病灶后,再序贯采用TACE(126例)或TACE联合IFN(102例)[64],结果表明联合组较单用TACE组OS明显延长(36.3个月 vs 24.5个月,P<0.05);联合组3年和5年的复发率亦显著低于单用TACE组(P<0.05)。Meta分析[65]对HBV/HCV相关HCC患者辅助应用PEG-IFN的效果进行总结分析发现,PEG-IFN明显提高3年和5年RFS,3年、5年HR分别为0.80(95%CI:0.64~0.99;P=0.04)和0.82(95%CI:0.67~0.99;P=0.04);对于经过根治性手术治疗的患者,应用PEG-IFN者5年OS明显长于未应用PEG-IFN者(HR=0.67;95%CI:0.47~0.97;P=0.03)。前瞻性随机对照研究[66]探讨了PEG-IFN联合ETV对RFS和OS的影响,结果表明,手术切除/RFA术后即应用PEG-IFN联合ETV较1年后联合治疗或单用NUCs有更好的疗效,2年和8年的RFS更长,8年的OS更高(P值均<0.05);术后早期联合治疗组如在48周时HBsAg下降大于1500 IU/mL则具有更低的复发率和病死率。
多项回顾性研究、Meta分析和少数前瞻性研究认为,HBV相关HCC患者综合治疗时辅助应用IFN类可提高患者的生存率,减少HCC早期和晚期的复发,提高患者的OS,但PEG-IFN只能应用于代偿期HBV相关HCC患者,需要掌握好适应证,并积极应对不良反应。将PEG-IFN与高效高耐药屏障NUCs合理联用,有助于提高OS或降低复发,尚需进一步积累前瞻性队列研究证据积累。
推荐意见6:HBV相关HCC患者只要HBsAg阳性,无论HBV DNA是否可检测出,均应立即给予一线NUCs抗病毒治疗(1A)。无PEG-IFN应用禁忌证的患者,术后可应用PEG-IFN联合NUCs治疗(2A),联合治疗可提升OS。
推荐意见7:对肝功能Child-Pugh A级、肝硬化程度较轻的患者,进行TACE治疗的同时应积极抗病毒治疗(1A)。对肝功能Child-Pugh B级、肝硬化程度较重的患者,应根据患者肝功能状态、肿瘤负荷程度给予改善肝功能、抗病毒治疗1~2周再行TACE治疗(2A)。对于手术、放疗、系统性化疗、靶向治疗的HBV相关性HCC患者,参照本推荐意见执行。
推荐意见8:TACE治疗前基线期HBsAg阴性但抗-HBc阳性HCC患者,不建议进行预防性抗病毒治疗(2A)。发生HBV再激活应立即给予抗病毒治疗。对HBsAg阴性但抗-HBc阳性且接受较大强度TACE的HBV再激活高危的患者,必须严密随访监测,以尽早发现HBV再激活并进行抗病毒治疗(1A)。
推荐意见9:对于HBV相关HCC采用肝移植治疗的患者,建议在肝移植前尽早开始应用一线NUCs进行抗病毒治疗(1A)。
2 HCV相关HCC
HCV感染在HCC发生发展中起重要作用,慢性HCV感染将增加患者罹患HCC的风险。近年来,抗HCV治疗已进入直接抗病毒药物(direct antiviral agent,DAAs)时代,无IFN的泛基因型方案目前被认为是HCV抗病毒治疗首选[67]。由此,必然带来HCV相关HCC预防、诊治及临床管理策略的变迁和更新[68]。随着DAAs在我国陆续进入医保,药物可及性显著增加;随之,相关临床实践中的重要问题亟待解决,这不但影响医生与患者治疗策略抉择,也关系到疾病的转归与预后。自DAAs上市以来,其与HCC发生、发展以及转归预后之间的争论引人关注。随着临床及基础研究推进,数据质量的提高,本共识就此进行了更新,旨在提高临床医生对DAAs在HCC患者中应用的认识,带动HCV相关临床实践进步。
2.1 流行病学及危险因素 据WHO统计,2019年全球约有5800万HCV感染者,约29万人死于HCV相关疾病,主要为肝硬化和HCC。全球HCV的流行存在地域性差异,流行率为0.5%~2.3%[69]。用2006年的血清进行调查发现,我国HCV抗体阳性率为0.43%[70]。2015年进行的一项基于模型的研究发现,我国约有980万慢性HCV感染者,感染人数居全球首位[71]。
HCV感染是HCC发生、发展和复发的主要危险因素之一,2018年数据分析显示,21%HCC新发病例及死亡病例归因于HCV感染[6,72-73]。HCV感染者发生HCC的相对风险为未感染者的15~20倍[74-78]。HCV相关HCC多发生在肝硬化基础上,非硬化患者(硬化前阶段)HCC年发生率为0.68%[79],而在HCV相关肝硬化患者中,HCC平均年发病率为1%~4%,亚太地区可达7%[80]。
HCV感染者发生HCC的危险因素包括与人类免疫缺陷病毒(human immunodeficiency virus,HIV) 或HBV合并感染、HCV基因1b型、高病毒载量、男性、高龄、糖尿病、肥胖、长期饮酒、吸烟、黄曲霉毒素B1暴露史等[75,81-85]。
2.2 HCV相关HCC二级预防中的抗病毒治疗
2.2.1 IFN抗病毒治疗对HCV相关HCC的影响 在DAAs上市之前的IFN时代,PEG-IFNα联合利巴韦林方案(PEG-IFNα+RBV,PR)是全球HCV感染者抗病毒治疗的首选方案[67],其中RBV不仅可以显著改善患者对PEG-IFN的应答,还可预防HCV复发[86-89]。PR方案的持续病毒学应答(sustained virological response,SVR)率在我国丙型肝炎患者中为53%~88%[90-100],可降低HCV相关肝炎和肝硬化患者HCC的发生率[101-105]。
在疾病的不同阶段,在以IFN为基础的治疗方案中,与未实现SVR的患者相比,实现SVR后能够降低70%~79%的HCC发生率[106-108]。另外,高龄、合并糖尿病以及饮酒、肥胖等因素都是IFN抗病毒治疗过程中发生HCC的风险因素[107,109]。
丙型肝炎具有较易慢性化且症状不典型等特点,众多患者初诊HCV感染时即已处于肝硬化阶段,限制了IFN的应用。另外,IFN存在不良反应多、成本高、疗效欠佳、用药不便等问题。随着各种DAAs的上市,其优越的抗病毒疗效,较低的不良反应,我国医保政策带动下不断增加的药物可及性等,彻底改变了HCV抗病毒治疗策略,IFN已不再作为HCV感染的一线治疗。
推荐意见10:建议选用DAAs作为治疗HCV感染的一线药物,不再建议应用含有IFN的治疗方案(1A)。
2.2.2 DAAs治疗对HCV相关HCC的影响
2.2.2.1 DAAs治疗对HCV相关HCC发生率的影响 DAAs治疗可有效清除HCV,获得SVR,但DAAs对HCV相关HCC的影响早期争议较大。有研究[110]认为,DAAs治疗可能有潜在提高HCC发生率的风险。但后续大规模系统综述[111]显示,与未接受抗病毒治疗的人群[3.080/100人年(95%CI: 1.535~5.158)]相比,DAAs治疗可明显降低HCC的发病风险[1.269/100人年(95%CI:1.124~1.424)](P<0.001)。
患者接受DAAs治疗或IFN治疗后,进展为HCC的风险是相似的。一项Meta分析[112]显示,在IFN治疗组,HCC发生率为1.14/100人年(95%CI:0.86~1.52),DAAs组为2.96/100人年 (95%CI:1.76~4.96)。但在DAAs治疗组中,肝硬化和门静脉高压患者的比例高于IFN治疗组,对患者人群差异进行调整后,两组间未见显著差异。
为进一步明确不同DAAs治疗方案对HCC发生风险的影响,对33 137例接受不同DAAs治疗方案的患者分析后发现,帕利瑞韦(paritaprevir)/利托那韦(ritonavir)/奥比他韦(ombitasvir)/达塞布韦(dasabuvir)(ProD)方案、索磷布韦(sofosbuvir)单药、索磷布韦/西咪匹韦(simeprevir)以及雷迪帕韦(ledipasvir)/索磷布韦治疗组,其HCC发生率分别为0.95%(82/6289)、1.91% (143/4356)、2.47%(168/3210) 和1.26%(348/19282),经基线校正后显示,不同DAAs方案治疗后HCC发生率无明显差异[113]。常用DAAs种类及用法详见附录1[67,114]。
2.2.2.2 DAAs治疗后发生HCC的危险因素
2.2.2.2.1 DAAs治疗是否获得SVR对HCC发生风险的影响
DAAs能够使大多数HCV感染者实现病毒清除,获得SVR,但仍有少部分患者(1%~15%)达不到这一目标。治疗失败通常与治疗后复发、治疗中病毒学突破及HCV产生耐药相关,DAAs治疗后是否获得SVR对HCC的发生有显著影响[115]。Meta分析[116]显示,在获得SVR和未获得SVR人群中,HCC发生率分别为2.1/100人年(95%CI:1.4~3.4)和9.1/100人年(95%CI:5.4~15.3);与非应答者相比,DAAs治疗获得SVR后可使HCC发生风险下降78%(P<0.01)。SVR可使非肝硬化患者发生HCC的风险降低70%~80%,还可使不同阶段的肝硬化患者发生HCC的风险降低50%~78%[117]。
2.2.2.2.2 肝硬化对DAAs治疗后HCC发生率的影响 不同阶段HCV相关肝硬化人群中,Child-Pugh A级治疗后获得SVR者HCC发生率为41/1952(2.1%),未获得SVR者为5/83(6.6%);Child-Pugh B级治疗后获得SVR者,HCC发生率为15/189(7.8%),未获得SVR者为3/25(12.4%)[118]。一项纳入62 354例患者的研究[119]显示,治疗失败的肝硬化人群中,HCC发生率最高(3.25/100人年);在获得SVR的肝硬化人群、治疗失败的非肝硬化人群及获得SVR的非肝硬化人群中,HCC的发生率分别为1.97/100人年、0.87/100人年和0.24/100人年。多项大规模研究[119-120]显示,经DAAs治疗后,HCV相关肝硬化人群获得SVR的概率为93%~95.2%,发生HCC的概率为3.8%~6.0%。
2.2.2.2.3 影响DAAs治疗后HCC发生风险的其他因素 既往无HCC病史的慢性HCV感染者,经治疗获得SVR后的HCC发生率为1.3%(0.9%~7.4%);既往有HCC病史的患者经DAAs治疗获得SVR后,其HCC复发率仍高达29.6%(17.1%~71.6%)[121-127]。既往有HCC病史者,在DAAs治疗期间和治疗结束后,均应警惕HCC复发。
其他DAAs治疗后发生HCC的因素还与性别、年龄、饮酒以及糖尿病等有关,其中男性、高龄、长期饮酒者及糖尿病患者发生HCC的危险相对较高[118,122,128]。
2.2.2.3 DAAs治疗后仍需监测HCC的发生 DAAs治疗获得SVR的患者,在治疗结束后仍有进展为HCC的风险。已获得SVR的肝硬化患者每年发生HCC的概率为1.39%[70]。现有证据[71]表明,对DAAs治疗后的患者进行HCC监测有利于降低病死率。凡具有HCC高危风险因素的慢性HCV感染者,无论DAAs治疗后是否获得SVR,均建议至少每隔3~6个月检查一次肝脏超声和血清AFP等肿瘤标志物。
推荐意见11:DAAs治疗后获得SVR可显著降低HCV相关HCC的发生风险。对既往有肝硬化或有HCC病史的慢性HCV感染者,无论是否获得SVR,均应进行HCC监测,推荐肝脏超声联合血清AFP检查,至少每隔3~6个月1次(1A)。
2.3 HCV与HIV或HBV合并感染
2.3.1 HCV-HIV合并感染 全球范围内,约有230万HCV-HIV共感染者,在HIV感染者中,HCV合并感染的全球流行率为6.2%[129],我国Meta分析的流行率为24.7%(95%CI:19.3~30.5)[130]。HCV-HIV合并感染被认为是 HCV相关肝病(如肝纤维化或终末期肝病)进展的危险因素[67,131-132],即使应用抗逆转录病毒治疗(antiretroviral treatment,ART)实现HIV病毒学抑制后,患者死亡风险仍较高[133]。相比于HCV单独感染,关于HCV-HIV共感染对HCC发生风险的影响尚存争议[134-140]。自2014年以来,HCV-HIV合并感染者被WHO列为优先治疗人群[134]。与HCV单一感染相比,HCV-HIV合并感染人群的DAAs治疗方案相同且应答率相似[67,141-144]。
2.3.2 HCV-HBV合并感染 约1%~15%的HCV感染者伴随HBV感染[145-146],亚洲国家更为常见[122]。2016年,全国多中心调查显示,我国HCV感染者中HBsAg阳性率为4.11%[147]。HCV与HBV两种嗜肝病毒的合并感染更易导致肝硬化、肝脏失代偿或HCC[148-151],对HCC发生风险具有叠加效应[150]。HCV-HBV合并感染时,HCV通常占主导地位,HBV DNA多处于低复制水平或低于检测值[67,142,145]。DAAs有效抑制HCV后,HBV再激活现象已成为重要临床事件[122,152]。对即将接受DAAs治疗的患者应开展有关HBV感染证据的筛查,明确是否存在HBsAg阳性或单纯抗-HBc阳性[153]的HBV感染,并在DAAs治疗期间进行管理。考虑到HBsAg阳性患者的安全性,建议在DAAs治疗之前对HBV进行预防性治疗,直到DAAs治疗结束后3个月[67,134,142,154]。对于单纯抗-HBc阳性的HBV感染者,尽管HBV再激活的可能性较低[155],在DAAs治疗期间仍需监测ALT、HBsAg及HBV DNA水平,必要时开始抗HBV治疗[122,156-157]。HCV-HBV合并感染者与HCV单一感染者的DAAs治疗方案相同[67,142,154],少数研究提示其SVR率未受影响[156,158]。
推荐意见12:所有拟接受DAAs治疗的HCV感染者,需在治疗前筛查是否存在HBV感染,并根据病史决定是否需要筛查HIV(1A)。
推荐意见13:HCV-HIV或HCV-HBV合并感染者,DAAs治疗方案与HCV单一感染相同且疗效相当,具体药物详见附录1。对于同时符合HBV抗病毒治疗标准的患者,可给予相应的HBV抗病毒治疗,可选择ETV、TDF、TAF或TMF等一线治疗药物(1A)。
推荐意见14:如HBsAg阳性但HBV DNA检测不出,建议在DAAs治疗开始前对HBV进行预防性治疗,至少持续到DAAs治疗结束3个月后。对于单项抗-HBc阳性而HBV DNA阴性的HCV感染者,需监测氨基ALT、HBsAg及HBV DNA水平,必要时应及时启动抗HBV治疗(1B)。
2.4 HCV相关HCC三级预防中的抗病毒治疗
由于大多数临床试验未纳入HCC患者,有关DAAs治疗HCV相关HCC获得SVR以及HCC复发风险的数据主要来自回顾性队列和真实世界研究。多数研究表明,与未发生HCC或已发生HCC后但接受了肝移植的HCV感染者相比,现患HCC的HCV感染者应用DAAs治疗后的SVR率相对较低[159-161]。在接受不含IFN的索磷布韦方案治疗后,总SVR12高达93%,而HCC患者的SVR12仅为82%[162]。在一项纳入421例HCV相关肝硬化患者的研究[163]中,33%病例具有活动性HCC或HCC病史。DAAs治疗后,不合并HCC的肝硬化患者SVR为88%,而合并HCC为79%,两组数据存在统计学差异。在未获得SVR的HCC患者中,93%存在活动性肿瘤。多变量分析显示,活动性肿瘤是DAAs治疗失败的危险因素。HCC缓解后,DAAs疗效类似于不伴HCC患者[164]。
对于发现时即为HCV相关HCC的患者,HCC根治性治疗(包括外科手术、局部消融、肝移植及立体放疗等)后再行DAAs治疗,可提高SVR,同时,HCC复发风险降低,总体生存率提高[165]。Meta分析[166]显示,与未行抗病毒治疗相比,接受DAAs治疗能够降低60%的HCC复发风险(OR=0.4;95%CI:0.26~0.61)。对来自美国及亚洲多中心的1676例HCV相关HCC患者进行回顾性分析,其中1239例患者未接受抗病毒治疗,437例患者接受DAAs治疗后获得SVR;结果表明,接受 DAAs治疗获得SVR患者,5年生存率显著提高(87.78% vs 66.05%,P<0.001);获得SVR可降低63% 5年全因病死率及66%肝脏相关病死率[167],接受DAAs治疗能够使HCV相关HCC患者获益。
2.4.1 接受HCC根治性治疗的HCV相关HCC患者的抗病毒治疗
2.4.1.1 DAAs对接受手术切除及消融治疗的HCV相关HCC患者肝癌复发的影响 虽然IFN可降低HCV相关HCC行外科手术切除后的复发率和病死率[168-170],但由于副作用等原因,HCC患者行外科手术后接受IFN治疗的比例不足10%(213/2237)[171],DAAs的出现为这类人群的治疗提供了新方法。然而,早期3项研究[123,172-173]发现,经过DAAs治疗后有相当高比例的患者出现HCC复发,引发广泛关注及争议。肝内HCC复发一般分为早期(1~2年以内)复发和非早期(2年以上)复发。早期复发通常是原发癌的微观转移或先前治疗过的癌灶局部复发。非早期复发归因于潜在肝硬化导致的多中心致癌过程[174]。有研究[175]认为,HCV的清除可以改善肝功能并延长HCC患者的生存时间,虽然也可以降低HCC的复发率,但降低的比例并不乐观。其可能原因为DAAs无法抑制已经形成的癌前病变发展为恶性肿瘤,因此无法降低HCC的早期复发率。在DAAs治疗的起始时期已经有潜在的HCC发生,造成DAAs治疗后HCC的早期复发率较高这一假象[123,176]。
越来越多的研究证实,DAAs不会加速HCC外科切除术后的复发甚至可以降低HCC复发率。欧洲一项纳入47例患者平均随访时间为21.5个月的研究[177]表明,DAAs治疗可以降低HCC复发风险(HR=0.894;95%CI:0.827~0.965;P=0.004)。一项回顾性队列研究[178]显示,外科切除术后接受DAAs治疗的患者和未经治疗的患者HCC复发的中位时间分别为17.4个月和10.1个月,同时两组间HCC复发率存在显著差异(73.3% vs 47.8%)。与未治疗相比,DAAs治疗组和IFN治疗组5年累计HCC复发率基本一致,分别为54.2%和45.1%(P=0.54)[121]。
局部消融是HCC根治性治疗常用的方法。迄今,只有一项回顾性研究单独纳入接受消融治疗后给予DAA治疗的HCV相关HCC患者。该研究共纳入926例接受RFA治疗后的HCV相关HCC患者,分为DAAs治疗组(27例)、IFN治疗组(38例)及不行抗病毒治疗组(861例),这三组的1年和2年的HCC累计复发率分别为21.1% vs 26.3% vs 30.5%和29.8% vs 52.9% vs 61.0%[179]。该研究提示,RFA治疗后,DAA治疗的复发风险不高于IFN组和未行抗病毒治疗组。
来自北美的一项793例HCV相关HCC患者回顾性队列研究[180]纳入107例RFA治疗后接受DAAs治疗的患者,157例RFA治疗后未接受抗病毒治疗。结果显示,DAAs治疗与HCC复发(HR=0.92;95%CI:0.59~1.44)或早期HCC复发(HR=0.99;95%CI:0.54~1.81)无关,且还可以显著降低死亡风险。对177例经包括RFA(81例)治疗后HCV相关HCC患者进行分析表明,接受DAA治疗的HCV相关HCC患者HCC复发率显著降低(HR=0.353;95%CI:0.191~0.651)[125]。
DAAs治疗可降低HCC根治性治疗后的死亡风险,提高总体生存率。包括31个国家的多中心队列研究证实,DAAs治疗可降低HCC患者全因死亡率。其中接受DAAs治疗的患者941人年(接受RFA 138例)中,死亡43例;未接受DAAs治疗的患者526.6人年(接受RFA治疗130例)中,死亡103例(粗率比0.23;95%CI:0.16~0.33)。在逆概率加权分析中,DAAs治疗与死亡风险显著降低相关(HR=0.54;95%CI:0.33~0.90)[165]。
2.4.1.2 手术切除及局部消融治疗的HCV相关HCC患者接受DAAs治疗的时机 美国胃肠病学会建议HCC行肝切除或消融治疗后完全缓解的患者需接受DAAs治疗,治疗时间可在术后4~6个月后。延迟DAAs治疗可以延长现有微小HCC克隆的免疫监视时间,还可以创造更长的时间以验证HCC是否完全缓解,从而最大限度地减少错误分类的机会[117]。一项纳入1820例HCV相关HCC患者(接受局部消融515例)的Meta分析[181]提示,至少在肿瘤完全缓解后6个月开始DAAs治疗。德国肝癌联盟也建议,HCV相关HCC患者接受根治性治疗后最早术后6个月接受DAAs治疗[182]。目前,仅有一项研究单独探讨接受RFA的HCV相关性HCC患者DAAs治疗时机,研究发现,HCC行RFA治疗与接受DAAs治疗的间隔时间是抗病毒治疗后HCC复发的唯一预测因子(OR=0.3;95%CI:0.03~0.64;P=0.01)[183]。
2.4.1.3 手术切除或局部消融治疗的HCV相关HCC患者DAAs治疗方案的选择 对于术后肝功能尚可(MELD评分<18~20分)的HCV相关代偿期HCC肝切除术后患者,应行DAAs治疗,治疗方案可参考中国《丙型肝炎防治指南(2019年版)》[68]实施;如术后肝脏失代偿或术前曾有肝脏失代偿病史,建议给予不含蛋白酶抑制剂的DAAs治疗方案。
推荐意见15:手术切除及局部消融等根治性治疗的HCV相关HCC患者接受DAAs治疗可降低肿瘤复发风险,降低死亡风险,提高总体生存率。在HCV相关HCC根治性治疗后4~6个月肿瘤无复发,可开始DAAs治疗(2B)。
推荐意见16:对于HCC根治性治疗后肝功能尚可(MELD评分<20分)的代偿期患者,可行DAAs治疗,可选择泛基因型方案或基因特异型方案;如肝脏失代偿(MELD评分≥20分)或治疗前曾有肝脏失代偿病史,建议给予不含蛋白酶抑制剂的治疗方案,可首选泛基因型DAAs[如索磷布韦(Sofosbuvir)联合维帕他韦(Velpatasvir)等](2B)。具体用药及用法详见附录1~3。
2.4.2 接受肝移植的HCV相关HCC患者的抗病毒治疗
2.4.2.1 DAAs治疗肝癌复发的影响 关于DAAs在接受肝移植的HCV相关HCC患者中的疗效,尤其是有关HCC复发风险的研究较少,存在争议。一项回顾性研究[184]纳入了81例接受肝移植的HCV相关HCC患者,其中18例患者移植前接受了DAAs治疗。与未接受DAAs治疗的患者(6/63,9.5%)相比,移植前接受DAAs治疗的患者其HCC复发风险(5/18,27.8%)呈现更高趋势,且在DAAs治疗组复发的5例患者中均观察到肿瘤肝外转移。虽因样本量过小,此结果无统计学意义(P=0.06),但仍引起了广泛关注。随后,Donato等[185]纳入35例接受移植前DAAs治疗的HCC患者,在移植术后20个月的随访时间内,HCC复发率仅为8.5%(3/35),认为移植前行DAAs治疗不会增加术后HCC复发的风险。两项研究之间的结果差异可能来源于更大的样本量(35 vs 18)及更高的SVR率(94% vs 50%)。法国一项多中心前瞻性研究[186]分析了314例在移植后接受DAAs治疗的HCV相关HCC患者,其12周SVR率为96.8%。肝移植后中位随访时间为70.3个月,共观察到7例HCC复发,复发率仅为2.2%。该项结果提示,肝移植后给予DAAs治疗,可获得较高的SVR率及较低的HCC复发率。
Gorgen等[187]进行了一项回顾性多中心研究,该研究纳入875例HCV相关HCC肝移植患者,分为移植前DAAs治疗组(121例)、移植前IFN治疗组(112例)、移植后DAAs治疗组(395例)、移植后IFN治疗组(105例)、未接受抗病毒治疗组(142例)。中位随访时间分别为2.1年、2.9年、4.5年、7.8年和2.7年。分析结果显示移植前DAAs治疗组、移植前IFN治疗组、未行抗病毒治疗组HCC复发率分别为 6.6%、15.2%、28.2%(P<0.001)。5年无复发生存率分别为93.4%、84.8%、73.9%(P<0.001)。移植后DAAs治疗组、移植后IFN治疗组和未行抗病毒治疗组的HCC复发率分别为6.3%、11.4%、282%。经过多变量回归分析提示,无论移植前或移植后,应用抗病毒治疗均可减少HCC复发风险。
2.4.2.2 DAAs治疗的时机 国际肝移植学会关于肝移植候选人中丙型肝炎管理的共识声明(2017年)[188],推荐移植等待名单中的HCV相关代偿期肝硬化合并HCC患者,可术前给予DAAs抗病毒治疗;HCV相关失代偿期肝硬化合并HCC患者,若在短时间内(3~6个月)不接受肝移植,应进行抗病毒治疗。反之,则建议将抗病毒治疗推迟到移植术后。欧洲肝病学会关于丙型肝炎治疗建议(2018年)[105]则指出,HCV相关HCC患者,若无合并肝硬化或处于代偿期肝硬化,移植前行抗病毒治疗可减少移植后HCV复发及移植术后并发症的风险,而移植后行抗病毒治疗获得SVR的可能性更高。美国胃肠病学会的DAAs治疗慢性丙型肝炎与HCC临床专家共识(2019)推荐指出,HCC的存在与DAAs治疗后获得较低的SVR相关。接受肝移植的HCC患者的DAAs治疗时机应综合考虑中位等待时间、是否使用HCV阳性器官以及肝功能异常的程度。相比移植后DAAs治疗,移植前用药具有改善肝功能[189-190]、预防移植后HCV复发[191]、避免移植后可能出现的药物相互作用等优势,而其可能存在HCC复发率升高、SVR率降低等弊端,但尚缺乏充足的证据。
2.4.2.3 DAAs治疗方案的选择 对于治疗方案的选择,应综合考虑患者移植时间、肝功能、HCV基因型、供受体HCV感染情况、合并用药等多个因素。
基于国内外指南[67,105],若患者于移植前行DAAs治疗,且为无肝硬化或代偿期肝硬化,首先推荐泛基因型方案索磷布韦/维帕他韦 (Sofosbuvir/Velpatasvir)或格卡瑞韦/派仑他韦(Glecaprevir/Pibrentasvir),或适合HCV-1、4、5、6基因型的索磷布韦/雷迪帕韦(Sofosbuvir/Ledipasvir),治疗时间为12周。当患者为失代偿期肝硬化时,推荐索磷布韦/维帕他韦+利巴韦林(Sofosbuvir/Velpatasvir+RBV,泛基因型)或索磷布韦/雷迪帕韦+利巴韦林(Sofosbuvir/Ledipasvir+RBV, 1、4、5、6基因型)方案治疗12周。若有RBV禁忌证或无法耐受时,可仅使用索磷布韦/维帕他韦 (Sofosbuvir/Velpatasvir)或索磷布韦/雷迪帕韦(Sofosbuvir/Ledipasvir),但需将疗程延长至24周。
若患者于移植术后行DAAs治疗,需关注供受体HCV感染情况。对于HCV RNA阳性的受体,无论供体HCV RNA阳性或阴性,术后均应重新测定HCV基因型以指导抗病毒治疗,方案同上。对于HCV RNA阴性的受体,若接受抗HCV阳性但HCV RNA阴性的供体,术后检测HCV RNA阳性,需按上述方案抗病毒治疗。若接受HCV RNA阳性的供体,其移植后早期和严重疾病的风险暂未知,建议术后重新测定基因型,按上述方案早期抗病毒治疗[188]。
推荐意见17:对于肝功能尚可(MELD评分<20分)、等待移植时间较长的HCC患者,可考虑于移植前行DAAs治疗。对于肝功能不佳(MELD评分≥20分)、等待移植时间较短的HCC患者,可将DAAs治疗推迟至移植术后。治疗方案的选择需根据移植时间、肝功能、HCV基因型、供受体HCV感染情况、合并用药等因素综合考虑(2B)。
2.4.3 接受TACE治疗的HCV相关HCC患者抗病毒治疗 一项病例对照研究[192]探究了DAAs治疗对71例(26例接受过TACE治疗)治疗后处于完全缓解状态的HCV相关HCC患者的复发情况,结果表明,DAAs对于HCV相关HCC患者的肝癌复发没有影响(41% vs 35%,P=0.790 4)。DAAs治疗HCV不会加速HCC复发,但对早期复发没有预防作用。
来自北美的队列研究[180]中包括793例(360例接受过TACE治疗)HCV相关HCC患者,其中304例(107例接受过TACE 治疗)接受DAAs治疗,489例(253例接受过TACE治疗)未接受抗病毒治疗。结果提示,DAAs治疗与HCC复发(HR=0.90;95%CI:0.70~1.16)或早期HCC复发(HR=0.96;95%CI:0.70~1.34)无关。同年该团队[165]在加拿大开展了另一项包括接受手术、TACE等治疗的797例(358例接受过TACE治疗,56例接受过立体放疗等其他治疗)HCV相关HCC患者的队列研究,结果表明,DAAs治疗与显著降低的死亡风险相关(HR=0.54;95%CI:0.33~0.90),且这种相关性因DAAs治疗后是否达到SVR而不同;DAAs治疗后能够降低取得SVR患者的死亡风险(HR=0.29;95%CI:0.18~0.47),但不能降低非SVR患者的死亡风险(HR=1.13;95%CI:0.55~2.33)。一项回顾性队列研究[193]纳入425例接受TACE治疗的HCV相关HCC的患者,与使用IFN和未进行抗病毒治疗相比,DAAs治疗能够降低肿瘤进展风险(HR=0.630;95%CI:0.411~0.966)及死亡风险(P=0.042)。另一项对97例接受TACE或放疗的HCC患者进行的回顾性队列研究[194](94例接受过TACE治疗)表明,接受抗HCV治疗可提高行HCC治疗后达到完全缓解状态的患者的OS(HR=0.244;95%CI:0.075~0.788)。在早期行TACE的HCV相关HCC患者中,接受DAAs治疗与未行HCV抗病毒治疗相比,HCC复发率降低,RFS延长(18.6% vs 72.7%,P=0.002;44个月 vs 11.5个月,P=0.002)[195]。
推荐意见18:接受TACE治疗的HCV相关HCC患者,给予DAAs抗病毒治疗可以降低死亡风险,提高OS;降低已经获得完全缓解患者的 HCC复发风险(2B)。
2.4.4 HCV相关晚期HCC患者的抗病毒治疗 美国肝病学会[196]建议HCV感染的成年人,除了那些预期寿命短且无法治愈的患者,均应给予抗病毒治疗;晚期HCV相关HCC患者,如非预期生存期短且无法补救,应进行DAAs抗病毒治疗。目前,有关DAAs治疗在HCC免疫治疗及靶向治疗患者中的应用数据有限,未来依据研究推进情况将进一步补充及更新。
在发生HCC之前治疗HCV是最佳策略,即HCV相关HCC二级预防证据较之现有三级证据更有利于达成共识。对于已发生HCC、并可进行根治性治疗的HCV感染者,将DAAs治疗时机推迟到抗肿瘤治疗使得HCC完全缓解后进行,可能会提高SVR率。对于已列入肝移植名单的HCC患者,DAA治疗的时机应根据具体情况来确定,并结合所在地区的中位等待时间、HCV阳性器官的可用性和肝功能障碍的程度。在中晚期HCC患者中,SVR相对较低,与早期HCC患者相比,HCC相关死亡率的风险较高。目前还没有足够的数据来评估DAA治疗在这些患者中的获益及成本效益。对于活动性HCC患者是否给予DAAs治疗,应综合考虑肿瘤负荷、HCC治疗获得完全应答的可能性、肝功能障碍程度、总体预期寿命以及患者的治疗意愿等。
DAAs治疗在HCC三级预防中的应用尚有诸多问题有待明确。但毋庸置疑,DAAs的成功治疗可减轻肝纤维化、降低门静脉高压和改善肝功能,而上述变化通常是HCC完全缓解和未治疗的HCV感染者死亡的主要驱动因素。尽管目前支撑证据数据质量有待提高,但对于大多数HCC患者,DAAs治疗的受益通常超过了潜在缺点,这为其在此类患者中的应用提供了依据。

附录1 丙型肝炎DAAs的分类[67,114]

附录2 初治或PRS经治的无肝硬化HCV感染者治疗方案[67]
共识起草小组成员:牛俊奇(吉林大学第一医院),江家骥(福建医科大学附属第一医院),叶胜龙(复旦大学附属中山医院,海军军医大学东方肝胆外科医院),董菁(福建医科大学附属第一医院),高沿航(吉林大学第一医院),刘嵘(复旦大学附属中山医院),周伟平(海军军医大学东方肝胆外科医院),黄罡(海军军医大学东方肝胆外科医院),曾昭冲(复旦大学附属中山医院),于乐成(东部战区总医院)
执笔人:董菁(福建医科大学附属第一医院),高沿航(吉林大学第一医院),刘嵘(复旦大学附属中山医院),黄罡(海军军医大学东方肝胆外科医院)
编写组专家(按姓氏笔画排序):于乐成(东部战区总医院),马雄(上海交通大学医学院附属仁济医院),万谟彬(海军军医大学附属长海医院),牛俊奇(吉林大学第一医院),王伽伯(解放军总医院第五医学中心),王炳元(中国医科大学附属第一医院),叶胜龙(复旦大学附属中山医院,海军军医大学东方肝胆外科医院),孙剑(南方医科大学南方医院),庄辉(北京大学医学部),任红(重庆医科大学附属第二医院),江家骥(福建医科大学附属第一医院),刘景丰(福建医科大学孟超肝胆医院),刘嵘(复旦大学附属中山医院),华海清(东部战区总医院全军肿瘤中心),朱康顺(广州医科大学附属第二医院 ),陈成伟(海军军医大学九〇五医院),陈敏山(中山大学肿瘤防治中心),陈煜(首都医科大学附属北京佑安医院),张大志(重庆医科大学附属第二医院),张德智(吉林大学第一医院),杨震(山东第一医科大学附属省立医院),范建高(上海交通大学医学院附属新华医院),周伟平(海军军医大学东方肝胆外科医院),郑琦(福建医科大学附属第一医院),段钟平(首都医科大学附属北京佑安医院),南月敏(河北医科大学第三医院),侯金林(南方医科大学南方医院),赵景民(中国人民解放军第三〇二医院),荚卫东(中国科学技术大学附属第一医院),胡鹏(重庆医科大学附属第二医院),贾继东(首都医科大学附属北京友谊医院),徐小元(北京大学第一医院),唐红(四川大学华西医院),高沿航(吉林大学第一医院),郭武华(福建医科大学孟超肝胆医院),谢雯(首都医科大学附属北京地坛医院),黄罡(海军军医大学东方肝胆外科医院),曾昭冲(复旦大学附属中山医院),曾争(北京大学第一医院),董菁(福建医科大学附属第一医院),温晓玉(吉林大学第一医院),鄢和新(上海交通大学医学院附属仁济医院)>

附录3 初治或PRS经治的代偿期肝硬化HCV感染者治疗方案[67]
利益冲突声明:牛俊奇曾经担任BMS、GSK、Gliead、默沙东、诺华、艾伯维、罗氏、凯因科技、豪森、圣和、东阳光、歌里等企业的新药临床注册研究,企业临时顾问或卫星会讲者。江家骥曾经担任过GSK、诺华、Roche、歌礼、Janssen的临时顾问,曾经或目前仍为BMS、GSK、Bayer、Novartis、Gilead、Roche、MSD、特宝等公司的讲者。叶胜龙曾参与Bayer、Sanofi公司新药临床试验及AstraZeneca、BMS、GSK、Merck、Novartis、Pfizer、SciClone等公司咨询,均与本项目无利益冲突。其他共识起草小组成员与本共识制定相关的企业及个人均无利益冲突。
志谢:特别感谢庄辉院士对本版共识提出的建设性及指导性意见和建议。感谢中华医学会肝病学分会肝癌学组第3届和第4届全体委员完成函审以及对本版共识提出的宝贵意见和建议,提出意见和建议的专家均列入了讨论专家名单。感谢兰州大学世界卫生组织指南实施与知识转化合作中心陈耀龙教授在指南编写方法上给予指导。
感谢吉林大学第一医院图书馆伦志军研究员在文献检索方面给予指导。吉林大学第一医院博士和硕士研究生:张明媛,高修竹,刘旭,刘丽莉,马鹤铭,王畅,湛梦茹,刘宇维,朱琦,朱倩,任天弈,李腊梅,李杰,马振华,赵天业参加了文献检索,赵天业提供了文献检索和方法学的辅导,在此也特别致谢。
华夏肝脏病学联盟和《临床肝胆病杂志》编辑部提供了少量资金赞助。多次讨论会议是在华夏肝脏病学联盟举办的学术会议期间进行或以网络会议方式举行。正大天晴药业集团在最初两次讨论中给数位专家提供了差旅费,后期根据指南编写原则,退出了赞助。编写人员均无劳务费用。
本共识已在国际实践指南注册平台注册,注册号:IPGRP-2021CN269。

参考文献见二维码

