综合医院金黄色葡萄球菌感染分布和耐药特征研究*
韩 飞,张帅帅
(重庆大学附属三峡医院医学检验科,重庆 404000)
金黄色葡萄球菌(SAU)是临床常见致病力强的病原菌,可引起血流感染、皮肤软组织感染及全身各脏器感染[1]。耐甲氧西林SAU(MRSA)是SAU的一个独特菌株,自1961年英国学者JEVONS首次报道至今感染已遍及全球,MRSA具有广谱耐药性[2],临床治疗棘手[3]。为了解本院SAU和MRSA 最新的耐药情况,本研究对本院住院患者标本中分离的1 532株非重复株SAU的分布及耐药性进行了分析。加强SAU,尤其是MRSA耐药性监测,对有效预防和治疗该菌引起的医院内感染非常重要。
1 材料与方法
1.1材料
1.1.1菌株来源 收集2017年1月至2020年12月本院各临床科室住院患者送检的各种标本中培养出的SAU 1 532株,按保留同一患者相同标本分离相同细菌第一株的原则去重。质控菌株ATCC 25923(K-B法)、ATCC 29213(仪器法)、ATCC 43300-mecA阳性、铅黄肠球菌ATCC 700327、粪肠球菌ATCC 29212均购自重庆市卫生健康委员会临床检验中心。
1.1.2仪器与试剂 仪器为法国梅里埃Vitek 2-Compact全自动微生物鉴定仪及配套革兰阳性菌鉴定卡和药敏卡(AST-GP67)。抗菌药物纸片购自英国OXOID。平皿购自重庆庞通公司。
1.2方法
1.2.1细菌培养与药敏试验 对临床送检的各种标本严格按标准操作规程进行细菌分离培养,采用梅里埃Vitek 2-Compact全自动微生物鉴定仪对病原菌进行鉴定和药敏分析。药敏试验结果根据美国临床和实验室标准化协会制定的标准判读。
1.2.2MRSA的确认检测 参照美国临床和实验室标准化协会制定的标准,用30 μg头孢西汀纸片检测[4]。抑菌环直径小于或等于21 mm判定为MRSA;抑菌环大于22 mm判定为甲氧西林敏感SAU(MSSA)。质控菌株ATCC 25923-mecA阴性和ATCC 43300-mecA阳性。
1.3统计学处理 应用WHONET5.6软件对耐药率进行统计分析,应用SPSS21.0统计软件进行数据分析。计数资料以率或构成比表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1SAU分离构成情况 1 532株SAU非重复株,其中MSSA 906株,MRSA 626株。MRSA总体分离率为40.9%;2017—2020年MRSA分离率比较,差异均无统计学意义(P>0.05);SAU分离率从2017年的26.4%下降至2020年的22.1%,MRSA检出率从2017年的43.2 %下降至2019年的36.8%,再上升至2020年的41.1%,检出率呈缓慢下降再上升趋势。见表1。儿童患者MRSA检出率为38.4%,成人患者MRSA检出率为41.9%,二者比较,差异无统计学意义(χ2=1.656 3,P=0.1981)。见表2。
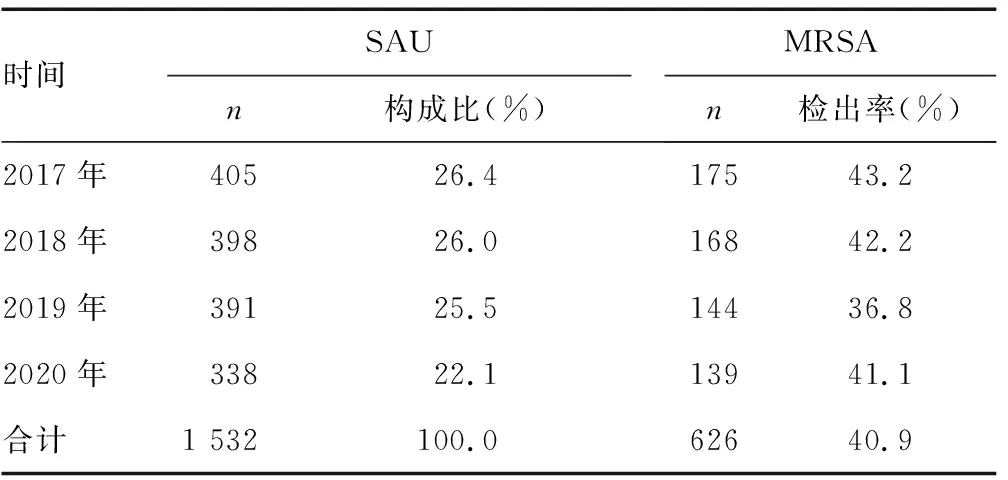
表1 SAU构成及MRSA检出情况

表2 儿童与成人患者分离SAU株数及MRSA检出情况
2.2SAU、MRSA标本来源分布 1 532株SAU检出最多的是伤口分泌物标本[565株(36.9%)],其次为痰液[432株(28.2%)]、脓液[320株(20.9%)]、血液[97株(6.3%)]和胸腹腔积液[57株(3.7%)]。MRSA检出率排前3位的标本分别为痰液(50.2%)、血液(47.4%)、脓液(40.9%)。见表3。

表3 SAU、MRSA标本来源分布[n(%)]
2.3SAU、MRSA科室来源分布 1 532株SAU科室来源排前5位为骨科(13.0%)、儿童外科(11.7%)、儿童内科(10.8%)、皮肤科(8.4%)和烧伤科(5.7%)。MRSA检出率排前3位的科室为重症医学科(78.6%)、神经外科(77.3%)和呼吸内科(61.4%)。见表4。
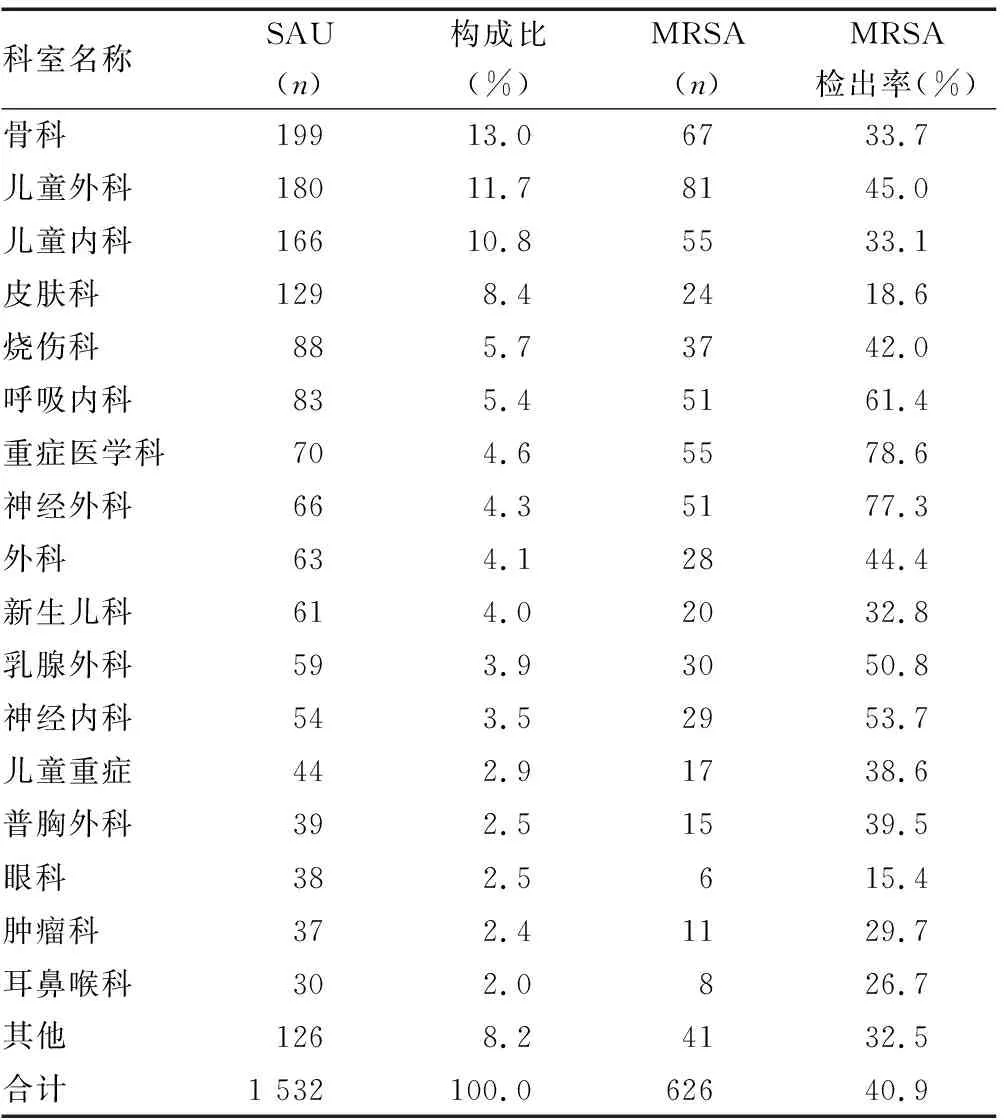
表4 SAU、MRSA科室来源分布
2.4SAU耐药性分析 1 532株SAU菌株对万古霉素、利奈唑胺、喹努普汀/达福普汀敏感率均为100.0%;对青霉素类敏感性最差(耐药率为94.5%)。MRSA对青霉素、苯唑西林、克林霉素、红霉素的耐药率均大于83.0%。MRSA对β-内酰胺类、红霉素、克林霉素、四环素、喹诺酮类、庆大霉素、复方新诺明、利福平耐药率均要明显高于MSSA,差异均有统计学意义(P<0.05)。见表5。成人分离的MRSA对红霉素、克林霉素耐药率与儿童比较,差异均无统计学意义(P>0.05);但对四环素、复方新诺明、庆大霉素、利福平、环丙沙星、左氧氟沙星、莫西沙星耐药率比较,差异均有统计学意义(P<0.05)。MSSA对除青霉素类、红霉素、克林霉素以外的抗菌药物耐药率均较低。成人分离的MSSA对青霉素、红霉素、克林霉素、四环素、复方新诺明、利福平耐药率与儿童比较,差异均无统计学意义(P>0.05);但对环丙沙星、左氧氟沙星、莫西沙星、庆大霉素耐药率比较,差异均有统计学意义(P<0.05)。MSSA成人分离株对喹诺酮类药物耐药率小于11.0%,可作为辅助用药。见表6。
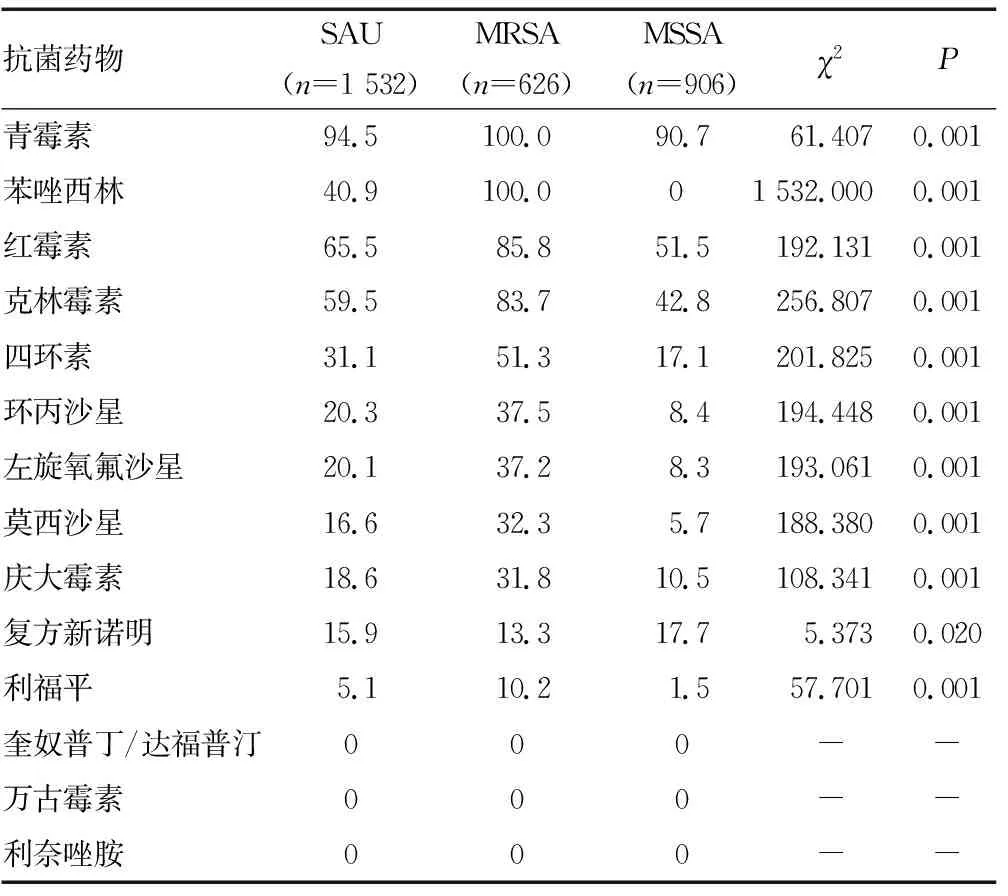
表5 MRSA、MSSA对抗菌药物的耐药率比较(%)

表6 儿童和成人MRSA、MSSA对抗菌药物的耐药率比较(%)
3 讨 论
SAU是革兰阳性球菌中最主要的病原菌[5],包括MRSA、MSSA。MRSA携带甲氧西林耐药基因[6],对除头孢洛林外所有β-内酰胺类抗生素均无效,还可通过改变抗生素作用靶位、产生修饰酶、降低膜通透性等机制对氨基糖苷类、大环内酯类、四环素类、氟喹喏酮类均产生不同程度耐药。本研究结果显示,SAU主要从手术切口、烧伤创面及皮肤等部位的伤口分泌物标本中分离出,其次为痰液,脓液等;主要来源于骨科和儿童外科,是由于骨科和儿童外科患者多长期卧床,伴开放性伤口,侵入性操作多,局部皮肤缺损极易发生SAU入侵引起皮肤软组织感染。因此,临床医护人员应加强对易感科室患者的观察与护理,预防与控制医院内感染的发生。MRSA传播与多种因素有关,包括患者自身因素、抗生素的选择性压力和感染控制措施等。本研究中2017—2020年4年间MRSA整体检出率呈平稳下降趋势,分离率从43.2%下降至41.1%,与近年来本院对抗菌药物合理使用实行了有效管理,临床加强了多重耐药菌监测,同时做好医护人员和患者的手卫生等措施有关。本院是包含儿科的综合性医院,本研究结果显示,儿童患者4年MRSA分离率分别为36.8%、35.6%、36.5%、45.5%,呈上升趋势;而成人MRSA分离率从2015年的46.5%降至2018年的39.3%,分析其原因,成人患者手卫生依从性明显好于儿童患者,且儿童诊疗过程中常伴有较多侵入性操作,更易引起MRSA感染,应引起高度重视,谨防发生医院内感染。本研究结果显示,MRSA在痰液标本中检出最多,其次为血液和脓液;MRSA主要来源于重症医学科,其次为神经外科和呼吸内科。表明本院MRSA感染多发生于危重患者、大手术后患者,长期住院的老年患者易引起呼吸系统疾病、血流感染和皮肤软组织化脓性感染,与文献报道相似[7-8]。本研究药敏结果显示,未检出对万古霉素、利奈唑胺、奎努普汀/达福普汀耐药的SAU菌株,提示这些抗菌药物仍可作为治疗的首选。虽然SAU对利福平耐药率不超过13.0%,但由于单独应用利福平易产生耐药性故不推荐其单独使用[9]。儿童患者SAU感染株对庆大霉素和喹诺酮类药物耐药率均较低,是由于这些药物本身的不良反应限制了其在儿科的使用所致。本研究中MRSA对其他11种抗菌药物的耐药率均明显高于MSSA,差异均有统计学意义(P<0.05),表明MRSA菌株耐药严重,与近年来中国细菌耐药监测网监测结果一致[10]。国外有关指南推荐使用克林霉素治疗MRSA,但本研究结果显示,MRSA菌株对克林霉素、红霉素耐药率均高达83.0%,说明二者不能用于临床治疗,与相关研究结果一致[11]。多重耐药性是MRSA感染临床治疗困难的主要原因,早期有效的抗生素治疗(6 h 黄金时间)可有效提高患者生存率。MRSA感染治疗策略专家共识推荐,对MSSA感染应选用β-内酰胺类抗生素,有药物过敏史者除外[11]。万古霉素应限用于严重MRSA感染患者;利奈唑胺对MRSA感染的疗效和安全性良好,推荐用于各种MRSA所致感染性疾病的治疗,包括皮肤和软组织感染、肺炎、骨关节感染和中枢神经系统感染。儿童推荐使用万古霉素等糖肽类抗菌药物或利奈唑胺;新生儿 MRSA脓毒血症推荐静脉应用万古霉素,利奈唑胺也可作为非血管内感染的替代用药。为防止耐药性的增加,建议应以实验室药敏试验为依据,规范使用抗生素;同时微生物室应定期向临床医师汇报MRSA检出情况,可指导医师经验用药并预警MRSA的流行;医护人员、患者及家属手卫生、警惕外源性感染、缩短住院时间是预防MRSA感染的主要措施[12-15]。需特别强调的是,临床用药应参照相关用药指南,根据患者不同生理病理状态做好药物浓度监测,选择合适剂量、足疗程规范用药,才能尽快控制感染,保证疗效。

