禽白血病病毒和鸡传染性贫血病毒二重荧光LAMP检测方法的建立及应用
张民秀 谢芝勋 谢志勤 谢丽基 张艳芳 邓显文 曾婷婷 范晴 罗思思 黄娇玲
摘要:【目的】建立同時鉴别ALV和CIAV的二重荧光环介导等温扩增(LAMP)检测方法,为临床上快速诊断及有效防控ALV和CIAV的单一或混合感染提供技术支持。【方法】参考ALV(A亚群、B亚群、C亚群、D亚群和J亚群)的pol基因和CIAV的VP2基因保守序列,设计2套用于LAMP的特异性引物,并在ALV和CIAV的F1c和B1c覆盖区域分别设计双标记探针[ALV-Probe(5'端标记FAM荧光基团,3'端标记BHQ3淬灭基团)和CIAV-Probe(5'端标记CY5荧光基团,3'端标记BHQ3淬灭基团)]。在Loopamp LA-320C实时浊度仪中反应结束后,将反应管置于多色荧光系统内进行观察分析;并通过特异性试验、灵敏度试验及临床样品检测验证二重荧光LAMP检测方法的适用性和可靠性。【结果】优化后的二重荧光LAMP反应体系20.0 μL:DNA/cDNA模板2.0 μL,2×Reaction Mix 10.0 μL,Bst DNA聚合酶0.8 μL,内引物ALV-FIP、ALV-BIP、CIAV-FIP和CIAV-BIP(工作浓度40.0 μmol/L)各0.8 μL,外引物ALV-F3、ALV-B3、CIAV-F3和CIAV-B3(工作浓度5.0 μmol/L)各0.4 μL,ALV-Probe(工作浓度0.5 μmol/L)0.4 μL,CIAV-Probe(工作浓度0.5 μmol/L)0.8 μL,以ddH2O补足至20.0 μL。扩增程序:62 ℃反应60 min,80 ℃灭活5 min。建立的二重荧光LAMP检测方法能特异性同时检测ALV和CIAV,对其他禽类病原体无特异性扩增;检测CIAV和ALV单一模板的下限均为102拷贝/?L,检测混合模板时ALV的检测下限为102拷贝/?L、CIAV的检测下限为103拷贝/?L。应用建立的二重荧光LAMP检测方法对13份咽喉和泄殖腔棉拭子样品进行检测,其检测结果与常规PCR检测结果的吻合率达100%。【结论】建立的二重荧光LAMP检测方法能实现在同一反应管内鉴别诊断ALV和CIAV,具有特异性好、敏感性高及污染风险小等优点,且检测结果可通过多色荧光系统进行肉眼观察,适用于ALV和CIAV的临床快速筛查。
关键词: 禽白血病病毒(ALV);鸡传染性贫血病毒(CIAV);二重荧光LAMP;探针;特异性;敏感性
中图分类号: S854.44 文献标志码: A 文章编号:2095-1191(2021)07-2007-08
A duplex fluorescence LAMP assay for identification of avian leukosis virus and chicken infectious anemia virus
ZHANG Min-xiu, XIE Zhi-xun*, XIE Zhi-qin, XIE Li-ji, ZHANG Yan-fang,
DENG Xian-wen, ZENG Ting-ting, FAN Qing, LUO Si-si, HUANG Jiao-ling
(Guangxi Veterinary Research Institute/Guangxi Key Laboratory of Veterinary Biotechnology,
Nanning 530001, China)
Abstract:【Objective】To establish a duplex fluorescence loop-mediated isothermal amplification(LAMP) method for simultaneous identification of avian leukosis virus(ALV) and chicken infectious anemia virus(CIAV), and provide technical support for clinical rapid diagnosis and effective prevention and control of single or mixed infections of ALV and CIAV. 【Method】According to the conserved sequences of the ALV(A, B, C, D and J subgroups) pol gene and the CIAV VP2 gene, two sets of specific primers were designed for LAMP,and a double labeled probe was designed in the areas covered by F1c and B1c of ALV and CIAV sequences, respectively[ALV-probe (5' end was labeled with a FAM fluorescent dye, 3' end was labeled with a BHQ3 quencher dye) and CIAV- probe (5' end was labeled with a CY5 fluorescent dye, 3' end was labeled with BHQ3 quencher dye)]. After the reaction in the Loopamp LA-320C turbidimeter, the results could be observed in the polychromatic fluorescence system. The applicability and reliability of the duplex fluorescence LAMP test method were validated by specificity testing, sensitivity testing, and clinical sample testing. 【Result】The duplex fluorescence LAMP was optimized in 20 μL volume containing DNA /cDNA template 2.0 μL, 2×Reaction Mix 10.0 μL, Bst DNA polymerase 0.8 μL, internal primers ALV-FIP, ALV-BIP, CIAV-FIP and CIAV-BIP (working concentration 40.0 μmol/L) 0.8 μL each. External primers were ALV-F3, ALV-B3, CIAV-F3 and CIAV-B3(working concentration 5.0 μmol/L) 0.4 μL each. ALV-Probe(working concentration 0.5 μmol/L) 0.4 μL , CIAV-Probe(working concentration 0.5) μmol/L) 0.8 μL , making up to 20.0 μL volume with ddH2O. Amplification procedure: the reaction mixture was incubated at 62 ℃ for 60 min and inactivation at 80 ℃ for 5 min. The results showed that duplex LAMP detection method could simultaneously detect ALV and CIAV, and had no specific amplification for other avian pathogens; the minimum detection limit of single template of CIAV and ALV in sensitivity test were 102 copies/?L. The minimum detection limit of mixed template in sensitivity test was 102 copies/?L for ALV and 103 copies/?L for CIAV; 13 throat and cloacal swabs were detected by the duplex fluorescence LAMP. The results were consistent with those of ALV and CIAV by single PCR me-thods, and the coincidence rate was 100%. 【Conclusion】The duplex fluorescence LAMP method for simultaneous detection of ALV and CIAV in this study has the advantages of good specificity, high sensitivity and low pollution. The detection results can be observed by naked eyes in the polychromatic fluorescence system, which is applicable for rapid clinical screening of ALV and CIAV.
Key words: avian leukosis virus(ALV); chicken infectious anemiavirus(CIAV); duplex fluorescence LAMP; probe; specificity; sensitivity
Foundation item:Guangxi Science Base and Talents Special Project(Guike AD17195083); Guangxi Science and Technology Key Project(Guike AA17204057); Guangxi Bagui Scholars Project(2019-79); National 10000 Talents Plan for Leading Talents in Scientific and Technological Innovation(W02060083)
0 引言
【研究意義】目前,养殖鸡群中免疫抑制性病毒二重及多重感染的现象普遍存在。禽白血病(Avian leukosis,AL)和鸡传染性贫血(Chicken infectious anemia,CIA)是常见的鸡免疫抑制病,引起这2种疾病的病原体分别是禽白血病病毒(Avian leukosis virus,ALV)和鸡传染性贫血病毒(Chicken infectious anemia virus,CIAV),二者共同感染时能显著降低疫苗的免疫效果,造成鸡群无法有效抵抗其他病毒感染而继发相关疾病,继而影响鸡群健康及其养殖经济效益(于帅,2015;李鑫,2016)。我国的养殖鸡群普遍存在CIAV感染,且常与ALV、马立克氏病病毒(MDV)、网状内皮增生症病毒(REV)等共同感染,其中CIAV与ALV共同感染的阳性率高达10.8%(王仙等,2017)。此外,禽类弱毒疫苗中存在CIAV和ALV污染,给养禽业的安全健康生产带来巨大威胁(胡晓苗等,2014;房立春等,2016)。因此,建立一种快速鉴别检测CIAV和ALV的方法,对净化及控制CIAV和ALV感染具有重要意义。【前人研究进展】环介导等温扩增(Loop-mediated isothermal amplification,LAMP)是将LAMP反应试剂混合后,在等温(60~65 ℃)条件下进行核酸扩增,其结果通过肉眼观察产物的浑浊度、浊度仪检测反应混合物的沉淀浊度或目测扩增产物是否发出荧光即可判断,具有快速、简便和敏感等优点(林文慧等,2015;侯谦等,2020)。在我国已有许多学者运用该技术建立针对禽类单一病原体的LAMP检测方法(康忠惠,2011;Peng et al.,2011;Xie et al.,2014;Luo et al.,2015;黄海超等,2018),包括针对ALV和CIAV的单重LAMP检测方法(邓显文等,2011;康忠惠,2011;刘业兵等,2011;黄海超等,2018);同时开发出针对多种病原体的二重及多重LAMP检测方法(姜侃等,2015;Nyan and Swinson,2015;范晴等,2017;李森等,2018)。Mahony等(2013)通过设计3套鉴别H1亚型、H3亚型和B型人流感病毒的LAMP引物,反应混合物放入荧光PCR仪内进行反应,根据荧光定量PCR熔解曲线的熔解温度差异可鉴定区分不同病原体。姜侃等(2015)基于LAMP-熔解曲线诊断成功建立了鉴别食源性沙门氏菌和金黄色葡萄球菌的二重LAMP检测方法。Nyan和Swinson(2015)成功建立了鉴别人类免疫缺陷病毒(HIV)、乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、戊型肝炎病毒(HEV)、登革热病毒(DENV)和西尼罗河病毒(WNV)的多重LAMP诊断方法,通过在每个靶序列的B2和B1c间设计1条与靶序列互补的双标记探针,扩增产物在紫外灯下发光,因此通过电泳可观察不同病毒形成的梯形条带差异进行判断。范晴等(2018)通过设计鉴别口蹄疫病毒(FMDV)和水泡性口炎病毒(VSV)的LAMP引物套,并分别在FMDV和VSV的内引物(FIP)5'端引入不同发射波长的荧光基团,反应结束后对扩增产物进行电泳并置于多色荧光成像系统下分析,根据不同目标病原体产物发出的荧光颜色进行判定。Suzuki等(2018)在不同病毒的环引物5'端引入不同发射波长的荧光基团,并于反应前在管盖内侧加入阳离子多聚物聚乙烯亚胺,反应结束后颠倒反应管使管底的特异性产物与阳离子多聚物聚乙烯亚胺聚合,短暂离心后,管底产生不同颜色沉淀,根据在紫外光产生的沉淀颜色即可鉴定区分病原体。方庆等(2020)尝试在F1c和B1c覆盖的区域设计1条双标记探针,成功建立了鸡细小病毒(ChPV)荧光LAMP检测方法,只需将反应后的反应管置于多色荧光成像系统下观察,若反应管出现相应的荧光则判定为阳性,能减少开盖带来的污染风险。【本研究切入点】鉴于LAMP检测方法具有快速、简便和敏感等优点,已开发出针对ALV和CIAV的单重LAMP检测方法(邓显文等,2011;黄海超等,2018),但至今未见针对ALV和CIAV二重LAMP检测方法的研究报道。【拟解决的关键问题】在LAMP检测方法中引入双标记探针引物,建立能同时鉴别ALV和CIAV的二重荧光LAMP检测方法,为临床上快速诊断及有效防控ALV和CIAV的单一或混合感染提供技术支持。
1 材料与方法
1. 1 试验材料
禽流感病毒(Avian influenza virus,AIV)H5(Duck/HK/313/78)和H7亚型(Duck/HK/47/76)cDNA由香港大学惠赠,鸡传染性法氏囊病毒(Infectious bursal disease virus,IBDV)AV6株购自中国兽医药品监察所,禽脊髓脑炎病毒(Avian encephalomyelitis virus,AEV)AE1163株由美国康乃狄格大学惠赠,新城疫病毒(Newcastle disease virus,NDV)GX6/02株、H9亚型AIV(Duck/Guangxi/1/00)、禽呼肠孤病毒(Avian reovirus,ARV)S1133株、禽网状内皮增生症病毒(Reticuloendotheliosis virus,REV)2012001-1株、禽传染性支气管病毒(Infectious bronchitis virus,IBV)GXIB/02株、鸡马立克病病毒(Mareks disease virus,MDV)2012006-1株、禽4型腺病毒(Fowl adenovirus group 4,FAdV-4)GX2018001株、ALV A亚群GX11 0521株、B亚群GX111230株和J亚群2012004-C5株及CIAV GXC060821株由广西兽医研究所保存提供。13份临床样品来源于广西某规模化鸡场采集的咽喉和泄殖腔拭子,经普通PCR鉴定,阳性样品送至华大基因生物科技(深圳)有限公司测序。按照EasyPure Viral DNA/RNA Kit说明提取不同病毒和临床样品的RNA或DNA,病毒RNA反转录成cDNA,cDNA/DNA模板-20 ℃保存备用。LAMP DNA扩增试剂盒和Loopamp LA-320C实时浊度仪购自荣研生物科技(中国)有限公司,EasyPure Viral DNA/RNA Kit购自北京全式金生物技术有限公司,反转录试剂盒和pMD18-T克隆载体购自宝日医生物技术(北京)有限公司,NanoDrop2000核酸测定仪购自Thermo Fisher Scientific公司,多色荧光成像系统购自美国Bio-Rad公司。
1. 2 引物和探针设计与合成
根据GenBank中ALV(A、B、C、D和J亚群)的pol基因和CIAV的VP2基因保守序列,利用MEGA 4.0和Primer Explorer V4设计LAMP引物,其中,外引物包括ALV-F3、ALV-B3、CIAV-F3和CIAV-B3,内引物包括ALV-FIP、ALV-BIP、CIAV-FIP和CIAV-BIP,内引物FIP=F1c+F2,BIP=B1c+B2。利用Primer Premier 5.0在ALV和CIAV的F1c和B1c覆盖区域分别间设计1条探针,即ALV-Probe(5'端标记FAM荧光基团,3'端标记BHQ3淬灭基团)和CIAV-Probe(5'端标记CY5荧光基团,3'端标记BHQ3淬灭基团)。引物和探针序列如表1所示,引物委托华大基因生物科技(深圳)有限公司合成,探针委托宝日医生物技术(北京)有限公司合成。同时基于ALV的env基因和CIAV的VP2基因,合成特异性引物:ALV-F(5'-GGATGAGGTGACTA AGAAAG-3')和ALV-R(5'-CGAACCAAAGGTAAC ACACG-3'),扩增片段长度545 bp;以及CIAV-F(5'-CTAAGATCTGCAACTGCGGA-3')和CIAV-R(5'-CCTTGGAAGCGGATAGTCAT-3'),扩增片段长度441 bp。特异性引物委托华大基因生物科技(深圳)有限公司合成。
1. 3 阳性质粒标准品制备
使用外引物ALV-F3/ALV-B3和CIAV-F3/CIAV-B3对阳性ALV cDNA和CIAV DNA模板进行截短目的基因扩增,目的片段长度分别为217和201 bp,将PCR扩增产物连接至pMD18-T载体上构建重组质粒。利用NanoDrop 2000紫外分光光度计测量ALV和CIAV的阳性重组质粒浓度,再根据分子量及浓度计算拷贝数。
1. 4 LAMP反应体系优化
DNA/cDNA模板2.0 μL,2×Reaction Mix 10.0 μL,Bst DNA聚合酶0.8 μL,内引物ALV-FIP、ALV-BIP、CIAV-FIP和CIAV-BIP(工作浓度40 μmol/L)各0.8 μL,外引物ALV-F3、ALV-B3、CIAV-F3和CIAV-B3(工作浓度5.0 μmol/L)各0.8 μL,ALV-Probe(工作浓度0.5 μmol/L)0.8 μL,CIAV-Probe(工作浓度0.5 μmol/L)0.8 μL,ddH2O补足至20.0 μL。同时设空白对照,以无RNAase水为模板加入反应管中。将反应管置于Loopamp LA-320C实时浊度仪中调整反应温度(60、61、62、63和64 ℃)反应60 min,以确定最佳反应温度,80 ℃灭活5 min,试验结束后将反应管直接置于多色荧光成像系统内进行判定。
确定最佳反应温度后,按ALV-FIP/ALV-BIP∶CIAV-FIP/CIAV-BIP∶ALV-F3/ALV-B3∶CIAV-F3/CIAV-B3∶ALV-Probe∶CIAV-Probe不同比例进行引物浓度优化,不同比例的引物终浓度(μmol/L)分别为1.60∶1.60∶0.10∶0.10∶0.02∶0.02、1.60∶1.60∶0.10∶0.10∶0.01∶0.02和1.60∶1.60∶0.10∶0.10∶0.01∶0.01;按最佳反应温度在Loopamp LA-320C实时浊度仪中进行反应,根据实时浊度仪扩增曲线效果及反应管在多色荧光成像系统内的成像效果确定引物最佳浓度及其比例。
1. 5 二重荧光LAMP结果判定
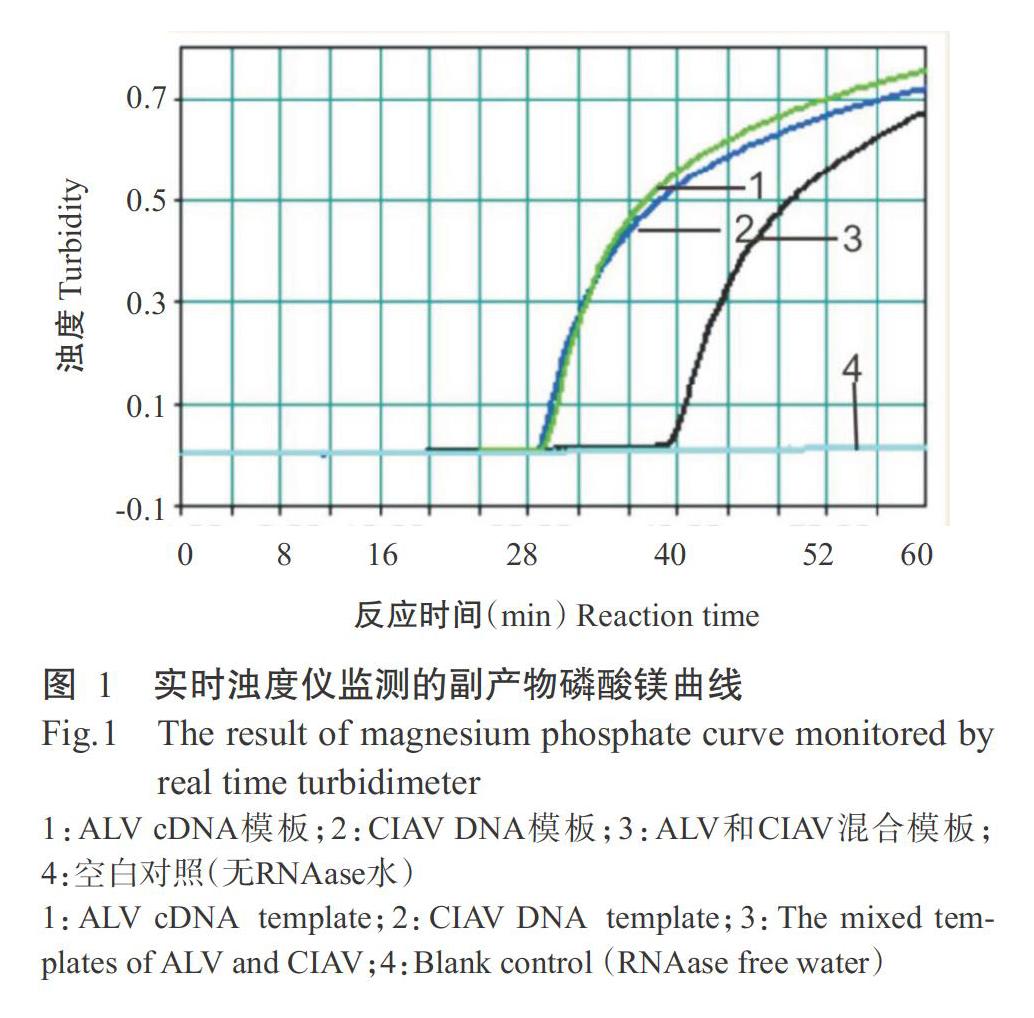
二重荧光LAMP在实时浊度仪反应结束后,将反应管置于多色荧光成像系统内,选择多通道凝胶成像。由于ALV-Probe 5'端标记的荧光基团为FAM,通道1选择520 nm为发射波长,ALV阳性产物反应管在该通道显示绿色荧光,而阴性对照管无绿色荧光;CIAV-Probe 5'端标记的荧光基团为CY5,通道2则选择670 nm发射波长,CIAV阳性产物反应管在该通道下显示红色荧光,而阴性对照管无红色荧光;当反应管中既有ALV阳性扩增产物又有CIAV阳性扩增产物时,反应管在2个通道下均能发出荧光,且反应管显示橘黄色。
1. 6 二重荧光LAMP特异性试验
根据1.4的反应体系及擴增程序,逐一将阳性ALV(A亚群、B亚群和J亚群)、CIAV、ALV及CIAV混合模板,以及FAdV-4、ARV、NDV、AIV-H5、AIV-H7、AIV-H9、AEV、REV、IBV、IBDV和MDV的cDNA/DNA模板加入LAMP反应体系中,以验证二重荧光LAMP的特异性。
1. 7 二重荧光LAMP灵敏度试验
1. 7. 1 单一病原体模板检测的灵敏度分析 制备好的ALV和CIAV阳性重组质粒按计算出的拷贝数,分别梯度稀释为106、105、104、103、102、101和100拷贝/?L。根据1.4的反应体系及扩增程序,取不同浓度的重组质粒2.0 ?L依次加入反应管中,混匀后置于Loopamp LA-320C实时浊度仪中进行反应。
1. 7. 2 2种病原体模板同时检测的灵敏度分析
将ALV和CIAV阳性重组质粒等量混合,然后梯度稀释为106、105、104、103、102、101和100拷贝/?L,根据1.4的反应体系及扩增程序,取不同浓度的重组质粒2.0 ?L依次加入反应管中,混匀后置于Loopamp LA-320C实时浊度仪中进行反应。
1. 8 临床样品检测
使用建立的二重荧光LAMP对13份临床样品(咽喉和泄殖腔棉拭子)进行检测,将检测结果与这2种病毒的常规PCR检测结果进行比较,以验证二重荧光LAMP的可靠性。
2 结果与分析
2. 1 二重荧光LAMP反应条件的优化结果
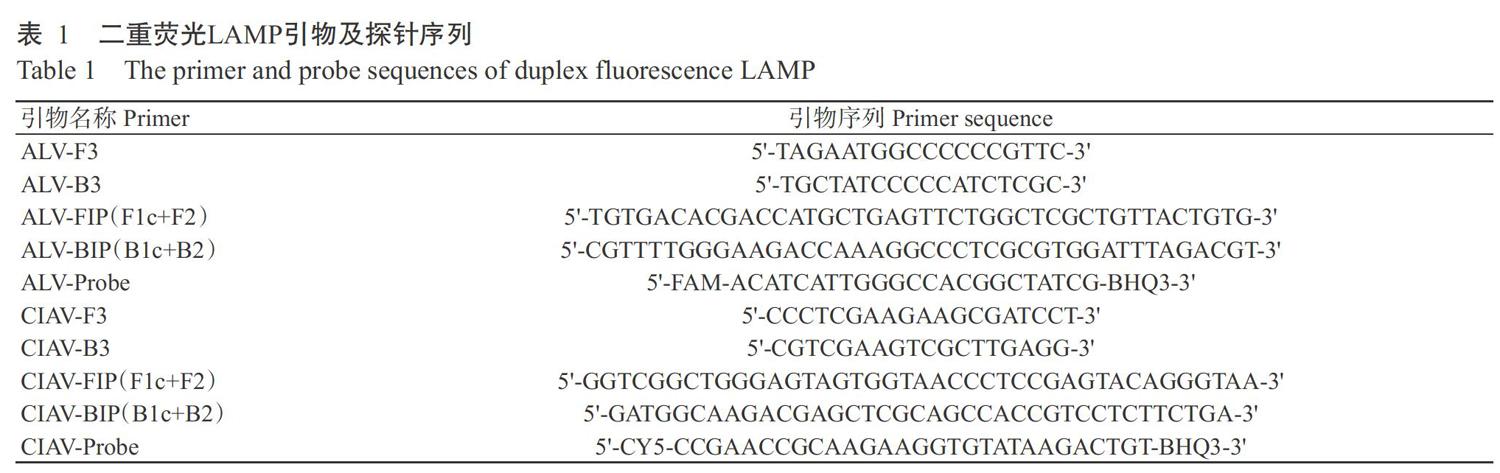
将含20.0 ?L反应混合物的反应管置于Loopamp LA-320C实时浊度仪中,分别于60、61、62、63和64 ℃下反应60 min,80 ℃灭活5 min。结果显示,当反应温度为62 ℃时,浊度仪曲线图的空白对照未起峰,且ALV和CIAV在此温度下最早进入指数增长期,因此确定最佳反应温度为62 ℃。ALV-FIP/ALV-BIP∶CIAV-FIP/CIAV-BIP∶ALV-F3/ALV-B3∶CIAV-F3/CIAV-B3∶ALV-Probe∶CIAV-Probe的最佳终浓度(μmol/L)比例为1.60∶1.60∶0.10∶0.10∶0.01∶0.02。
优化后的二重荧光LAMP反应体系20.0 μL:DNA/cDNA模板2.0 μL,2×Reaction Mix 10.0 μL,Bst DNA聚合酶0.8 μL,内引物ALV-FIP、ALV-BIP、CIAV-FIP和CIAV-BIP(工作浓度40.0 μmol/L)各0.8 μL,外引物ALV-F3、ALV-B3、CIAV-F3和CIAV-B3(工作浓度5.0 μmol/L)各0.4 μL,ALV-Probe(工作浓度0.5 μmol/L)0.4 μL,CIAV-Probe(工作浓度0.5 μmol/L)0.8 μL,以ddH2O补足至20.0 μL。扩增程序:62 ℃反应60 min,80 ℃灭活5 min。
2. 2 二重荧光LAMP检测方法特异性试验结果
特异性试验结果显示,建立的二重荧光LAMP检测方法仅扩增出阳性ALV(A亚群、B亚群和J亚群混合模板)的cDNA和CIAV的DNA,部分扩增结果如图1所示。ALV阳性反应管在520 nm通道下呈绿色荧光,CIAV阳性反应管在670 nm通道下呈红色荧光,ALV和CIAV混合模板在2个通道下均呈现出相应的荧光,混合色呈橘黄色,而其他病毒和空的对照均未扩增出任何产物及发出荧光(图2)。
2. 3 二重荧光LAMP检测方法敏感性试验结果
采用建立的二重荧光LAMP检测方法分别检测单模板ALV和CIAV的敏感性,实时浊度仪监测结果显示,单独检测ALV cDNA模板或CIAV DNA模板的下限均為102拷贝/?L(图3-A和图4-A),将实时浊度仪反应结束后的反应管置于多色荧光成像系统中,荧光结果也显示在单模板存在的情况下,2种病原体的最低检测下限均为102拷贝/?L(图3-B和图4-B)。同时检测ALV cDNA模板和CIAV DNA模板时,ALV的检测下限为102拷贝/?L,CIAV的检测下限为103拷贝/?L(图5)。
2. 4 二重荧光LAMP检测方法的临床应用效果
采用建立的二重荧光LAMP检测方法对13份临床样品进行检测,其检测结果与常规PCR检测结果的吻合率达100%。13份临床样品中,有5份样品为CIAV单一感染,有1份样品为ALV单一感染,有1份样品为ALV和CIAV混合感染(图6)。
3 讨论
LAMP具有检测快速、敏感度高、特异性好且无需特殊仪器等优点,已广泛应用于临床病原诊断(Peng et al.,2011;彭宜等,2013;Xie et al.,2014;Luo et al.,2015),但至今应用较成熟的均为单重LAMP检测方法。近年来,多重LAMP检测技术的开发成为鉴别不同动物病原体的研究热点(姜侃等,2015;Nyan and Swinson,2015;范晴等,2017;李森等,2018)。常规LAMP检测结果的判定主要依据反应产物直接凝胶电泳观察梯形条带、实时浊度仪形成的副产物磷酸镁曲线、肉眼判断白色沉淀及扩增产物加入荧光显色剂显色等方法,但这些方法均不能准确地对多重病原体进行鉴别诊断。目前,国内研究报道能实现真正意义上鉴别诊断的多重LAMP有3种方法:①基于扩增产物酶切处理的特异序列识别法,通过在LAMP内引物中引入限制性内切酶位点,在进行恒温扩增完毕后对扩增产物进行酶切处理,然后根据酶切产物在琼脂糖凝胶电泳中的不同位置来区分不同产物,但该方法耗时较长,且需要开盖处理产物,增加了扩增产物对实验室污染的风险(范晴等,2017)。②依赖于荧光PCR检测仪,根据扩增产物熔解曲线出现特征峰的不同熔解温度判断病原体,但该方法可能由于同一病原体不同来源模板其扩增产物的熔解温度不同,而导致判断结果出现偏差,具有一定的局限性(姜侃等,2015)。③在内引物FIP的5'端引入不同发射波长的荧光基团,扩增产物经电泳后能在不同发射波长通道下发出不同荧光,而以此区分不同病原体,但该方法也需开盖电泳,易造成实验室污染(范晴等,2018)。
在参考方庆等(2020)建立鸡细小病毒(ChPV)荧光LAMP检测方法的基础上,本研究通过在ALV和CIAV靶基因上的F1c和B1c引物间设计携带不同荧光基团的双标记探针,依靠靶基因不断扩增导致探针不断裂解,将带有阳性扩增产物的反应管置于多色荧光成像系统中,阳性扩增产物在相应的发射波长通道内发出荧光,根据荧光颜色能准确判定病原体,具有以下优点:①设计的探针只与特异性模板发生杂交,增加了反应的特异性,避免假阳性;②检测反应只需60 min,且可在水浴锅内完成反应,反应敏感高效;③无需开盖即能准确判定结果,污染风险小。本研究采用2种荧光基团(FAM和CY5),但这2种荧光基团的发射波长不同,分别是520和670 nm,在完成LAMP反应后只需将反应管置于多色荧光系统内进行观察,在520 nm通道下能观察到ALV阳性反应管呈绿色荧光,在670 nm通道下能观察到CIAV阳性反应管呈红色荧光,二者互不干扰,而其他病毒和空白对照均不发光,因此能准确判断检测结果。由于二重荧光LAMP检测方法涉及到荧光探针,其价格相对较高,加之二重LAMP检测方法需配备多色荧光系统才能进行观察判定,也增加检测成本,因此该方法不易在基层和现场推广引用。
4 结论
建立的二重荧光LAMP检测方法能实现在同一反应管内鉴别诊断ALV和CIAV,具有特异性好、敏感性高及污染风险小等优点,且检测结果可通过多色荧光系统进行肉眼观察,适用于ALV和CIAV的临床快速筛查。
参考文献:
邓显文,谢芝勋,谢志勤,刘加波,庞耀珊,谢丽基,彭宜,范晴. 2011. 鸡传染性贫血病毒病LAMP快速可视化检测方法的建立[J]. 家畜生态学报,32(6):57-60. doi:10.3969/j.issn.1673-1182.2011.06.011. [Deng X W,Xie Z X,Xie Z Q,Liu J B,Pang Y S,Xie L J,Peng Y,Fan Q. 2011. Development of a reverse transcription loop-mediated isothermal amplification assay for visual detection of chicken infectious anemia[J]. Acta Ecologae Animalis Domastici,32(6):57-60.]
范晴,谢芝勋,谢志勤,庞耀珊,邓显文,谢丽基,黄莉. 2017. 口蹄疫病毒和水泡性口炎病毒二重RT-LAMP鉴别检测方法的建立[J]. 中国兽医学报,37(10):1829-1834. doi:10.16303/j.cnki.1005-4545.2017.10.03. [Fan Q,Xie Z X,Xie Z Q,Pang Y S,Deng X W,Xie L J,Huang L. 2017. Development of duplex reverse transcription loop-media-ted isothermal amplification assay for detection of foot-and-mouth disease virus and vesicular stomatitis virus[J]. Chinese Journal of Veterinary Science,37(10):1829-1834.]
范晴,谢芝勋,谢志勤,谢丽基,黄娇玲,张艳芳,曾婷婷,王盛,罗思思,邓显文,刘加波. 2018. 二重荧光RT-LAMP方法鉴别检测口蹄疫病毒和水泡性口炎病毒[J]. 畜牧兽医学报,49(5):996-1004. doi:10.11843/j.issn.0366-6964. 2018.05.014. [Fan Q,Xie Z X,Xie Z Q,Xie L J,Huang J L,Zhang Y F,Zeng T T,Wang S,Luo S S,Deng X W,Liu J B. 2018. Development of a duplex fluorescence-based reverse transcript loop-mediated isothermal amplification assay for detection of foot-and-mouth disease virus and vesicular stomatitis Virus[J]. Acta Veterinaria et Zootechnica Sinica,49(5):996-1004.]
方庆,谢芝勋,张艳芳,张民秀,罗思思,谢丽基,范晴,曾婷婷,黄娇玲,邓显文,谢志勤,刘加波. 2020. 鸡细小病毒荧光LAMP检测方法的建立[J]. 中国兽医科学,50(4):412-416. doi:10.16656/j.issn.1673-4696.2020.0059. [Fang Q,Xie Z X,Zhang Y F,Zhang M X,Luo S S,Xie L J,Fan Q,Zeng T T,Huang J L,Deng X W,Xie Z Q,Liu J B. 2020. Establishment of fluorescence LAMP for detection of chicken parvovirus[J]. Veterinary Science in China,50(4):412-416.]
房立春,李曉晗,任志浩,李阳,王一新,崔治中,常爽,赵鹏. 2016. 弱毒疫苗中鸡传染性贫血病毒低剂量污染对SPF鸡体重和疫苗免疫抗体的影响[J]. 病毒学报,32(2):190-194. doi:10.13242/j.cnki.bingduxuebao.002906. [Fang L C,Li X H,Ren Z H,Li Y,Wang Y X,Cui Z Z,Chang S,Zhao P. 2016. Effect of low dose of chicken infectious anemia virus in attenuated vaccine on SPF chicken body weight and vaccine immune antibody[J]. Chinese Journal of Virology,32(2):190-194.]
侯谦,代军飞,张杰. 2020. LAMP的发展及在口蹄疫诊断中的应用[J]. 江西农业学报,32(6):99-104. doi:10.19386/j.cnki.jxnyxb.2020.06.18. [Hou Q,Dai J F,Zhang J. 2020.Development of LAMP and its application indiagnosis of foot-and-mouth disease[J]. Acta Agriculturae Jiangxi,32(6):99-104.]
胡晓苗,沈学怀,戴银,赵瑞宏,侯宏艳,潘孝成,周学利,张丹俊,朱传明. 2014. PCR法检测活毒疫苗中禽白血病病毒污染[J]. 中国兽医杂志,50(9):23-25. doi:10.3969/j.issn. 0529-6005.2014.09.007. [Hu X M,Shen X H,Dai Y,Zhao R H,Hou H Y,Pan X C,Zhou X L,Zhang D J,Zhu C M. 2014. Study on PCR method for the detection of avian leukemia virus pollution in live vaccines[J]. Chinese Journal of Veterinary Medicine,50(9):23-25.]
黄海超,陈轩,杨素,赵海燕,曹伟胜,邵建宏,赵福振,沙才华,李忠. 2018. 禽白血病病毒K亚群RT-LAMP检测方法的建立[J]. 中国兽医科学,48(2):161-166. doi:10.16656/ j.issn.1673-4696.2018.0025. [Huang H C,Chen X,Yang S,Zhao H Y,Cao W S,Shao J H,Zhao F Z,Sha C H,Li Z. 2018. Development of RT-LAMP method for the detection of avian leukosis virus subgroup K[J]. Chinese Ve-terinary Science,48(2):161-166.]
姜侃,张慧,汪新,刘鹏鹏,黄建锋,周志南. 2015. 多重LAMP—熔解曲线法检测食品中两种食源性致病菌[J]. 食品与机械,31(2):92-97. doi:10.13652/j.issn.1003-5788.2015. 02.018. [Jiang K,Zhang H,Wang X,Liu P P,Huang J F,Zhou Z N. 2015. Development of multiplex LAMP combined with melting curves analysis for detection of two kinds of food borne pathogens[J]. Food & Machinery,31(2):92-97.]
康忠惠. 2011. A、B亞群禽白血病病毒LAMP检测方法的建立及初步应用[D]. 哈尔滨:东北农业大学. doi:10.7666/d.y1973658. [Kang Z H. 2011. Development and preliminary application of loop-mediated isothermal amplification(LAMP) for the detection of avian leukosis virus subgroup A and B[D]. Harbin:Northeast Agricultural University.]
李森,王源升,余红伟,李瑜,夏革清. 2018. 三种食源性致病菌的多重LAMP检测方法研究[J]. 海军工程大学学报,30(1):75-79. doi:10.7495/j.issn.1009-3486.2018.01.015. [Li S,Wang Y S,Yu H W,Li Y,Xia G Q. 2018. Deve-lopment of multiplex loop-mediated isothermal amplification assays to detect three kinds of food-borne pathogens[J]. Journal of Naval University of Engineering,30(1):75-79.]
李鑫. 2016. 禽白血病病毒及鸡传染性贫血病病毒对禽流感疫苗免疫效果的影响[D]. 北京:中国农业科学院. [Li X. 2016. Impact of avian leukosis virus and chicken infection anemia virus on the avian influenza vaccine[D]. Beijing:Chinese Academy of Agricultural Sciences.]
林文慧,邹秉杰,宋沁馨,周国华. 2015. 多重环介导等温扩增技术研究进展[J]. 遗传,37(9):899-910. doi: 10.16288/j. yczz.15-141. [Lin W H,Zou B J,Song Q X,Zhou G H. 2015. Progress in multiplex loop-mediated isothermal amplification technology[J]. Hereditas(Beijing),37(9):899-910.]
刘业兵,张磊,孙跃辉,毛娅卿,立俊平,宁宜宝. 2011. 可视化的RT-LAMP方法检测禽白血病病毒[J]. 畜牧兽医学报,42(1):150-156. [Liu Y B,Zhang L,Sun Y H,Mao Y Q,Li J P,Ning Y B. 2011. Visualized detection of avian leukosis virus by reverse transcription loop-mediated isothermal amplification assay[J]. Acta Veterinaria et Zootechnica Sinica,42(1):150-156.]
彭宜,谢芝勋,刘加波,庞耀珊,邓显文,谢志勤,谢丽基,范晴,罗思思. 2013. H5亚型禽流感病毒RT-LAMP可视化检测技术的建立[J]. 南方农业学报,44(2):323-327. doi:10.3969/j:issn.2095-1191.2013.2.323. [Peng Y,Xie Z X,Liu J B,Pang Y S,Deng X W,Xie Z Q,Xie L J,Fan Q,Luo S S. 2013. Development of a reverse transcription loop-mediatedisothermal amplification assay for visual detection of H5 subtypeavian influenza virus[J]. Journal of Southern Agriculture,44(2):323-327.]
王仙,闫彩虹,羊扬,金文杰. 2017. 鸡传染性贫血病病毒与三种致家禽肿瘤病毒混合感染的流行病学研究[J]. 中国家禽,39(13):21-25. doi:10.16372/j.issn.1004-6364.2017. 13.005. [Wang X,Yan C H,Yang Y,Jin W J. 2017. Epidemiological study of co-infection of chicken infectious anemia virus and three oncogenic viruses[J]. China Poultry,39(13):21-25.]
于帅. 2015. 四川部分地区CIAV分子流行病学调查及CIAV与ALV-J共感染鸡对疫苗免疫效果的影响[D]. 雅安:四川农业大学. [Yu S. 2015. Molecular epidemiology of CIAV in some areas of Sichuan and CIAV co-infected with ALV-J affect vaccine effectiveness[D]. Yaan:Sichuan Agricultural University.]
Luo S S,Xie Z X,Xie L J,Liu J B,Xie Z Q,Deng X W,Huang L,Huang J L,Zeng T T,Khan M I. 2015. Reverse-transcription,loop-mediated isothermal amplification assay for the sensitive and rapid detection of H10 subtype avian influenza viruses influenza virusess[J]. Virology Journal,12:145. doi:10.1186/s12985-015-0378-1.
Mahony J,Chong S,Bulir D,Ruyter A,Mwawasi K,Waltho D. 2013. Multiplex loop-mediated isothermal amplification (M-LAMP) assay for the detection of influenza A/H1,A/H3 and influenza B can provide a specimen-to-result diagnosis in 40 min with single genome copy sensitivity[J]. Journal of Clinical Virology,58(1):127-131. doi:10.1016/j.jcv.2013.06.006.
Nyan D C,Swinson K L. 2015. A novel multiplex isothermal amplification method for rapid detection and identification of viruses[J]. Scientific Reports,5:17925. doi:10.1038/ srep17925.
Peng Y,Xie Z X,Liu J B,Pang Y S,Deng X W,Xie Z Q,Xie L J,Fan Q,Feng J X,Khan M I. 2011. Visual detection of H3 subtype avian influenza viruses by reverse transcription loop-mediated isothermal amplification assay[J]. Virology Journal,8:337.doi:10.1186/1743-422X-8-337.
Suzuki R,Tanaka H,Suzuki K,Fukuta S,Kato S,Ohno T. 2018. Multiplex loop-mediated isothermal amplification assay for the identification of three major whitefly species in the greenhouse[J]. Journal of Applied Entomology,142(8):745-754. doi:10.1111/jen.12522.
Xie L J,Xie Z X,Zhao G Y,Liu J B,Pang Y S,Deng X W,Xie Z Q,Fan Q,Luo S S. 2014. A loop-mediated isothermal amplification assay for the visual detection of duck circovirus[J]. Virology Journal,11:76. doi:10.1186/1743-422X-11-76.
(責任编辑 兰宗宝)

