基于斑马鱼模型的竹柳多糖对感觉毛细胞保护活性的研究
孙 晨,高 燕,巴帅康,秦子臻,张 云,张姗姗*,刘可春*
1齐鲁工业大学(山东省科学院)生物研究所,济南 250103;2云南大学生命科学学院,昆明 650500
氨基糖苷类药物是化学结构中含有氨基糖分子的抗生素,多用于治疗革兰氏阴性菌的感染,应用十分广泛[1]。但是这类药物具有较强的耳毒性和肾毒性[2]。研究发现,其肾毒性可通过水化治疗来缓解[3]。但是其耳毒性目前却无有效的治疗方法,开发相应的防治药物至关重要。氨基糖苷类药源性耳聋的致病机理目前尚未完全研究清楚,但是已有研究发现,内耳中的感觉毛细胞在其中发挥着关键作用[4]。该细胞是位于哺乳动物内耳中的一类终末分化细胞,一旦缺失不可再生。氨基糖苷类药物进入毛细胞后,可诱导活性氧(reactive oxygen species,ROS)的大量产生[5]。这些由于氨基糖苷类药物作用而产生的ROS可促使毛细胞发生氧化损伤,并诱导其凋亡[6]。因此,降低感觉毛细胞内ROS的产生现已成为氨基糖苷类药源性耳聋防治药物研发的方向之一。斑马鱼是一种国际认可的新型脊椎动物模式生物,体积较小、生长快速、生殖能力强、体外受精发育、胚胎透明,在生理结构、信号通路、蛋白质功能等方面,斑马鱼与人类相比均表现出极高的保守性[7]。斑马鱼具有与人类高度同源的内耳感觉毛细胞及侧线毛细胞。当其发育至第5天(days post-fertilization,dpf)时,上述毛细胞既已发育完全[8]。由于斑马鱼在发育早期全身透明,借助活体成像技术,可直接实时观察待测样品对毛细胞的毒性作用。因此,斑马鱼现已成为研究药源性耳聋防治药物的重要模式生物。在前期的研究中发现,竹柳中含有一种具有抗氧化功效的多糖,其组成为:8.72%木糖、14.87%L(+)-鼠李糖、3.22%D(-)-葡萄糖醛酸、5.45%D-半乳糖醛酸、54.68%D-阿拉伯糖、13.05%甘露糖(见附录1)。基于抗氧化与感觉毛细胞损伤保护的密切联系,本实验选用斑马鱼为试验动物,氨基糖苷类代表性抗生素——卡那霉素为损伤药物,以自主发现的竹柳多糖为实际研究对象,对其感觉毛细胞的保护活性与机制进行了初步研究,旨在为进一步理解药源性耳聋的防治提供理论依据与实验数据。
1 材料与方法
1.1 实验动物
本实验采用健康野生AB系斑马鱼,由山东省人类疾病斑马鱼模型与药物筛选工程技术研究中心提供。雌雄斑马鱼在28 ℃,光照与黑暗时间为14 h和10 h条件下分开养殖。交配取卵时,于前日将健康成熟斑马鱼按雌雄比1∶1或1∶2比例放入交配缸内,中间放置隔板,置于黑暗环境中,次日亮灯前抽去隔板,光照刺激使其排卵。
1.2 实验药品、仪器与试剂
造模药物卡那霉素(批号:BA10BA0024,生工生物工程(上海)股份有限公司),用去离子水配制成1 mM的储蓄液,放置于-20 ℃保存。4%多聚甲醛(批号:AR1069,武汉博士德生物公司);CellROX Deep Red试剂盒(批号:2023824,Thermo Fisher Scientific);TUNEL Brightred Appoptosis Detection Kit(批号:A113,南京诺唯赞生物科技有限公司);FM1-43染料(批号:#70020,Biotium);三卡因(批号:886-86-2,Sigma-Aldrich)。
AXIO Zoom.V16蔡司体式荧光显微镜(卡尔蔡司,德国);OLYMPUS荧光显微镜观察并拍照(OLYMPUS,日本)。
1.3 实验方法
1.3.1 竹柳多糖的安全性评价
受精3 h(hours post-fertilization,hpf)的斑马鱼胚胎分别暴露于0、30、40和50 μg/mL的竹柳多糖药液中,在28.5 ℃的培养箱中连续处理96 h,期间每24 h更换一次药液,每个浓度同时设置三个平行组(每个浓度20个胚胎)。处理结束后,对斑马鱼进行形态观察并统计各组的累计死亡率、累计孵化率、畸形率及心率。累计死亡率=(96 hpf的死亡数/胚胎总数)×100%;累计孵化率=(96 hpf孵化数/96 hpf存活的胚胎总数)×100%;畸形率=(96 hpf畸形数/96 hpf已孵化幼鱼数)×100%;畸形指标为脊柱和尾巴弯曲、卵黄囊畸形、心包水肿和生长发育迟缓[9]。
1.3.2 卡那霉素与竹柳多糖的联合毒性评价
受精6 dpf的斑马鱼置于24孔细胞培养板中,随机分成空白对照组与不同浓度联合暴露组,分别为a:空白对照组、c:30 μg/mL竹柳多糖+卡那霉素组、d:40 μg/mL竹柳多糖+卡那霉素组、e:50 μg/mL竹柳多糖+卡那霉素组,每组15尾仔鱼,同时设置三个平行孔。空白对照组中不添加任何待测物;不同浓度联合暴露组中分别同时添加200 μM的卡那霉素与30、40、50 μg/mL的竹柳多糖药液,上述各组斑马鱼均置于28.5 ℃的培养箱中连续处理2 h。处理结束后,对斑马鱼进行形态观察并统计各组的累计死亡率、累计孵化率、畸形率和心率。
1.3.3 竹柳多糖对功能型毛细胞的保护活性评价
受精6 dpf的斑马鱼随机分成空白对照组、造模组和不同浓度的竹柳多糖处理组分别为a:空白对照组、b:卡那霉素造模组、c:30 μg/mL竹柳多糖+卡那霉素组、d:40 μg/mL竹柳多糖+卡那霉素组、e:50 μg/mL竹柳多糖+卡那霉素组。空白对照组内不添加任何待测物,置于28.5 ℃的培养箱中连续处理1 h。造模组中添加终浓度为200 μΜ的卡那霉素,置于28.5 ℃的培养箱中连续处理1 h。不同浓度竹柳多糖处理组中首先分别添加终浓度为30、40、50 μg/mL的竹柳多糖,置于28.5 ℃的培养箱中预处理1 h,随后加入终浓度为200 μΜ的卡那霉素,在28.5 ℃的培养箱中继续处理1 h。处理结束后,将上述各组仔鱼置于5 μM 的FM1-43染料中,避光孵育3 min。随后使用麻醉剂将仔鱼麻醉,荧光显微镜下观察计数耳石附近5簇功能型毛细胞(O1、MI1、MI2、O2和IO4)的数量(n=15)[10]。
1.3.4 感觉毛细胞内ROS含量检测
受精6 dpf的斑马鱼如“1.3.3”所述方法处理后,应用CellROX Deep Red试剂盒,对感觉毛细胞内的ROS进行荧光标记,操作方法参照试剂盒说明。标记结束后,清洗各组仔鱼,荧光显微镜下观察拍摄耳石周围被标记为红色荧光的ROS。
1.3.5 凋亡感觉毛细胞检测
受精6 dpf的斑马鱼如“1.3.3”所述方法处理后,应用TUNEL BrightRed凋亡检测试剂盒,对发生凋亡的感觉毛细胞进行特异标记,操作方法参照试剂盒说明。标记结束后,清洗各组仔鱼,荧光显微镜下观察拍摄耳石周围被标记为红色荧光的凋亡毛细胞。
1.4 统计分析
使用GraphPad Prim version 6软件对数据进行t检验和单因素方差分析,数据以均数±标准误(mean±SEM)表示,P<0.05代表差异显著。
2 结果
2.1 竹柳多糖对斑马鱼一般指标的影响
不同浓度竹柳多糖连续作用斑马鱼胚胎96 h后,如图1所示,空白对照组内无胚胎畸形情况发生,其累计死亡率、孵化率分别为2.50%±1.44%、97.40%±0.03%,心率为198.60±2.27(见表1)。30、40和50 μg/mL的竹柳多糖连续处理斑马鱼96 h后,亦无胚胎畸形情况发生,其死亡率分别为2.50%±2.50%、10.00%±3.82%、5.83%±2.21%,孵化率分别为100.00%、98.04%±1.96%、99.07%±0.93%,心率分别为198.90±1.59、198.30±2.15、205.35±2.00(见图1、表1)。不同浓度竹柳多糖处理组在死亡率、孵化率和心率等方面与空白对照组相比,均无显著性差异。上述结果提示,当竹柳多糖的作用浓度为30、40、50 μg/mL时,它对斑马鱼没有明显的毒性作用。
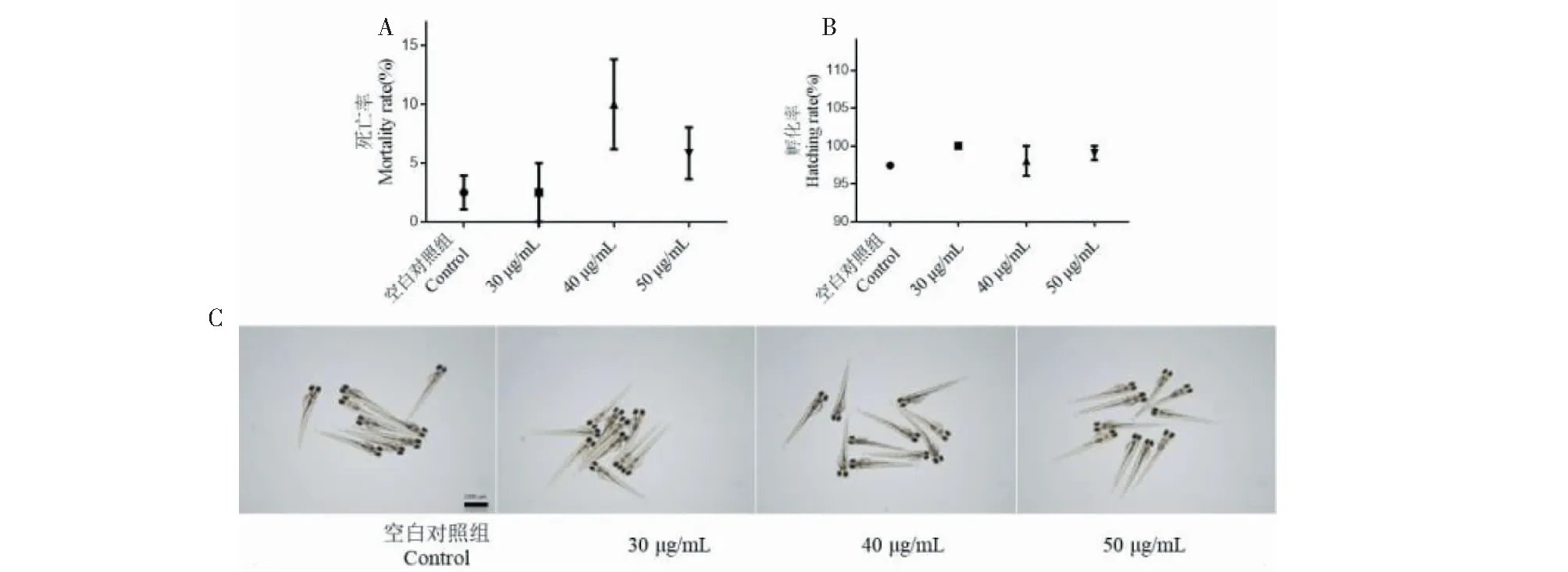
图1 竹柳多糖的安全性评价Fig.1 Safety evaluation of bamboo willow polysaccharides注:A:竹柳多糖连续作用96 h后斑马鱼的累计死亡率;B:竹柳多糖连续作用96 h后斑马鱼的累计孵化率;C:竹柳多糖连续作用96 h后斑马鱼的形态。Note:A:Cumulative mortality of zebrafish after 96 h continuous treatment with bamboo willow polysaccharides;B:Cumulative hatching rate of zebrafish after 96 h continuous treatment with bamboo willow polysaccharides;C:Morphology of zebrafish after continuous treatment with bamboo willow polysaccharides for 96 h.

表1 96 hpf幼鱼每分钟心率Table 1 Zebrafish heart rate per minute of 96 hpf = 20)
2.2 竹柳多糖与卡那霉素共处作用后对斑马鱼心率及形态的影响
不同浓度竹柳多糖与卡那霉素共同作用6 dpf斑马鱼2 h后,各组斑马鱼均发育正常,且无死亡现象,如图2所示。在空白对照组中,斑马鱼的平均心率为195.80±3.28;在30、40和50 μg/mL的联合暴露组中,斑马鱼的心率分别为193.70±2.27、197.00±2.86、197.30±1.95(见表2)。不同浓度联合暴露组的斑马鱼心率与空白对照组相比,均无统计学差异。上述结果提示,当竹柳多糖的作用浓度为30、40、50 μg/mL时,它与200 μM的卡那霉素联合作用斑马鱼后,不具有明显的联合毒性。
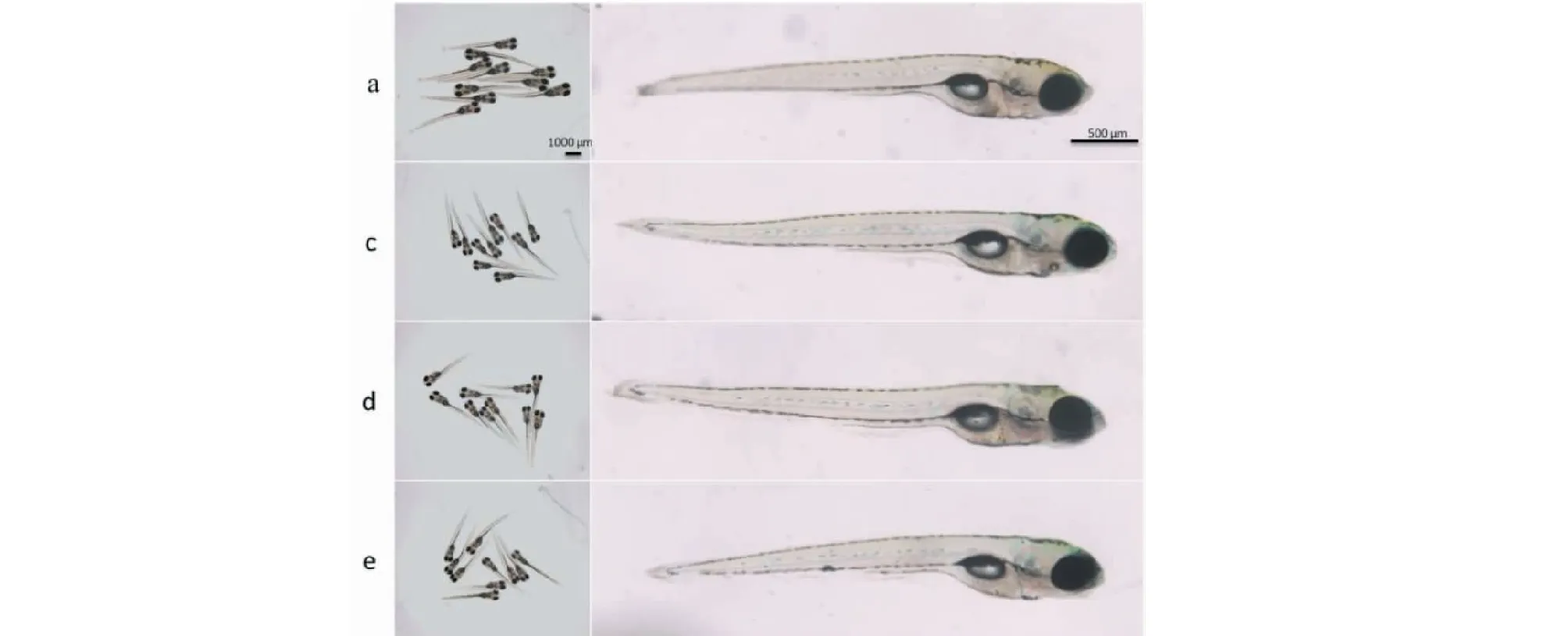
图2 竹柳多糖与卡那霉素的联合毒性评价Fig.2 Evaluation of joint toxicity of bamboo willow polysaccharides and kanamycin注:不同浓度竹柳多糖与卡那霉素联合作用后,斑马鱼形态发育正常,脊柱与尾巴均无弯曲、卵黄囊无畸形、心包无水肿(a:空白对照组;c:30 μg/mL竹柳多糖+卡那霉素组;d:40 μg/mL竹柳多糖+卡那霉素组;e:50 μg/mL竹柳多糖+卡那霉素组)。Note:Morphology of zebrafish treated with kanamycin and polysaccharides (a:Control;c:30 μg/mL bamboo willow polysaccharides+kanamycin;d:40 μg/mL bamboo willow polysaccharides+kanamycin;e:50 μg/mL bamboo willow polysaccharides+kanamycin).
表2 斑马鱼每分钟心率Table 2 Zebrafish heart rate per minute = 15)
2.3 竹柳多糖对卡那霉素诱导的感觉毛细胞损伤的影响
FM1-43是一种特异的荧光染料,它可以通过感觉毛细胞上的机械感知通道进入胞内[11]。机械感知通道是一种机械敏感的离子通道,它可将声波的机械振动转化为电信号,是感觉毛细胞行使听觉功能的关键[12]。为了明确竹柳多糖对卡那霉素诱导的感觉毛细胞损伤是否具有保护功效,应用FM1-43对功能型的感觉毛细胞进行了特异标记,结果如图3所示。在空白对照组中,斑马鱼侧线处的感觉毛细胞均被特异标记,其耳石周围5簇功能型毛细胞的平均数量为48.64±4.17。但是当浓度为200 μM的卡那霉素连续作用斑马鱼1 h后,其侧线处功能型毛细胞的数量明显减少,与空白对照组相比具有明显的统计学差异。当30、40、50 μg/mL的竹柳多糖与卡那霉素共同作用时,与卡那霉素处理组相比,毛细胞数量显著增加,且毛细胞的数量与竹柳多糖的作用浓度呈正相关性(见图3、表3)。上述结果提示,竹柳多糖对卡那霉素诱导的感觉毛细胞损伤具有一定的保护活性。
表3 各组斑马鱼耳石周围五簇功能型毛细胞的数量Table 3 Numbers of five clusters of functional hair cells around otoliths in zebrafish in each group = 15)
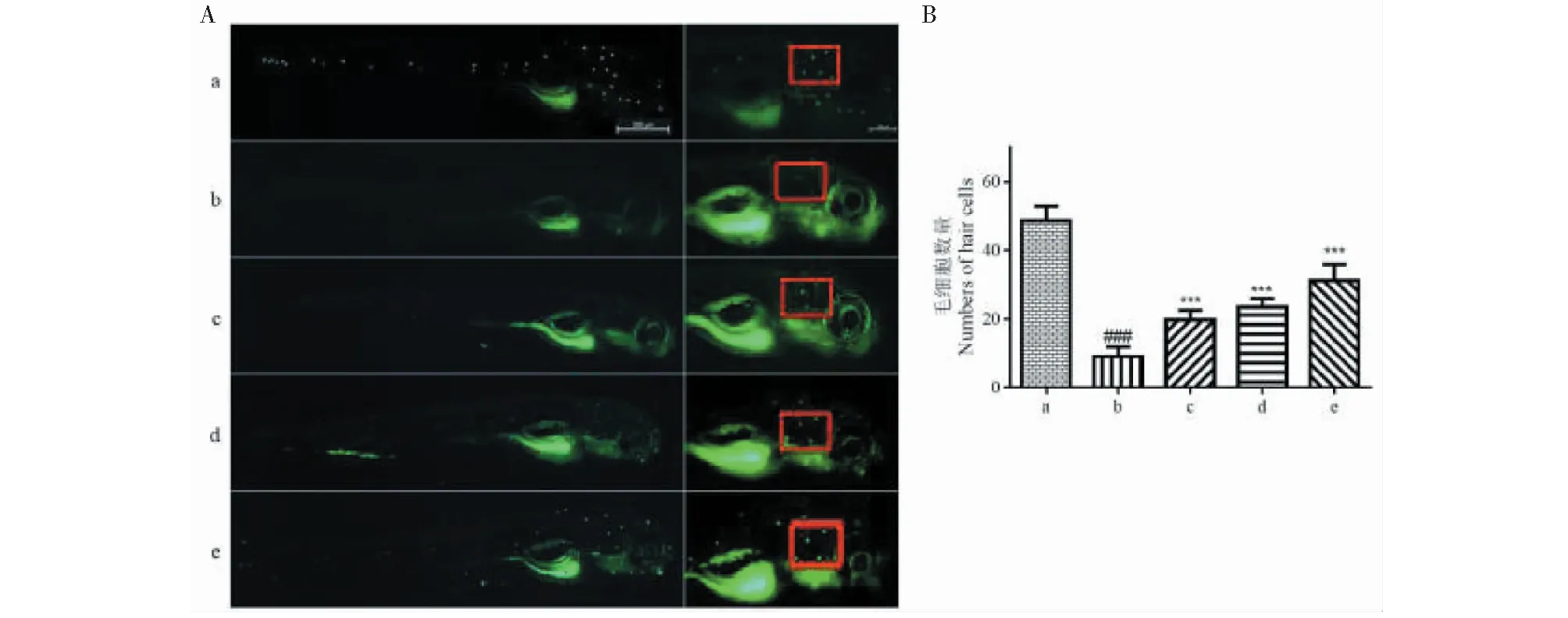
图3 竹柳多糖对感觉毛细胞的保护功效Fig.3 Protective effect of bamboo willow polysaccharides on sensory hair cells注:A:被特异标记的功能型毛细胞(a:空白对照组;b:卡那霉素造模组;c:30 μg/mL竹柳多糖+卡那霉素组;d:40 μg/mL竹柳多糖+卡那霉素组;e:50 μg/mL竹柳多糖+卡那霉素组,下同);B:各组斑马鱼耳石周围五簇功能型毛细胞的数量统计。红色方框:耳石周围的五簇毛细胞;###卡那霉素造模组vs空白对照组,P<0.001;***竹柳多糖处理组vs卡那霉素造模组,P<0.001)。Note:A Functional hair cells that are specifically labeled(a:Control;b:kanamycin;c:30 μg/mL bamboo willow polysaccharides+kanamycin;d:40 μg/mL bamboo willow polysaccharides+kanamycin;e:50 μg/mL bamboo willow polysaccharides+kanamycin,the same below);B Numbers of five clusters of functional hair cells around the otolith of zebrafish in each group.Red box:five clusters of hair cells around the otolith;###Kanamycin vs control,P<0.001; ***Bamboo willow polysaccharides vs kanamycin,P<0.001).
2.4 竹柳多糖对卡那霉素诱导的ROS积聚的影响
由于ROS的过量积聚在卡那霉素诱导感觉毛细胞损伤中起着重要作用,因此为了明确竹柳多糖的感觉毛细胞保护机制,对毛细胞内的ROS含量进行了检测。结果发现,与空白对照组相比,200 μM的卡那霉素可导致毛细胞内ROS水平的升高,但是当30、40、50 μg/mL的柳多糖与卡那霉素共同作用时,毛细胞内的ROS含量明显减少(见图4)。
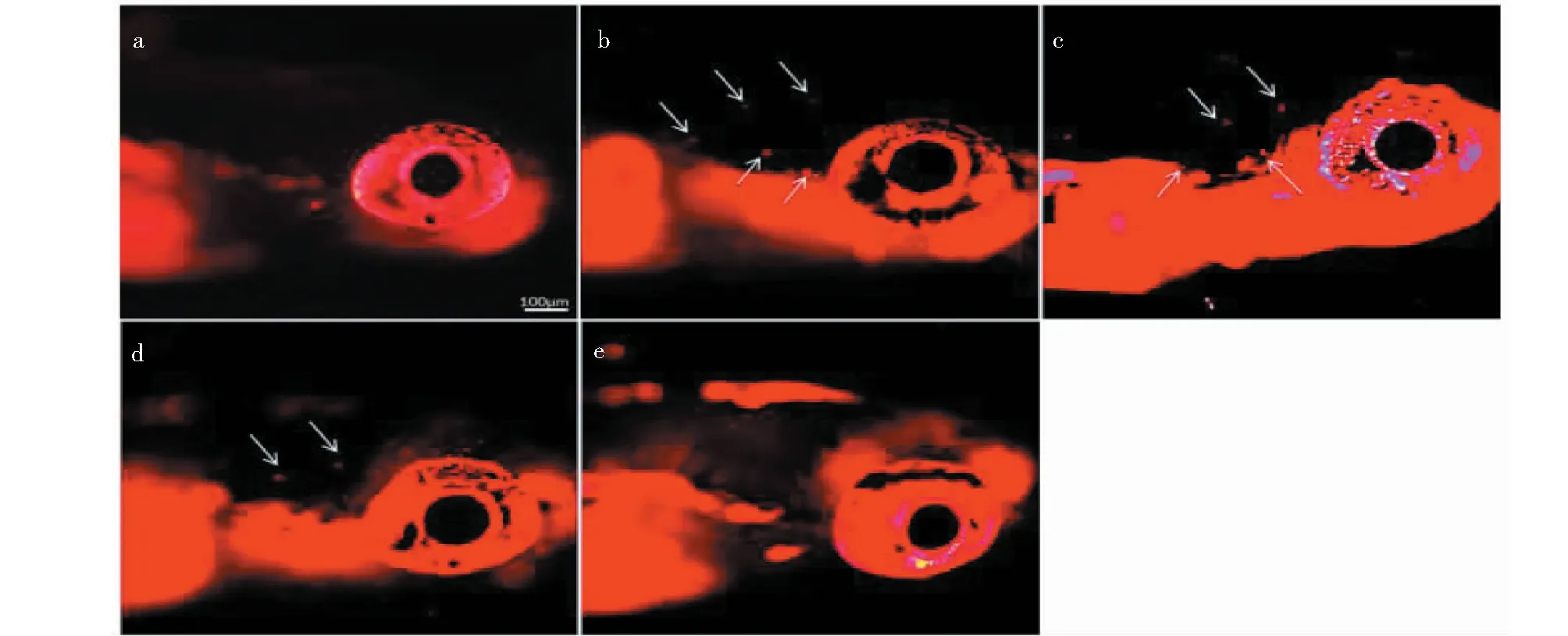
图4 感觉毛细胞内ROS检测Fig.4 Detection of ROS in sensory hair cells注:白色箭头:被红色荧光标记的ROS。Note:The white arrows:ROS in sensory hair cells were labeled by red fluorescence.
上述结果提示,竹柳多糖有效抑制了感觉毛细胞中卡那霉素诱导的ROS的积聚。
2.5 竹柳多糖对卡那霉素引起的感觉毛细胞凋亡的影响
为了进一步明确竹柳多糖的感觉毛细胞保护机制,对毛细胞的凋亡进行了检测。如图5所示,与空白对照相比,200 μM卡那霉素连续作用斑马鱼1 h后,毛细胞的凋亡发生率明显增加。但是当30、40或50 μg/mL的竹柳多糖与卡那霉素共同作用时,与卡那霉素单独处理组相比,发生凋亡的毛细胞明显减少。上述结果提示,竹柳多糖抑制了卡那霉素诱导的感觉毛细胞凋亡的发生。
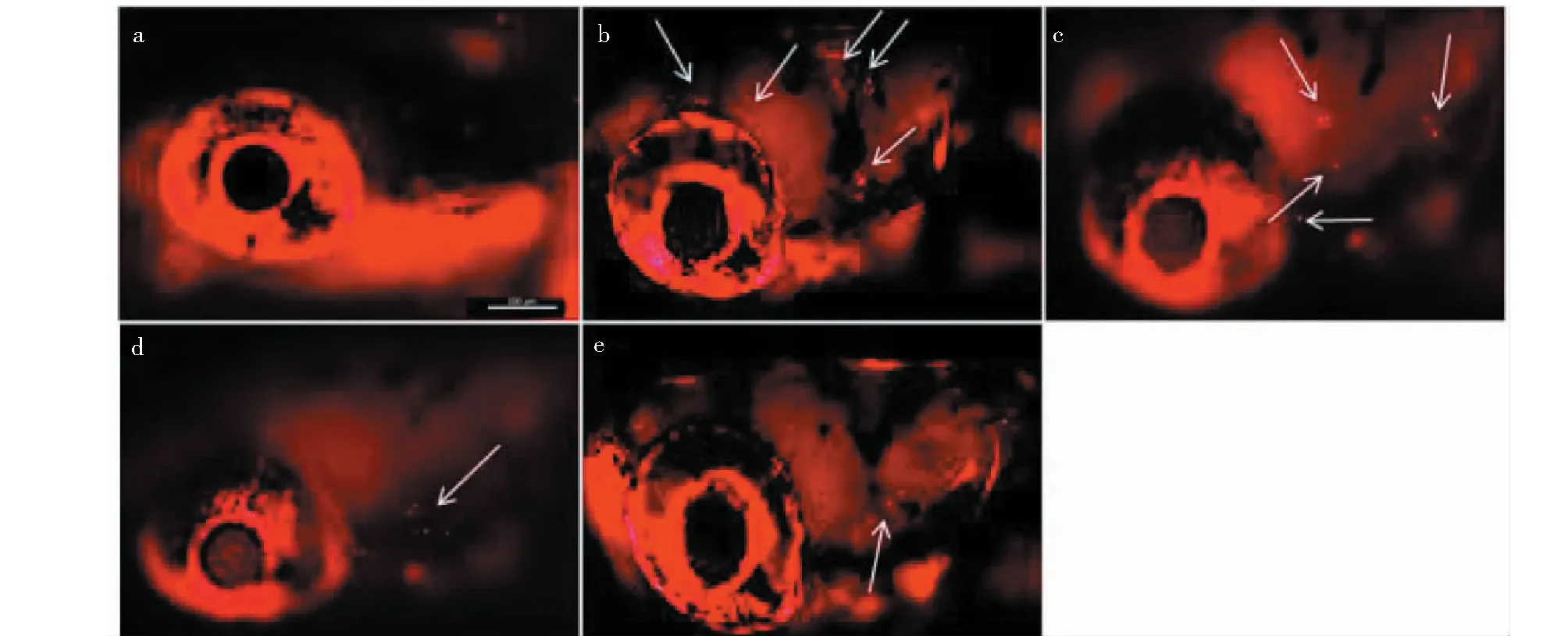
图5 感觉毛细胞凋亡检测Fig.5 TUNEL assay of sensory hair cells注:白色箭头:发生凋亡的毛细胞。Note:The white arrow:Apoptotic cells were marked as red dots.
3 讨论与结论
卡那霉素作为氨基糖苷类抗生素的代表药物之一,价格低廉、抗菌谱广,性质稳定,应用十分广泛[13]。但是它却具有较强的耳毒性[14]。卡那霉素致聋的作用机制比较复杂,内耳感觉毛细胞内ROS的过量积聚在其中发挥着重要作用,而抗氧化剂则可在一定程度上防治卡那霉素引起的感觉毛细胞损伤[15]。基于此,本项目以自主发现的具有抗氧化活性的竹柳多糖作为研究对象,应用斑马鱼模型对其感觉毛细胞保护活性进行了初步研究。
研究发现,当30、40或50 μg/mL的竹柳多糖单独作用于斑马鱼后,斑马鱼的累计孵化率均高于98%,累计死亡率均低于15%,心率均在每分钟198~210次之间。虽然在40 μg/mL的处理组中,斑马鱼的累计死亡率略高,但是经过统计学检测后发现,上述三组斑马鱼(30、40、50 μg/mL)的累计孵化率、死亡率以及心率与空白对照组相比,均无统计学差异。该结果提示,竹柳多糖对斑马鱼无明显毒性或致畸作用。进一步的研究发现,竹柳多糖与卡那霉素共同作用时,对斑马鱼亦无明显的毒性或致畸作用。但是在此浓度下,该多糖对卡那霉素诱导的感觉毛细胞损伤却具有明显的保护活性,且可有效减少毛细胞内卡那霉素诱导的ROS的积聚,并抑制毛细胞凋亡的发生。ROS作为机体内一类氧的单电子还原产物,是电子从呼吸链中泄露,并消耗约2%的氧气后生成的[16]。机体内部的ROS并不总是有害的。适量ROS可促进修复、免疫、生长和存活等[17]。但是在病理条件下,ROS产生与清除的动态平衡会发生紊乱,ROS长时间的过量积聚往往会对蛋白质、核酸、多糖和脂质等生物大分子造成伤害,使细胞处于氧化应激状态,并诱导其凋亡[15]。本研究发现,在体外具有抗氧化活性的竹柳多糖亦可在感觉毛细胞内发挥其抗氧化功效。该多糖可通过降低感觉毛细胞内ROS的含量,缓解其氧化损伤程度,并最终抑制卡那霉素诱导的凋亡的发生,对毛细胞起到保护作用。又由于该多糖不具有明显的毒性或致畸作用,因此上述结果提示,竹柳多糖在听觉保护领域具有一定的应用潜能。
天然产物来源的多糖是一类结构复杂的高分子化合物。大量研究已证实,多糖通常具有抗氧化活性[18],且该活性与多糖中甘露糖、半乳糖和糖醛酸的含量密切相关[19]。例如甘露糖、半乳糖和糖醛酸等均易与ROS相互作用,进而使糖苷键发生裂解或使糖醛酸氧化。本研究所用竹柳多糖含有约13.05%的甘露糖,3.22%的葡萄糖醛酸及5.45%的D-半乳糖醛酸。由此推测,竹柳多糖的感觉毛细胞保护活性可能是由其单糖组成决定的。竹柳多糖内的甘露糖与糖醛酸均有助于其快速降低感觉毛细胞内的ROS含量,进而起到感觉毛细胞保护活性。
竹柳生长迅速、抗逆性强、经济效益高、适应性强、近年来在我国的种植面积迅速扩大[20]。目前对于竹柳的研究主要集中在抗旱,耐盐碱,病虫害防治等领域[21],而对其提取物功效的研究鲜有报道。本研究通过在体实验,证实竹柳多糖对氨基糖苷类抗生素诱导的感觉毛细胞损伤具有一定的保护活性,并发现该保护活性与竹柳多糖的抗氧化性密切相关。本研究所得数据可为药源性耳聋的防治提供新的实验数据,并有助于拓宽竹柳的应用领域,促进其高值化应用。

