柴胡皂苷A减轻脑缺血再灌注大鼠海马神经元损伤
马大亮, 崔红莉, 荣卫江, 贾琦, 黄福献
1.新疆维吾尔自治区第三人民医院脑病中心,乌鲁木齐 830000; 2.新疆心脑血管病医院神经内科,乌鲁木齐 830000 3.新疆医科大学第六附属医院建工医院神经外科,乌鲁木齐 830000
脑血管疾病是危害老年人健康的常见疾病,具有发病率高,致残率高,死亡率高的特点[1]。脑缺血再灌注(ischemia reperfusion,I/R)损伤是缺血区域的血
流再灌注导致严重的脑损伤和相关功能障碍[2]。近年来,中药对脑缺血再灌注损伤的防治受到重视。柴胡皂苷A(Saikosaponin A,SA)是一种从药用植物柴胡中提取的三萜皂苷,具有抗炎和抗氧化作用[3]。据报道,在体外,柴胡皂苷A能抑制LPS诱导的原代小鼠巨噬细胞中TNF-α和IL-1β的产生[4],能抑制LPS诱导的人脐静脉内皮细胞的炎症和氧化应激[5]。在体内,柴胡皂苷A可通过抑制NF-κB活化来预防实验性败血症[6],还可保护小鼠免受葡聚糖硫酸钠诱发的结肠炎[7]。然而,目前尚未见报道柴胡皂苷A对脑缺血再灌注损伤具有保护作用。脑缺血引起的脑组织损伤的病理机制很复杂,包括炎症反应,氧化应激,细胞凋亡等[8]。沉默信息调节器1(silent information regulator 1,SIRT1)是细胞周期调节因子,是能量代谢和基因稳定的关键基因,也是缺血性脑血管病的潜在治疗靶点[9]。本研究主要探讨柴胡皂苷A对脑缺血再灌注大鼠海马神经元损伤和氧化应激、SIRT1水平的影响,期为防治缺血性脑血管疾病的临床应用和实验研究提供依据和思路。
1 材料与方法
1.1 材料
1.1.1 药品及试剂 柴胡皂苷A(HPLC>98%,批号:20180213;规格:1 g)购自美国Sigma公司;尼莫地平(HPLC>98%,批号:20170826;规格:50 mg)购自上海士锋生物科技有限公司;二喹啉甲酸蛋白定量试剂盒(批号:20180521)购自美国PIERCE公司;MatrigelTM底膜基质(批号:20170816)购自美国BD公司;Caspase3抗体(批号:20180219),Caspase9抗体(批号:20180313),Bax抗体(批号:20170427),Bcl-2抗体(批号:20170506),SIRT1抗体(批号:20170422)购自美国Sigma公司;HRP标记的山羊抗大鼠二抗(批号:20180602)购自美国Santa Cruz公司;大鼠CKMb ELISA试剂盒(批号:20180608),Mb ELISA试剂盒(批号:20181011)购自武汉博士德生物工程有限公司;SOD试剂盒(批号:20170229)、MDA试剂盒(批号:20170512)、LDH试剂盒(批号:20170324)购自南京建成生物工程研究所。
1.1.2 仪器 Varioskan Flash多功能酶标仪(美国Thermo Fisher公司);OLYMPUSDP71显微镜(日本奥林巴斯光学有限公司);高速低温离心机(Beckman公司,美国);电泳槽,电转仪(美国Bio-Rad公司);凝胶成像系统GDS-800 UVP(美国UVP公司)。
1.1.3 动物 选用54只SPF级健康成年雄性SD大鼠,鼠龄8个月,体重240~280 g,购自新疆维吾尔自治区实验动物研究中心,生产许可证号:SCXK(新)2016-0001。所有动物实验符合动物伦理委员会标准。实验动物在标准条件下适应性饲养1周后用于实验。
1.2 实验方法
1.2.1 动物分组及给药 随机分为6组,每组9只大鼠,分别为假手术组(Sham);模型组(I/R,双侧颈总动脉结扎术建立脑缺血再灌注模型);柴胡皂苷A 1 mg/kg组(I/R+SA 1 mg/kg);柴胡皂苷A 5 mg/kg组(I/R+SA 5 mg/kg);柴胡皂苷A 10 mg/kg(I/R+SA 10 mg/kg);尼莫地平1 mg/kg组(I/R+NMDP 1 mg/kg)。建模成功后分别用1、5、10 mg/kg的柴胡皂苷A或1 mg/kg尼莫地平灌胃给药,每日给药1次,给药容积是1 ml,连续给药7 d。假手术组和模型组灌胃等量生理盐水。
1.2.2 脑缺血再灌注模型构建方法 将大鼠仰卧位固定,腹腔注射戊巴比妥钠(30 mg/kg)进行麻醉,分离双侧颈总动脉(common carotid artery,CCA)用微动脉夹夹闭10 min,松开10 min,再夹闭10 min复制大鼠脑缺血再灌注模型[10]。
1.2.3 脑损伤指标检测 记录各组大鼠跳台实验犯错次数,Y迷宫实验检测新异臂进入次数;然后处死大鼠,取脑,去除嗅球、小脑和低位脑干后称湿重,置于培养皿中,滤纸吸干表面水分,入烘箱90℃烘干后取出,经多次称量直至恒重后记录,作为组织干重。计算脑含水率及脑指数。
脑含水率(%)=(湿重-干重)/湿重×100%;脑指数=脑湿重/体重×100
1.2.4 HE染色观察脑组织病理损伤 取部分脑组织放入4%多聚甲醛溶液进行固定,24 h后脱水,石蜡包埋、切片;然后HE染色:将切片分别置于二甲苯Ⅰ和二甲苯Ⅱ、100%、95%、90%、80%、70%的酒精各10 min,自来水冲洗;苏木精染色、伊红染色;由低到高浓度酒精梯度脱水,二甲苯透明,中性树脂封片;光学显微镜拍照,观察其形态特征。
1.2.5 尼氏小体染色检测神经元凋亡 取部分脑组织放入4%多聚甲醛溶液固定30 min,将标本移至30%蔗糖溶液约72 h,OCT胶进行包埋,再进行冰冻切片。将脑片置于尼氏液中室温下染色10 min;75%、95%、100%酒精各脱色1 min,二甲苯透明10 min,中性树胶封片;显微镜下观察照相。
1.2.6 蛋白免疫印迹法检测凋亡相关蛋白和SIRT1的表达 取适量脑组织匀浆,加入含有蛋白酶抑制剂的RIPA裂解液,1:3加入,匀浆,12000 r·min-1离心10 min,取上清,根据BCA试剂盒说明书测蛋白浓度。匀浆上清液与上样缓冲液1:1配比,电泳,转膜,封闭,一抗4℃过夜,二抗室温孵育1 h,TBST漂洗,ECL发光剂显影,采用BIO-RAD Gel Doc XR+凝胶成像系统采集图像,用Image J2x软件对各抗体条带灰度值进行统计。
1.2.7 试剂盒检测脑组织氧化应激水平 取适量脑组织匀浆,分别采用SOD,MDA,LDH试剂盒测定超氧化物歧化酶(superoxide dismutase,SOD)活性和丙二醛(malondialdehyde,MDA),乳酸脱氢酶(lactate dehydrogenase,LDH)的水平。操作步骤严格按照试剂盒说明书进行。
1.3 统计学方法
用软件SPSS 21.0对所有实验数据进行统计分析,组间差异采用t检验或单因素方差分析进行检验。实验结果以(均数±标准差)(±s)表示。以P<0.05认为差异有统计学意义。
2 结果
2.1 跳台实验及Y迷宫实验结果
如图1所示,与假手术组比较,模型组大鼠跳台实验犯错次数显著增加(P<0.05);新异臂进入次数显著减少(P<0.05)。与模型组比较,柴胡皂苷A 5 mg/kg组、柴胡皂苷A 10 mg/kg组和尼莫地平1 mg/kg组大鼠跳台实验犯错次数显著减少(P<0.05);新异臂进入次数显著增加(P<0.05)。
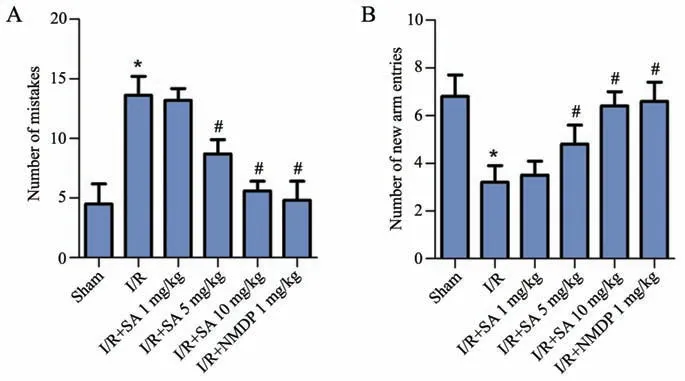
图1 跳台实验犯错次数(A)和Y迷宫实验新异臂进入次数(B)统计图*P<0.05,与假手术组相比#P<0.05,与I/R组相比n=9Fig.1 Statistical chart of the number of errors made in the step-down test(A) and number of new arm entries(B)*P<0.05 vs Sham group;#P<0.05 vs I/Rgroup;n=9
2.2 HE染色结果
如图2所示,假手术组海马区域组织染色均匀、结构清晰,神经细胞形态正常;模型组海马区域结构紊乱、间质水肿、胞核出现深染、固缩、碎裂。与模型组比较,柴胡皂苷A 5 mg/kg组、柴胡皂苷A 10 mg/kg组和尼莫地平1 mg/kg组海马区神经元病变范围变小,程度减轻。与假手术组比较,模型组大鼠脑梗死率,脑含水率和脑指数均显著升高(P<0.05)。与模型组比较,柴胡皂苷A 5 mg/kg组、柴胡皂苷A 10 mg/kg组和尼莫地平1 mg/kg组大鼠脑梗死率,脑含水率和脑指数均显著降低(P<0.05)。
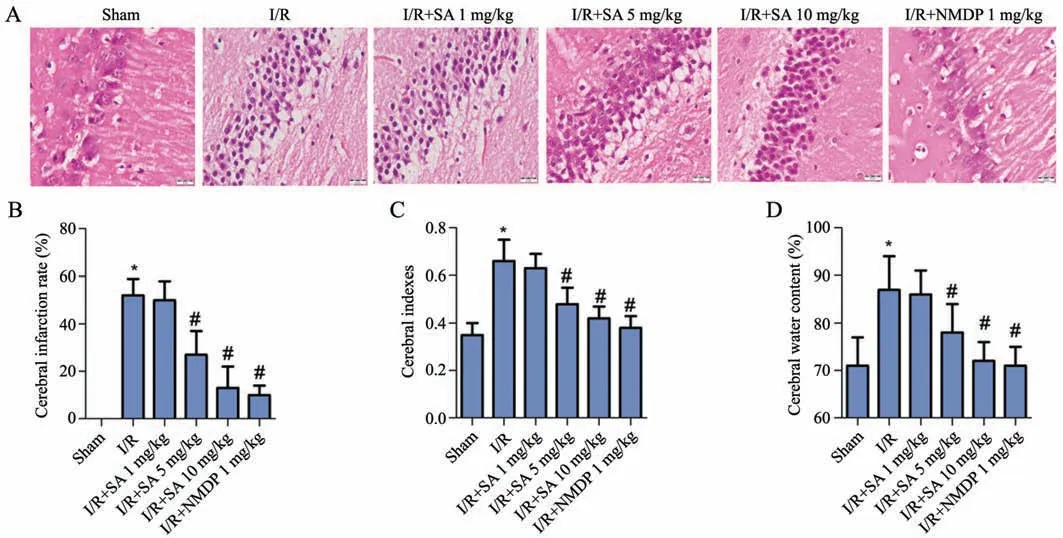
图2 HE染色观察脑组织病理损伤(A)及脑梗死率(B)、脑指数(C)、脑含水量(D)统计图*P<0.05,与假手术组相比 #P<0.05,与I/R组相比n=9Fig.2 Statistical chart of pathological damage of brain tissue(A),cerebral infarction rate(B),brain index(C),brain water content(D),detected by HEstaining*P<0.05 vs Sham group;#P<0.05 vs I/Rgroup;n=9
2.3 柴胡皂苷A对脑缺血再灌注大鼠神经元凋亡的影响
如图3所示,尼氏小体染色结果显示,假手术组海马区域组织结构清晰,神经细胞形态正常;脑损伤模型组海马区域结构紊乱、神经细胞数量减少、细胞核碎裂、溶解及尼氏小体崩解及丢失。与模型组比较,柴胡皂苷A 5 mg/kg组、柴胡皂苷A 10 mg/kg组和尼莫地平1 mg/kg组海马区神经元损伤程度减轻。免疫印迹结果显示,与假手术组比较,模型组Bax/Bcl-2、Cleaved caspase3/caspase3 和 Cleaved caspase9/caspase9的比值均显著升高(P<0.05)。与模型组比较,柴胡皂苷A 5 mg/kg组、柴胡皂苷A 10 mg/kg组和尼莫地平1 mg/kg组Bax/Bcl-2、Cleaved caspase3/caspase3和Cleaved caspase9/caspase9的比值显著降低(P<0.05)。
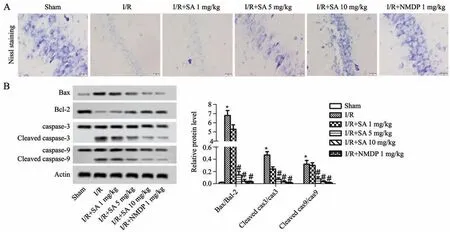
图3 柴胡皂苷A对脑缺血再灌注大鼠神经元凋亡的影响A:尼氏小体染色检测神经元凋亡B:蛋白印迹检测Bax/Bcl-2、Cleaved caspase3/caspase3和Cleaved caspase9/caspase9表达水平*P<0.05,与假手术组相比#P<0.05,与I/R组相比n=9Fig.3 Effect of different concentrationsof saikosaponin A on neuronal apoptosisin ratswith cerebral ischemia-reperfusion A:The neuron apoptosis was detected by Nissl body staining;B:The expression levels of Bax/Bcl-2,Cleared caspase3/caspase3 and Cleared caspase9/caspase9 weredetected by Western blotting;*P<0.05 vs Sham group;#P<0.05 vs I/Rgroup;n=9
2.4 柴胡皂苷A对脑缺血再灌注大鼠氧化应激的影响
如图4所示,与假手术组比较,模型组SOD活性显著降低(P<0.05);MDA和LDH的含量均显著升高(P<0.05)。与模型组比较,柴胡皂苷A 5 mg/kg组、柴胡皂苷A 10 mg/kg组和尼莫地平1 mg/kg组10 mg/kg组SOD活性显著升高(P<0.05),MDA和LDH的含量均显著降低(P<0.05)。
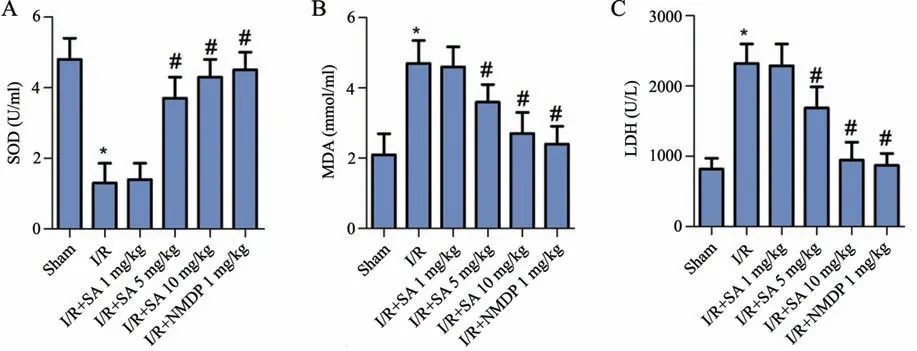
图4 柴胡皂苷A对脑缺血再灌注大鼠氧化应激的影响A:SOD活性统计图B:MDA含量统计图C:LDH含量统计图 *P<0.05,与假手术组相比#P<0.05,与I/R组相比n=9Fig.4 Effects of different concentrations of saikosaponin A on oxidative stress in rats with cerebral ischemiareperfusion A:Statistical chart of SOD activity;B:Statistical chart of MDA content;C:Statistical chart of LDH content;*P<0.05 vs Sham group;#P<0.05 vs I/Rgroup;n=9
2.5 柴胡皂苷A对SIRT1表达的影响
如图5所示,与假手术组比较,模型组SIRT1 mRNA表达和SIRT1蛋白表达水平均显著降低(P<0.05)。与模型组比较,柴胡皂苷A 5 mg/kg组、柴胡皂苷A 10 mg/kg组和尼莫地平1 mg/kg组SIRT1 mRNA表达和SIRT1蛋白表达水平均显著升高(P<0.05)。
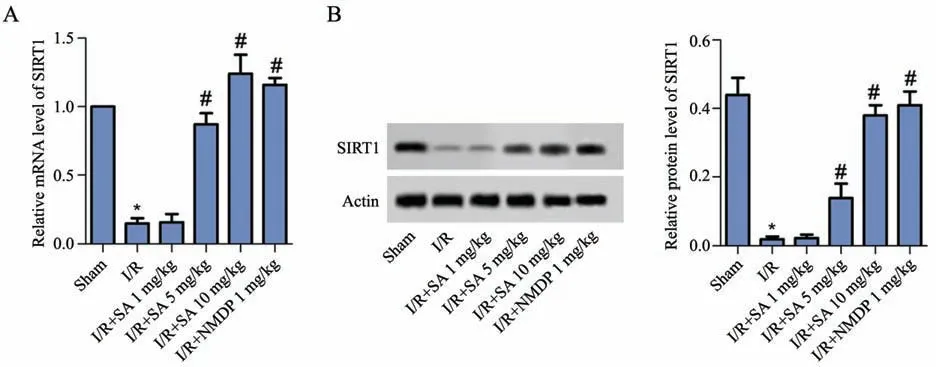
图5 柴胡皂苷A对SIRT1表达的影响A:RT-qPCR检测SIRT1 mRNA表达统计图B:蛋白印迹检测SIRT1蛋白表达*P<0.05,与假手术组相比#P<0.05,与I/R组相比n=9Fig.5 Effect of different concentrations of saikosaponin A on the expression of SIRT1 A:Statistical chart of SIRT1 mRNA expression detected by RT-qPCR;B:SIRT1 protein expression detected by Western blot;*P<0.05 vs Sham group;#P<0.05 vs I/Rgroup;n=9
3 讨论
由脑缺血引起的脑组织损伤的病理机制很复杂,包括炎症反应,氧化应激,细胞凋亡,能量代谢,钙超载和其他因素[11]。缺血区域的血流再灌注会导致严重的脑损伤和相关功能障碍,尤其是神经元和神经胶质细胞的损伤[12]。柴胡皂苷A是从柴胡中提取的三萜皂苷,具有广泛的药理活性[13]。本研究结果显示,经柴胡皂苷A处理后,大鼠跳台实验犯错次数减少;新异臂进入次数增加,海马神经元损伤减轻,脑梗死率,脑含水率和脑指数均降低,提示柴胡皂苷A能减缓脑缺血再灌注引起的脑损伤,起到脑保护的作用。
凋亡信号传导途径由胱天蛋白酶介导,其中,caspase-3和caspase-9是凋亡过程中的关键介体。凋亡途径可以通过caspase-9启动,并通过切割下游执行者caspase-3触发凋亡[14,15]。作为Bcl-2家族的2种典型蛋白质,Bcl-2和Bax在caspase依赖性细胞凋亡中起关键作用。Bcl-2是一种抗凋亡蛋白,主要位于细胞核和线粒体膜上,而促进凋亡的家族成员Bax主要位于细胞质中。Bcl-2在抑制Bax诱导的caspase依赖性凋亡方面具有很强的抗凋亡作用。因此,高比例的Bcl-2/Bax被认为具有抗凋亡的作用[16]。研究发现,柴胡皂苷A能够通过调节Bcl-2家族介导caspase-3依赖性和独立性的凋亡,导致线粒体功能障碍和凋亡因子的释放[17]。本研究结果显示,经柴胡皂苷A处理后,Bax/Bcl-2,Cleaved caspase3/caspase3 和 Cleaved caspase9/caspase9蛋白表达水平的比值降低,提示柴胡皂苷A能够抑制脑缺血再灌注引起的神经元凋亡。
氧化应激可与细胞膜、脂质和蛋白质等细胞的几种基本成分相互作用[18]。据报道,在炎症条件下,脂质氧化的标志物MDA的浓度非常高,其浓度与氧化负荷的程度有关[19]。研究发现,柴胡皂苷A处理能提高抗氧化酶(Nrf2,HO-1,SOD,GSH,GST和过氧化氢酶)活性,降低MDA含量,因此证实柴胡皂苷A不仅通过抑制活性氧的产生来提高抗氧化酶的水平,还可通过抑制脂质过氧化来增强其抗氧化潜能[20]。本研究结果显示,柴胡皂苷A处理后,SOD活性升高,MDA和LDH的含量降低,提示柴胡皂苷A可缓解脑缺血再灌注引起的氧化应激。
沉默信息调节器1(silent information regulator 1,SIRT1)有助于细胞调节。SIRT1是神经系统疾病的保护因子,可以调节基因表达并适应细胞代谢[21]。SIRT1促进自噬并减少缺氧诱导的凋亡,从而保护心肌细胞免受缺氧应激的影响[22]。研究发现,上调SIRT1可以促进自噬并抑制体外细胞凋亡,因此对氧葡萄糖剥夺/再灌注诱导的损伤具有潜在的神经保护作用[23]。本研究结果显示,经柴胡皂苷A处理后,SIRT1 mRNA和蛋白表达水平均升高,提示柴胡皂苷A对脑缺血再灌注引起的神经元损伤缓解作用与SIRT1上调有关。
综上所述,胡皂苷A能缓解缺血再灌注大鼠海马神经元损伤和氧化应激,其机制与SIRT1上调有关。本实验可为防治缺血性脑血管疾病的临床应用和实验研究提供依据和思路。