喷施外源GABA对高温条件下茶树叶片部分生理指标的影响
曹 语, 任太钰, 马媛春, 李 芳, 房婉萍, 朱旭君
(南京农业大学园艺学院, 江苏 南京 210095)
茶树〔Camelliasinensis(Linn.) Kuntze〕生长发育的适宜年均温为15 ℃~20 ℃,极端的高温或低温会对茶树造成热害和冻害等伤害。高温会导致茶树的光合系统损伤、叶绿素含量降低、活性氧积累以及酶活性破坏;连续的高温天气还会造成茶树叶片的灼伤烧焦,并使茶树根系活力降低,进而影响茶树的正常生长发育,降低茶叶的品质和产量[1-4]。
γ-氨基丁酸(GABA)的合成途径涉及氮素贮藏、pH值调节、生长发育和免疫过程等[5];植物抵抗缺氧、干旱和高温等逆境胁迫时,GABA代谢支路起着重要作用[6],[7]9。黄娟[8]认为,在高温胁迫下外源GABA可降低植物叶片的相对电导率和丙二醛含量,减缓叶绿素的分解,提高脯氨酸和可溶性糖含量,并能有效增强抗氧化酶活性及光合作用强度。在茶树应对高温胁迫的过程中,外源GABA是否也能起到类似的效应?其作用机制如何?这些问题尚缺乏深入的研究和探讨。为此,作者以茶树品种‘中茶108’(‘Zhongcha 108’)的1年生扦插苗为研究材料,在模拟高温条件下,研究喷施外源GABA对茶树叶片部分生理指标的影响,以期明确外源GABA对提升茶树耐高温性能的作用,为研究茶树对高温胁迫环境的耐性机制提供基础资料。
1 材料和方法
1.1 材料
供试茶树品种‘中茶108’的1年生扦插苗购自南京雅润茶业有限公司,幼苗生长状态较为一致,株高约15 cm。将幼苗种植于108孔穴盘中,每孔穴1株,种植3盘,栽培基质为V(营养土)∶V(蛭石)∶V(珍珠岩)=9∶3∶1的复合基质(pH 5.5),底部放置接水托盘。
1.2 方法
1.2.1 实验设计和处理方法 设置CK1、CK2和TG共3个组。CK1组:常温(25 ℃)对照,喷施去离子水2 L;CK2组:高温(42 ℃)对照,喷施去离子水2 L;TG组:高温(42 ℃)处理,喷施5 mmol·L-1GABA 2 L。每组32株幼苗,从幼苗叶片正上方向下一次性喷施,3组重复。喷施完成后,将幼苗置于温度25 ℃或42 ℃、光照时间16 h·d-1、光照度3 600 lx、空气相对湿度50%的人工气候光培箱中培养,分别于0、4、8、24和48 h以一叶或二叶为标准采摘鲜叶,每次随机采集约7 g鲜叶,各组混合后置于-80 ℃冰箱中保存、备用。
1.2.2 生理指标测定 将鲜叶用液氮研磨成粉,采用超高效液相色谱法[9]测定GABA含量;采用茚三酮比色法[10]测定游离脯氨酸含量,采用硫代巴比妥酸法[11]201测定丙二醛含量,采用比色法[11]72测定叶绿素含量,采用浸泡法[12]测定相对电导率,采用蒽酮法[11]113测定可溶性糖含量,采用硝基四氮唑蓝(NBT)还原法[11]210测定SOD活性,采用愈创木酚法[11]128测定POD活性,采用抗坏血酸法[11]213测定APX活性。上述指标均重复测量3次,结果取平均值。
1.3 数据处理和分析
采用EXCEL 2010软件进行数据整理,采用SPSS 22.0软件进行单因素方差分析(one-way ANOVA)。
2 结果和分析
喷施外源GABA对高温条件下茶树品种‘中茶108’叶片部分生理指标的影响见表1。由表1可以看出:喷施处理后4~48 h,在高温(42 ℃)条件下,喷施5 mmol·L-1GABA的TG组叶片的GABA含量均显著(P<0.05)高于喷施去离子水的CK2组和常温(25 ℃)下喷施去离子水的CK1组,且CK2组的叶片GABA含量在多数时间显著高于CK1组;CK2组和TG组叶片的游离脯氨酸含量显著高于CK1组,且TG组叶片的游离脯氨酸含量在喷施处理后8和48 h显著高于CK2组;CK2组和TG组叶片的SOD活性总体较CK1组不同程度下降。喷施处理后4~24 h,TG组叶片的POD活性显著高于CK2组和CK1组,而CK2组叶片的POD活性则与CK1组无显著差异。喷施处理后8~48 h,CK2组和TG组叶片的相对电导率和可溶性糖含量显著高于CK1组,且CK2组叶片这2项指标也显著高于TG组。喷施处理后24~48 h,CK2组和TG组叶片丙二醛和叶绿素含量显著低于CK1组;且在喷施处理后部分时间,TG组的叶片丙二醛含量显著低于CK2组,叶绿素含量显著高于CK2组。喷施处理后4 h,TG组叶片的APX活性显著低于CK2组;而喷施处理后24~48 h,TG组叶片的APX活性显著高于CK2组。
随处理时间的延长,CK2组和TG组叶片的GABA含量波动变化,分别在喷施处理后48和4 h达到最高;CK2组和TG组叶片的游离脯氨酸含量、相对电导率和可溶性糖含量总体升高,并在喷施处理后48 h达到最高;CK2组和TG组叶片的丙二醛和叶绿素含量以及POD活性总体下降,并在喷施处理后48 h降至最低;CK2组和TG组叶片的SOD活性波动变化,并分别在喷施处理后8和24 h降至最低;CK2组叶片的APX活性先升高后波动下降,TG组叶片的APX活性先下降后波动升高,并分别在喷施处理后4和8 h达到最高。总体上看,与CK2组比,TG组叶片的GABA、游离脯氨酸和叶绿素含量升高,抗氧化酶(SOD、POD和APX)活性增加,而丙二醛含量、相对电导率和可溶性糖含量降低。
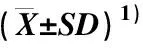
表1 喷施外源GABA后高温条件下茶树品种‘中茶108’叶片部分生理指标的影响
3 讨论和结论
上述研究结果表明:喷施处理后4~48 h,高温条件下2个组的叶片游离脯氨酸含量显著高于常温组,其中,喷施GABA后叶片的游离脯氨酸含量在喷施处理后8和48 h显著提高,而叶片丙二醛含量则有所降低,表明喷施GABA可在一定程度上提高茶树抵抗高温胁迫的能力。总体上看,随高温处理时间延长,叶片APX酶活性先升高后降低,SOD和POD酶活性波动降低,表明短期高温处理可诱导抗氧化酶活性的提高,但较长时间的高温处理可导致酶活性降低,可能与温度处理导致细胞膜受损、酶变性失活有关[12]。而喷施GABA可使处理中后期叶片SOD、POD和APX的活性提高,丙二醛含量降低,表明喷施GABA可以提高抗氧化酶的活性并减少活性氧的积累[7]28-36,[13]。
高温条件下,与未喷施GABA的幼苗相比,喷施GABA后茶树幼苗的叶片相对电导率和可溶性糖含量总体上显著降低,表明喷施GABA具有一定的抑制细胞膜变化以及维持植物体内的渗透平衡的作用[8];而其叶绿素含量的降幅减小,表明喷施GABA可降低高温胁迫对叶绿素的损害程度,缓解高温胁迫对光合作用的影响[14]。
综上所述,喷施GABA后,在高温条件下茶树品种‘中茶108’幼苗叶片中与抗逆性相关的游离脯氨酸含量升高,丙二醛含量降低,细胞膜透性的损害和叶绿素的降解程度有所减缓,表明喷施GABA可一定程度缓解高温胁迫对茶树叶片的生理伤害,增强茶树的耐热性。由于本研究对喷施GABA后茶树叶片生理指标在常温下的变化规律缺少必要的研究,加之取样量较少,导致本文部分数据误差较大。因此,后续将进一步完善实验设计,扩大研究对象的范围,在探究GABA对茶树抗逆性作用机制的基础上,明晰GABA处理后茶树不同品种抗高温性的差异。

