HE4和PKM2在子宫内膜癌组织中的表达及其与前哨淋巴结转移的相关性
赵惠杰
子宫内膜癌是一种原发于子宫内膜的上皮性恶性肿瘤,其中以子宫内膜腺体的腺癌最为常见[1]。流调学显示,子宫内膜癌约占女性全身恶性肿瘤的7%,占女性生殖道恶性肿瘤的20%~30%,绝经后的中老年女性为高发群体[2]。近些年子宫内膜癌发病率呈现逐渐升高趋势[3],但其发病机制尚不清晰,一般临床认为其与激素分泌异常、遗传因素、环境因素等相关。子宫内膜癌的治疗效果与临床期别和病理类型密切相关,有研究指出Ⅰ、Ⅱ期子宫内膜癌患者接受外科手术联合放疗干预后,5年的生存率可高达88.1%,但Ⅲ期和Ⅳ期患者接受干预后的5年生存率仅为35.65%,且复发患者往往预后较差[4-5],因而对子宫内膜癌的先期诊断及临床干预对改善其预后具有重要意义。HE4是目前临床上常用的卵巢癌肿瘤标志物,已有研究显示HE4也同子宫内膜癌、宫颈癌等恶性肿瘤密切相关[6]。PKM2是糖酵解过程中的主要限速酶之一,以往被应用于心肌梗死的诊断中,近些年的研究指出其在多种肿瘤的进展中扮演重要角色,与食管癌、肝癌等淋巴结转移及预后不良相关[7]。本研究旨在探究子宫内膜癌组织中HE4和PKM2的表达,并分析其与子宫内膜癌前哨淋巴结转移的相关性,以期为改善子宫内膜癌患者预后提供临床参考。现详述如下。
1 资料与方法
1.1 一般资料
选择2017年1月至2020年1月于我院接受治疗的60例子宫内膜癌患者为研究组,纳入标准:①入组对象均经宫腔镜刮宫病理取材确诊为子宫内膜癌,②临床资料及随访资料完整,③经医院伦理学会批准实施,④患者签署知情同意书;排除标准:①并发精神疾病患者,②并发心肝肺肾等功能异常者,③并发血液系统疾病患者,④并发免疫系统疾病患者,⑤并发急慢性感染者,⑥并发其他部位肿瘤者,⑦药物或酒精依赖者。另选同期于我院接受治疗的50例良性子宫内膜病变患者为对照组。
1.2 干预方法
所有患者入院后均按照临床常规进行对应治疗,同时经手术取病变组织进行病理学诊断以及淋巴结转移诊断,按照诊断结果实施干预,并开展常规分期手术及前哨淋巴结活检以及术后随访,对出现前哨淋巴结转移患者应进行盆腔淋巴结清扫术及腹主动脉旁淋巴结清扫术等。
1.3 观察指标及评判标准
采集研究组与对照组患者子宫内膜病变组织,处理后采用酶联免疫吸附法(ELISA)对2组患者病变组织中的HE4和PKM2表达水平进行检测,所应用试剂盒均购自罗氏公司,检测仪器均为MK3型全自动酶标仪,检测过程严格按照试剂盒说明书进行,重复3次,取平均值。首先对比研究组与对照组2组患者组织HE4和PKM2表达水平差异,而后将研究组患者按照是否出现淋巴结转移进行分组,就前哨淋巴结转移组与未转移组患者的组织HE4和PKM2水平进行组间对比。
1.4 统计学方法
使用统计学SPSS 22.0进行数据分析,对采集数据开展正态分布检验,如数据符合正态分布,计数资料以[n(%)]表示,对组间差异性分析选择卡方检验,计量资料以(均数±标准差)表示,组间的差异性分析选择t检验,相关性分析使用Spearman进行,P<0.05为差异具有统计学意义。
2 结果
2.1 2组患者一般临床资料差异性比较
2组患者一般临床资料组间差异不明显(P>0.05),具有可比性,见表1。
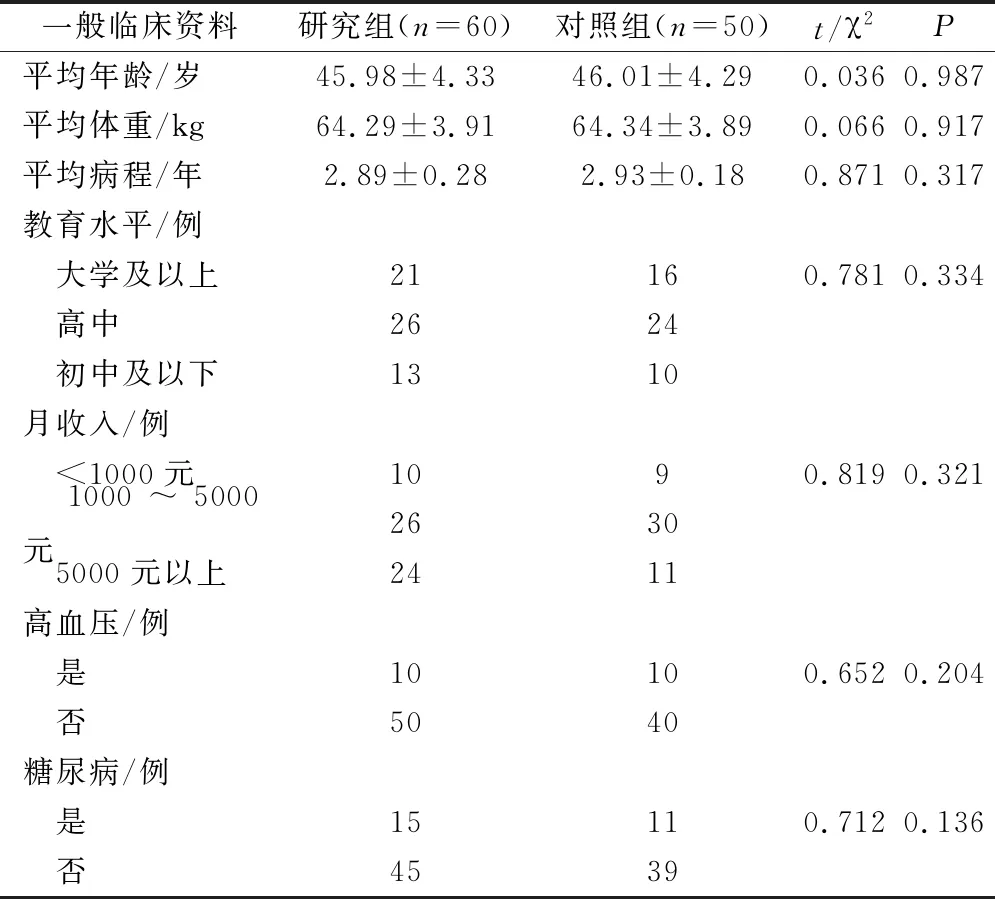
表1 2组一般临床指标比较
2.2 研究组与对照组患者组织HE4和PKM2表达水平的比较
研究组患者组织中HE4和PKM2表达水平均明显高于对照组患者(P<0.05),见表2。

表2 2组患者组织HE4和PKM2表达水平比较
2.3 子宫内膜癌前哨淋巴结转移组与未转移组患者组织HE4和PKM2表达水平比较
将研究组患者按照是否出现前哨淋巴结转移区分为转移组(19例)和未转移组(41例),对比2组患者HE4与PKM2水平,结果显示淋巴结转移组患者的组织HE4和PKM2表达水平均明显高于未出现淋巴结转移组患者(P<0.05),见表3。

表3 子宫内膜癌淋巴结转移组与未转移组患者组织HE4和PKM2表达水平差异性比较
2.4 子宫内膜癌患者组织HE4和PKM2表达水平相关性分析
就子宫内膜癌患者组织中HE4和PKM2的表达水平开展Spearman相关性分析,结果显示,子宫内膜癌组织中HE4表达水平与PKM2表达水平明显呈现正相关性(γ=0.8949,P<0.05),见图1。
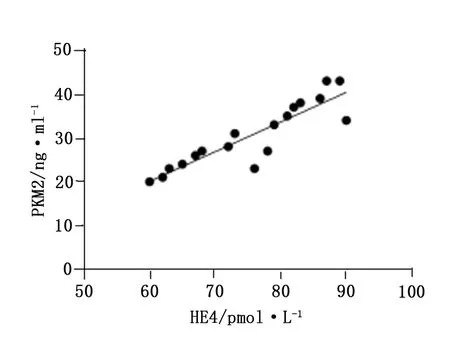
图1 子宫内膜癌患者组织HE4和PKM2表达水平相关性分析
2.5 HE4与PKM2水平对子宫内膜癌诊断价值分析
分别绘制HE4和PKM2对子宫内膜癌的诊断ROC曲线,并分别计算其AUC面积,结果显示HE4对子宫内膜癌诊断AUC为0.9464(95% CI为0.8760~1.000,P<0.0001),PKM2对子宫内膜癌诊断AUC为0.9308(95% CI为0.8525~1.000,P<0.0001),如图2所示。
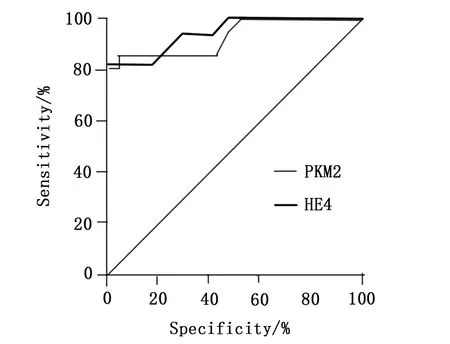
图2 HE4与PKM2水平对子宫内膜癌诊断价值分析
3 讨论
宫颈癌、子宫内膜癌、卵巢癌合称为女性生殖道三大恶性肿瘤,数据显示,美国子宫内膜癌发病率位居妇科恶性肿瘤之首,我国子宫内膜癌发病率仅次于宫颈癌。子宫内膜癌又名子宫体癌,好发于子宫体的内膜,主要表现形式为内膜腺癌,故而又被称为子宫内膜癌[8-9]。该病进展较慢,治疗难度小,且转移较慢,故而其预后相对较好,患者5年生存率一般达80%以上[10]。近些年随着我国居民生活方式及饮食结构的调整,子宫内膜癌的发病率有逐年递增趋势,尤其是青年女性,如得不到及时治疗可能会对其生育造成影响[11]。
本文作者通过设立不同分组的方式,就HE4和PKM2在子宫内膜癌组织中的表达意义,以及是否出现前哨淋巴结转移对上述因子水平的影响开展了临床研究,结果显示,相比于子宫内膜良性病变的对照组患者,子宫内膜癌的研究组患者组织中HE4和PKM2表达水平明显更高,提示恶变细胞中上述因子呈现高表达态。一项针对80例子宫内膜癌患者、50例良性子宫内膜病变患者以及50例健康个体开展的对照研究显示,子宫内膜癌患者组织中HE4水平最高,其次为良性病变患者,健康个体最低,该学者的研究与本文结果一致[12]。本文作者分析认为,HE4是一种在附睾和女性生殖道上皮组织中高表达的蛋白,目前的研究已证实HE4蛋白在卵巢癌患者中呈现异常表达状态,其对于早期卵巢癌的诊断价值甚至优于其他肿瘤标志物。PKM2已被报道同多种恶性肿瘤相关,已有研究证实PKM2高表达患者往往生存期较短且预后较差,这说明该因子同样与肿瘤进程相关[13]。
前哨淋巴结是原发肿瘤引流区域发生转移时所经的第一站淋巴结,检测它的的范围既可明确肿瘤的病变范围、转移与否,又可减少患者不必要的医疗,从而减少患者的经济负担,因此对子宫内膜癌的诊断及治疗具有重要意义。文中还就不同前哨淋巴结转移状态子宫内膜癌患者组织HE4和PKM2表达水平的差异开展了研究,结果显示,出现前哨淋巴结转移的子宫内膜癌患者组织HE4和PKM2表达水平明显高于未出现淋巴结转移的患者,且组间差异明显。有学者针对此类现象开展过调研,结果显示,出现淋巴结转移或肿瘤分期较晚的子宫内膜癌患者血清HE4和CA724浓度明显更高,该学者进一步就上述两种因子对子宫内膜癌的诊断价值开展了分析,结果显示HE4诊断敏感性、特异性和准确性均较高[14]。还有学者的研究指出,PKM2表达与淋巴结转移和临床分期均呈现明显相关(OR分别为0.43和0.33)[15]。上述研究都与本文结果类似,印证了HE4和PKM2对淋巴结转移诊断的可行性,最后文中分别就HE4和PKM2表达的相关性,以及HE4和PKM2对子宫内膜癌诊断的价值进行了分析,结果显示HE4与PKM2表达呈正相关,且HE4和PKM2对子宫内膜癌具有较好的诊断灵敏度和特异度。
综上所述,HE4和PKM2在子宫内膜癌患者组织中呈显著高表达,且二者水平与前哨淋巴结转移存在密切相关性,可以考虑将HE4和PKM2作为子宫内膜癌诊断指标推广应用于临床。

