CTHRC1与PD-L1在前列腺癌组织中的表达水平及临床意义
吴树军 苏文涛 刘建军 张军民
前列腺癌(prostate cancer,PCa)是我国男性常见的泌尿系统恶性肿瘤,近年来我国PCa发病率呈快速上升趋势,由于PCa导致的死亡患者逐年增多[1]。胶原三股螺旋重叠蛋白1(collagen triple helix repeat containing 1,CTHRC1)是1种外分泌糖蛋白[2],在多种实体肿瘤中高表达,CTHRC1基因通过调控MMP-7/MMP-9通路促进肿瘤细胞浸润和扩散[3]。而程序性死亡受体-配体(programmed cell death ligand 1,PD-L1)是重要的免疫检查点蛋白,通过与PD-1结合抑制T细胞功能促进肿瘤免疫逃逸的发生[4],PD-L1已被证实在多种肿瘤中表达增高,且常与患者预后不良相关[5]。CTHRC1、PD-L1均与恶性肿瘤的发生发展相关,但在PCa中作用尚不明确。本研究采用免疫组织化学法检测PCa患者组织中CTHRC1、PD-L1的表达情况,旨在为PCa的预后的评估提供参考价值。
1 材料与方法
1.1 研究对象
选取2013年1月至2017年1月于本院泌尿外科行根治性前列腺切除术的86例患者,患者年龄49~81岁,平均年龄(67±9.14)岁。所有患者病理学检查均确诊为前列腺癌,TNM分期组遵循美国癌症联合会(AJCC)分类;所有患者入组前均未行放、化疗,靶向药物治疗及生物免疫治疗;患者身体状况良好,无手术禁忌症。术中采集患者肿瘤组织及癌旁正常组织保存于-80 ℃备用,所有患者均签署研究的知情同意书,本研究经医院医学伦理委员会审核通过。
1.2 免疫组织化学法检测CTHRC1、PD-L1蛋白表达
将玻片脱蜡水化,使用磷酸缓冲液(PBS)冲洗后滴加3%H2O2孵育10 min,使用EDTA(pH8.0)和柠檬酸钠溶液对抗原进行高压热修复,PBS冲洗后滴加山羊血清室温下封闭30 min,滴加50 μl一抗置于湿盒内4 ℃孵育过夜。次日在室温复温1 h,PBS冲洗3次后滴加50 μl二抗,室温静置1 h。PBS洗涤后滴加DBA显色,与显微镜下观察染色程度。PBS冲洗后苏木精复染2 min,再冲洗后梯度酒精脱水、透明、中性树胶封片后于显微镜下观察。CTHRC1、PD-L1一抗均购自美国Abcam公司,HRP标记山羊抗兔二抗购买自美国SBI公司,DBA显色液及其他实际均购买自北京中杉金桥公司。CTHRC1、PD-L1染色部位均为细胞质。染色后细胞质中出现棕黄色颗粒为蛋白表达阳性,按照蛋白染色强度打分:无染色记0分、浅黄色记1分、棕黄色记2分、深棕色记3分。再按照染色高表达细胞密度进行打分:高表达细胞<25%记1分,26%~50%记2分,51%~75%记3分,>75%记4分。参照文献报道[6-7]最终结果以上述两项评分相乘获得,以≤6分记为低表达,>6分为高表达。
1.3 治疗及随访
患者行根治性前列腺切除术后采用多西他赛联合泼尼松龙方案进行化疗,化疗期间患者每3个月复查血清PSA水平、CT、MRI及骨扫描,以出现肿瘤进一步生长、骨转移、患者临床症状进一步加重、患者死亡判定为化疗无效,无上述指征者判定为化疗有效。采用电话、微信、邮箱等方式对患者进行随访,随访间隔为3个月,随访时间3年,末次随访时间为2020年1月。
1.4 统计分析
收集的实验数据应用SPSS 21.0进行分析,计数资料以例数或率表示,两组比较采用χ2检验,相关性分析采用Spearman分析,采用Kaplan-Meier生存曲线观察两组患者生存情况进行比较,以P<0.05为差异具有统计学意义。
2 结果
2.1 CTHRC1、PD-L1在肿瘤及癌旁组织中表达情况
免疫组化染色结果显示:86例PCa组织中65例患者CTHRC1呈高表达,高表达率为75.58%;69例患者PD-L1呈高表达,高表达率为80.23%。肿瘤组织中CTHRC1、PD-L1表达水平明显高于癌旁组织,差异具有统计学意义(P<0.001),见表1。
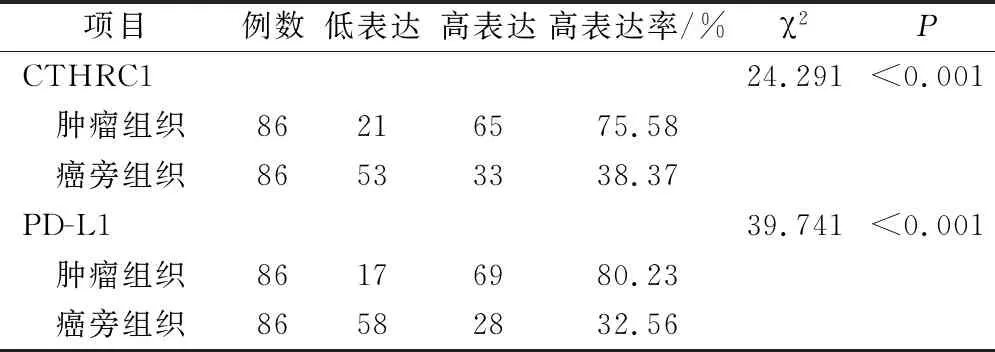
表1 免疫组化法检测CTHRC1、PD-L1表达情况/例
2.2 CTHRC1、PD-L1表达水平与患者临床资料的关系
研究表明:PCa患者组织中CTHRC1、PD-L1表达水平与患者年龄及术前前列腺特异性抗原(Prostate specific antigen,PSA)水平无关(P>0.05),而与患者TNM分期、是否伴随骨转移及Gleason评分相关(P<0.05),见表2。
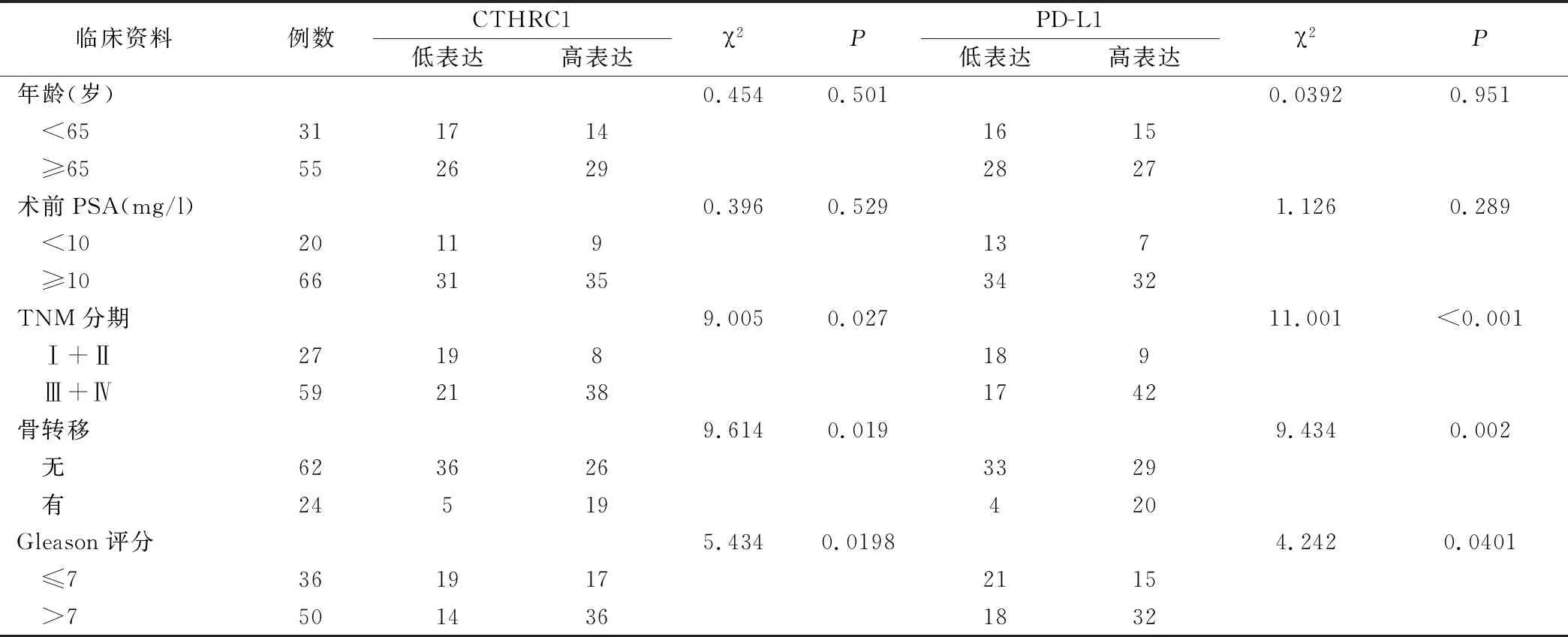
表2 CTHRC1、PD-L1表达水平与患者临床资料的关系/例
2.3 CTHRC1、PD-L1表达水平的相关性研究
86例PSa患者肿瘤组织中CTHRC1高表达65例,而PD-L1高表达69例,Spearman相关性分析显示:PD-L1表达与CTHRC1表达呈正相关(γ=0.377,P<0.01)。
2.4 CTHRC1、PD-L1表达与患者化疗效果的关系
86例PCa患者中化疗有效71例,无效15例。化疗有效患者肿瘤组织中CTHRC1、PD-L1表达明显低于无效患者,差异有统计学意义(P<0.001),见表3。

表3 CTHRC1、PD-L1表达与患者化疗效果的关系/例
2.5 CTHRC1、PD-L1表达水平对患者预后的影响
以随访患者死亡或到截止时间为标准停止随访,86例PCa患者肿瘤组织中CTHRC1高表达患者65例,死亡24例,存活38例,失访3例;CTHRC1低表达患者21例,死亡3例,存活18例,无失访。86例PCa患者肿瘤组织中PD-L1高表达患者69例,死亡26例,存活41例,失访2例;PD-L1低表达患者17例,死亡2例,存活14例,失访1例,所有死亡患者死因均为前列腺癌进展或并发症。采用Kaplan-Meier生存曲线比较患者生存情况,结果发现肿瘤组织中CTHRC1、PD-L1呈低表达的患者36个月的生存率高于高表达患者,差异具有统计学意义(P<0.05),见图1。
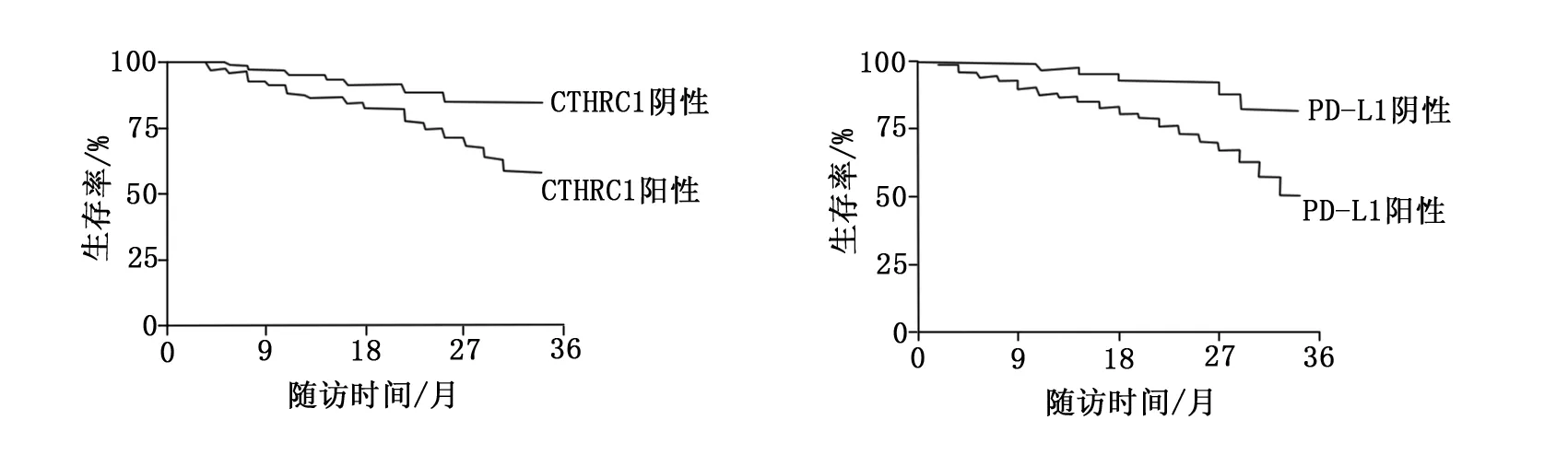
图1 CTHRC1、PD-L1表达水平与患者生存率的关系
3 讨论
研究表明CTHRC1是1种迁移蛋白,其表达与血管重构、组织纤维化的形成、骨骼形成和肿瘤形成等多种生命活动相关[8],而CTHRC1在肿瘤中常出现表达水平升高。大量文献报道其与多种肿瘤的生长侵袭相关,如良性黑色素瘤细胞不表达CTHRC1,但在具有高度侵袭和转移能力的恶性黑色素瘤细胞中CTHRC1表达水平明显升高[9];在非小细胞肺癌中CTHRC1表达水平可作为评估患者预后的相关指标,高表达患者常伴随预后不良的发生[10];此外还有研究表明CTHRC1表达水平与肿瘤耐药的发生密切相关[11],其可能作为相应的分子靶点在肿瘤的靶向治疗中发挥作用。但目前CTHRC1与PCa的相关研究少有报道,本研究结果表明其在PCa组织中呈高表达,且化疗有效的患者组织中CTHRC1表达水平较低,高表达CTHRC1的患者生存率低于低表达患者。国内郭碧莹等[12]的研究发现,体外过表达CTHRC1显著增强卵巢癌细胞增殖和迁移的能力,而下调CTHRC1的表达后卵巢癌细胞浸润能力大大降低,研究证实CTHRC1在恶性肿瘤发生发展过程中发挥促肿瘤作用。郭碧莹等[13]的研究还发现高表达CTHRC1的卵巢癌细胞对化疗药物的敏感性较低,而沉默CTHRC1后发现抑制细胞中Akt、STAT3磷酸化,使Bcl-2表达降低,提升化疗效果。结合本研究结果,提示CTHRC1可能参与了PCa的发生发展及化疗耐药的发生。
PD-L1是免疫反应中重要的负性调控分子,与PD-1结合后募集蛋白酪氨酸磷酸酶(SHP)下调PI3K/Akt通路磷酸化水平,使CD4+T淋巴细胞向Treg分化[14],抑制免疫反应的发生。PD-1/PD-L1还可通过耗竭CD8+T细胞的方式抑制抗肿瘤免疫反应,促进肿瘤的免疫逃逸[15]。研究表明PD-L1在多种肿瘤中的表达水平明显升高,而其表达水平可作为患者预后的相关指标,胃癌组织中PD-L1高表达常与患者预后不良相关[16];PD-L1还能通过促进肝癌微血管生成促进肿瘤的生长转移[17]。本研究发现PD-L1在PCa组织中表达水平明显上升,且与患者化疗效果和生存率相关,与低表达者相比PD-L1高表达的PCa患者多数化疗无效,且生存率明显降低,结果与先前的研究一致。本研究还发现PD-L1的表达与CTHRC1表达相关。相关研究报道CTHRC1与金属基质蛋白酶-9、粘蛋白-1等分子表达水平相关,可能参与了肿瘤微环境的调控导致PD-L1表达水平增高从而进一步促进肿瘤的发生发展[18],但对此机制的研究尚不完全明确。
综上所述,本研究结果显示PCa患者肿瘤组织中PD-L1、CTHRC1表达水平明显升高,且与患者TNM分期、有无骨转移、Gleason评分、化疗效果及预后相关,提示PD-L1、CTHRC1参与了PCa的发生发展,可能作为PCa患者化疗效果及预后的评价指标发挥作用。但本研究样本量较小,结果可能存在偏倚,需在后续研究中心加以改进,且PD-L1、CTHRC1在PCa中发挥的作用及机制仍需进一步研究。

