高脂饮食对氯吡格雷药代动力学影响的meta分析
王纯叶,黄睿超,盛小燕,王婷,党桂宁,张国超*,黎赛*(. 惠州市第一妇幼保健院,广东 惠州56007;. 南方医科大学中西医结合医院,广州 505;. 鹤山市中医院,广东 江门 59700)
氯吡格雷为临床上用于急性冠脉综合征(acute coronary syndrome,ACS)和冠脉介入治疗(percutaneous coronary intervention,PCI)术后的双联抗血小板药物之一。由于其能显著降低患者的主要心血管不良事件(major adverse cardiovsscular events,MACE),2013年美国心脏病协会以及2017年冠心病二级预防中国指南将其作为ⅠA类推荐[1-2]。作为一种噻吩并吡啶类前体药物,氯吡格雷经口服肠道吸收后(大约50%),85%经羧酸酯酶转化为无活性羧酸代谢产物SR26334,剩余的15%主要在肝脏CYP450酶系统的CYP2C19参与下,经两步代谢最终生成具有活性的硫醇衍生物,与血小板ADP受体结合发挥抗血小板效应[3-4](见图1)。由于存在CYP2C19基因多态性[5]、药物相互作用[6]、特殊人群[7]等因素,氯吡格雷的药代动力学和药效学存在个体差异。上述影响因素中,饮食的影响往往容易被忽视。有研究显示,饮食对药物的吸收和代谢过程可产生明显改变[8]。但饮食是否对氯吡格雷的药代动力学行为产生影响,尚不明确。本研究通过meta分析方法,评价饮食对氯吡格雷药代动力学的影响,以期为临床合理用药提供参考依据。
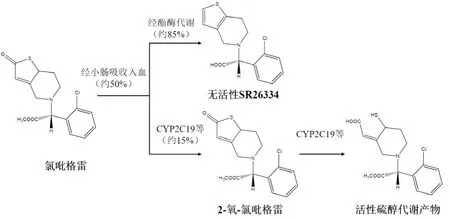
图1 氯吡格雷体内代谢活化过程Fig 1 Biotransformation of clopidogrel in vivo
1 资料与方法
1.1 资料来源
系统检索中国知网、万方、中国生物医学文献服务系统、维普期刊数据库、PubMed、Clinical trials、Cochrane、Web of Science和Embase数据库。中文检索词:氯吡格雷、药代动力学/药动学和空腹;英文检索词:Clopidogrel、Pharmacokinetics和Fasting,采用主题词与自由词相结合的方式检索,检索时间建库至2021年8月6日。
1.2 纳排标准
文献纳入标准:①生物等效性试验或Ⅰ期临床研究,资料完整,语种限于中英文;②服用氯吡格雷的健康受试者,年龄、性别、国籍不限;③服药方式分为空腹和餐后组,两组均经过血药浓度检测和分析;④结局指标:不同服药方式的药代动力学参数,包括血药浓度-时间曲线下面积(AUC0~t)、峰浓度(Cmax)和半衰期(t1/2)等;⑤参考《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》中高脂饮食的标准:高脂高热饮食的热量约800~1000 kcal,其中脂肪约提供不少于食物中50%的热量。
文献排除标准:①综述型文献、病例报道、基础研究及重复性研究;②资料不清晰或出现错误导致不能提取所需数据资料的文献。
1.3 资料提取
由两名评价者独立完成文献筛选并提取以下信息:①第一作者、发表年份、研究地区、纳入分析的患者人数、性别、年龄、体质量、药物剂量;②空腹和餐后氯吡格雷及其代谢产物的Cmax、AUC0~t、t1/2指标。如果分别提供了中位数、最小值、最大值,而没有提供均数和标准差,则用Chowbay等[9]所述方法估算均数和标准差。如文献提供的是标准误(SE),则在RevMan中换成标准差。
1.4 统计学分析
用RevMan 5.3软件进行分析,各研究间的异质性采用χ2检验,若无统计学异质性(P>0.1和I2<50%)采用固定效应模型进行分析;若存在统计学异质性(P<0.1,I2≥50%)时,采用随机效应模型并进行敏感性分析或亚组分析。采用漏斗图评估发表偏倚。计量资料以标准化均数差(SMD)及其95%置信区间(CI)表示。
2 结果
2.1 文献基本情况
通过检索数据库共获得相关文献47篇,按图2筛选后,最终纳入8篇文献[10-17],总计948名健康志愿者。4篇文献研究地区为中国,其余为国外人群。除Hurbin[10]和Nirogi[13]的研究外,其余均为仿制药与原研药的生物等效性研究。文献基本资料见表1,筛选流程图见图2。
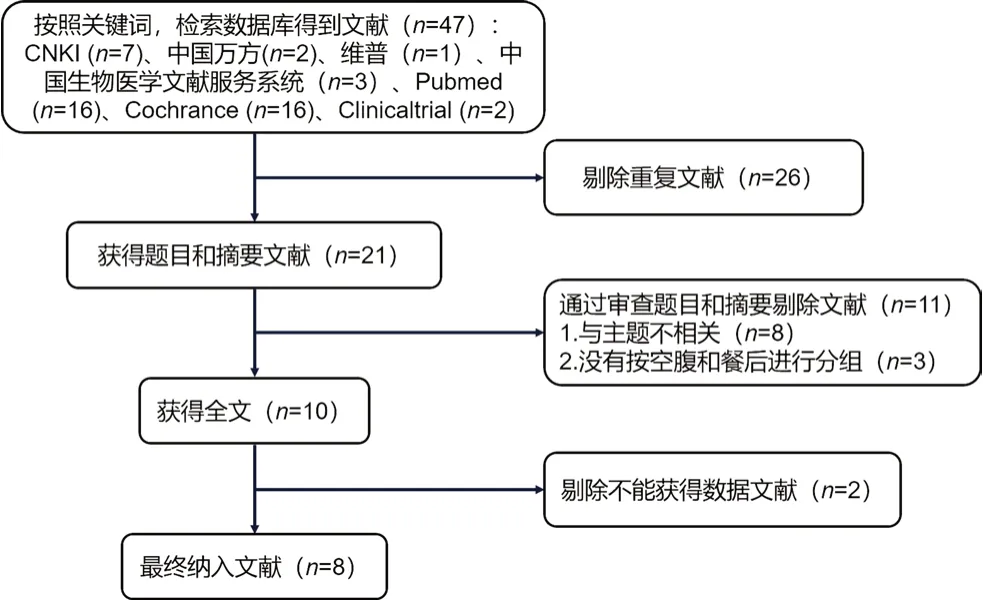
图2 文献筛选流程图Fig 2 Flow chart of literature screening
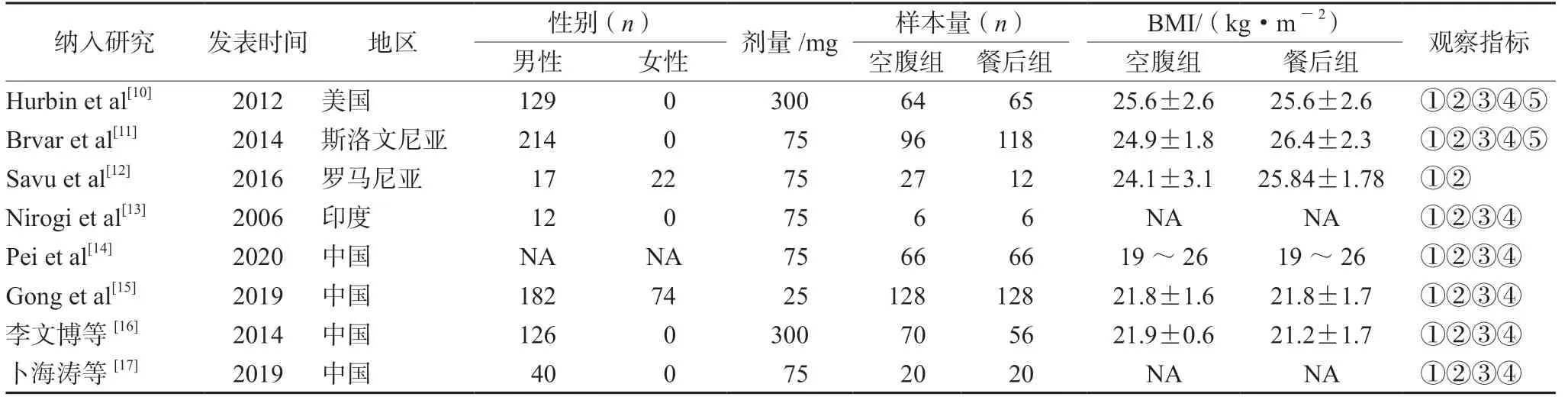
表1 纳入研究基本信息Tab 1 General information of included studies
2.2 Meta分析结果
2.2.1 高脂饮食对氯吡格雷Cmax的影响 纳入本研究的8篇文献[10-17]均报道了高脂饮食对氯吡格雷的Cmax水平的影响,各研究之间异质性较大(P<0.1,I2>50%),用随机效应模型进行分析。按照给药剂量进行亚组分析:①300 mg剂量共纳入2篇文献,总人数255人,结果显示,空腹给药时氯吡格雷的达峰浓度要显著低于餐后给药(SMD:2.04,95%CI:1.46~2.61,P<0.000 01);②75 mg剂量共纳入5篇文献,共427人,结果显示,空腹给药时氯吡格雷的达峰浓度要显著低于餐后给药(SMD:2.39,95%CI:1.58~3.20,P<0.000 01);③25 mg剂量共纳入1篇文献,共256人,结果空腹给药时氯吡格雷的达峰浓度要显著低于餐后给药(SMD:1.91,95%CI:1.61~2.20,P<0.000 01),见图3。
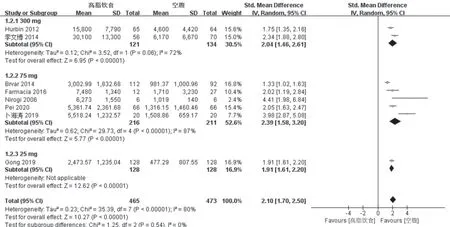
图3 高脂饮食对氯吡格雷Cmax的影响的meta分析森林图Fig 3 Forest plots of effect of high-fat diet on Cmax of clopidogrel
2.2.2 高脂饮食对氯吡格雷AUC0~t的影响 纳入本研究的8篇文献[10-17]均报道了高脂饮食对氯吡格雷的AUC0~t水平的影响,各研究之间异质性较大(P<0.1,I2>50%),用随机效应模型进行分析。同“2.2.1”项下按照给药剂量进行亚组分析:①300 mg剂量结果显示,空腹给药时氯吡格雷的体内暴露强度要显著低于餐后给药(SMD:2.92,95%CI:1.79~4.05,P<0.000 01);②75 mg剂量结果显示,空腹给药时氯吡格雷的暴露强度要显著低于餐后给药(SMD:2.35,95%CI:1.67~3.02,P<0.000 01);③25 mg剂量结果与上述两个结果一致,空腹给药时氯吡格雷的暴露强度要显著低于餐后给药(SMD:3.02,95%CI:2.66~3.38,P<0.000 01),见图4。
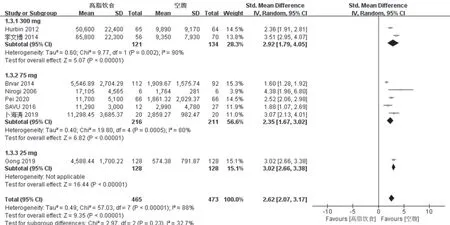
图4 高脂饮食对氯吡格雷AUC0~t的影响meta分析森林图Fig 4 Forest plots of effect of high-fat diet on clopidogrel AUC0~t
2.2.3 高脂饮食对氯吡格雷t1/2的影响 共有7篇文献[10-11,13-17]报道了高脂饮食对氯吡格雷半衰期的影响,共899人,各研究之间异质性较大(P<0.1,I2>50%),用随机效应模型进行分析。结果显示高脂饮食对氯吡格雷的半衰期无影响(SMD:-0.08,95%CI:-0.61~0.44,P=0.76),见图5。

图5 高脂饮食对氯吡格雷t1/2的影响的meta分析森林图Fig 5 Forest plots of effect of high-fat diet on t1/2 of clopidogrel
2.2.4 高脂饮食对氯吡格雷代谢产物SR26334药动学的影响 共有2篇文献[10-11]报道了高脂饮食对SR26334Cmax和AUC0~t的影响。结果显示,高脂饮食能显著减少SR26334在体内的峰浓度(SMD:-0.75,95%CI:-1.16~-0.33,P=0.0004),说明空腹状态能促进氯吡格雷向SR26334的转化。结果显示高脂饮食虽然能减少SR26334在体内的暴露强度,但与空腹相比AUC0~t无显著差异(SMD:-0.20,95%CI:-0.41~0.02,P=0.07),见图6。
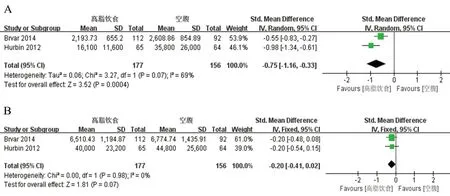
图6 高脂饮食对氯吡格雷代谢产物SR26334药动学参数Cmax(A)和AUC0~t(B)meta分析森林图Fig 6 Forest plots of effect of high-fat diet on Cmax(A)和AUC0~t(B)metabolite of SR26334
2.3 发表偏倚和异质性分析
本研究的发表偏倚主要由漏斗图进行分析评估。高脂饮食对氯吡格雷Cmax、t1/2以及AUC0~t影响结果显示,点基本均匀分布中线或合并SMD值两侧,提示偏倚控制较好,发表偏倚对此次meta影响较小,结论较为准确(见图7)。本次分析的异质性检验显示Cmax、AUC0~t和t1/2的异质性较大,但通过亚组分析和逐个剔除纳入文献分析,显示合并结果未发生明显变化,说明分析结果较稳定。由于高脂饮食对氯吡格雷代谢产物SR26334药动学参数影响纳入文献较少(2篇),故不应用漏斗图进行发布偏倚评估。
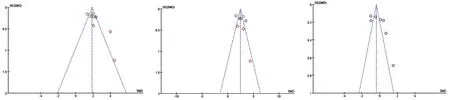
图7 高脂饮食对氯吡格雷药动学Cmax(A),AUC0~t(B)和半衰期(C)影响的漏斗图Fig 7 Invert funnel plot of high-fat diet on Cmax(A),AUC0~t(B)and half-time(C)of clopidogrel
3 讨论
药物进入人体后,发挥药效作用前,要经过机体对药物的吸收、分布、代谢和排泄处置过程。各种内外因素通过影响这四个过程来调节药物在体内的血药浓度,进而影响该药的药理作用强度和程度。目前药物相互作用、疾病状态、基因多态性等是临床上关注较多的影响因素,而饮食对药物药代动力学的影响却往往被人们所忽视[18-19]。氯吡格雷为常用的口服抗血小板药物,其作用受诸多因素的影响,容易造成血小板反应多样性,进而出现氯吡格雷抵抗,发生血栓事件[20]。在众多影响因素中,CYP2C19基因多态性以及竞争该酶的药物相互作用研究成为目前研究氯吡格雷个体化用药的热点,而饮食是否对其吸收、代谢甚至抗血小板活性产生影响,关注甚少[21]。因此,本文通过meta分析方法,评价饮食对氯吡格雷药代动力学的影响,并分析其原因,旨在引起大家关注饮食对药物造成的影响,为其临床合理用药提供参考。
研究结果显示,餐后口服氯吡格雷后,其达峰时间明显延长(tmax从空腹组的0.58~1.0 h延长至餐后组的1.5~3.0 h),Cmax显著增加,体内的暴露水平明显提高,t1/2有所延长。由于食物的影响,氯吡格雷转化为SR26334的过程也受到抑制,导致SR26334在体内的暴露强度和水平存在不同程度的下降。上述结果提示,氯吡格雷在食物的影响下生物利用度增加,酯酶代谢途径受到抑制,无活性产物的暴露水平下降。推测氯吡格雷经CYP2C19代谢途径可能被激活,其转化为活性成分硫醇代谢物水平有望升高,其抗血小板活性可能也会相应的提高。
口服给药方式最容易被食物从吸收和代谢两个环节影响药物的体内药代动力学过程[22]。首先,食物通过改变改变胃肠道的pH值、排空速率,促进胆汁分泌来影响药物的吸收。其次,当药物进入体内后,食物中的脂肪、维生素等成分能够调节药物代谢酶的活性进一步影响药物在体内的暴露水平。在本研究中,氯吡格雷和代谢产物SR26334的体内药代动力学过程受饮食改变明显,可能的原因包括:①氯吡格雷主要在小肠吸收,食物可能导致胃排空速率减慢,致使药物连续不间断达到小肠吸收部位,避免达到过饱和状态,药物吸收总量可能增加;②氯吡格雷为脂溶性药物,高脂高热食物会刺激胆汁流量,增加血流量和淋巴液的循环,胆汁中胆酸盐可增加亲脂药物的溶解度,促进药物吸收[23],增加药物的生物利用度;③高脂高热饮食导致吸收入血的胆固醇酯、三酰甘油等物质增加,该类物质可能会竞争性抑制代谢氯吡格雷为SR26334的羧酸酯酶活性[24],从而导致SR26334在体内的暴露强度下降。
本meta分析存在的局限性:首先,纳入研究有4篇文献来自中国,其他地区的文献相对较少,且样本量相对有限,得出的结论可能存在一定局限性;其次,纳入的研究都只关注了氯吡格雷原形药物以及无活性产物SR26334在空腹和进食后的药代动力学状态,而实际发挥抗血小板作用的硫醇代谢物的药代动力学变化并未检测,而且纳入的研究只探讨饮食对药代动力学的影响,未进一步报道长期的高脂饮食与氯吡格雷抗血小板作用以及心血管事件之间的关系。此外,数据没有按年龄、性别等其他可疑因素分层,因此还需要更多的数据进行更精确的分析。

