伴矿景天和鹅掌柴间作系统中根系相互作用对植物生长和镉锌吸收的影响①
孙 曦,李 柱,彭洪柳,赵 婕,朱仁凤,吴龙华*
伴矿景天和鹅掌柴间作系统中根系相互作用对植物生长和镉锌吸收的影响①
孙 曦1, 2,李 柱1,彭洪柳1,赵 婕3,朱仁凤3,吴龙华1*
(1 中国科学院土壤环境与污染修复重点实验室(南京土壤研究所),南京 210008;2 中国科学院大学,北京 100049;3 江苏萤火虫环境科技有限公司,南京 210008)
为明确不同物种根系间的相互作用对植物生长和重金属元素吸收的影响,以Cd、Zn超积累植物伴矿景天与花卉植物鹅掌柴为材料,研究二者根系相互作用及对植物生长和Cd、Zn的影响。结果发现,二者根系具有相互抑制生长的作用。单作条件下伴矿景天的Cd、Zn吸收量最高,分别达0.812、19.6 mg/盆;较单作相比,无分隔间作条件下伴矿景天对土壤Cd、Zn吸收降低分别达30.0% 和30.6%。两种植物根系改变了土壤养分性质,对土壤钾和磷的利用分别具有竞争和互补作用,但其有效态含量并未降低到亏缺水平,养分竞争可能不是两种植物根系相互作用的主要因素。水培试验表明鹅掌柴根系分泌物对伴矿景天的生长和Cd吸收具有抑制作用。
植物吸取修复;间作;伴矿景天;根系相互作用;鹅掌柴
在重金属污染土壤的超积累植物吸取修复中,超积累植物与其他植物进行间套作种植是其常见的实施方式。然而,单一种植超积累植物时修复期间土地常无法产生有效的经济产出。理想的超积累植物与作物间作系统可以提高资源利用率以及修复效率,同时降低作物的重金属吸收量,甚至可以在受污染的农田中产出符合食品安全标准的作物[1]。相邻植物间的相互作用,即邻近作用。一些研究发现了间作植物对超积累植物的理想邻近作用,其表现为:高秆间作植物可为喜阴超积累植物遮阴,缓解强光及高温对超积累植物生长的抑制[2];间作豆科植物根系的有机酸分泌可提高土壤重金属的生物有效性,提高超积累植物对重金属的吸收量[3];间作植物的残体及根际微生物作用可提高超积累植物养分利用率[4];间作植物根系穿透力较强,其改善了土壤孔隙度,促进穿透力较弱的超积累植物根系向更深层次土壤的分布[4]。
伴矿景天()是一种Cd、Zn超积累植物,目前已被成规模地应用在Cd污染土壤的植物修复中,其间套作的修复模式也有部分研究报道,在多个报道中[1, 5]伴矿景天间作时修复效率并未显著下降。鹅掌柴()是一种原产于华南地区的灌木,在道路绿化、边坡护理、药用天然产物提取等领域应用广泛,具有一定经济价值。本课题组前期于广东省仁化县某铅锌冶炼企业周边污染农田进行的9种园林植物替代种植田间试验中发现,鹅掌柴生长良好,且具有一定的Cd积累能力,在土壤Cd浓度为1.74 mg/kg时鹅掌柴地上部Cd富集系数达3.21[6]。伴矿景天根系分布较浅,穿透力较弱,间作植物鹅掌柴可通过更强的根系穿透力改善土壤结构使超积累植物根系分布加深[4],从而提高其修复效率;而间作植物也可能与超积累植物竞争资源,从而对彼此的生长造成不良影响。目前,超积累植物与间作植物的根系相互作用对二者根系分布、养分利用、根系分泌物相互作用的研究还较少,这方面的研究可以为提高间作系统的修复效率和经济产出提供理论基础。
为此设计了根系不同分隔的间作装置,开展超积累植物伴矿景天和鹅掌柴的间作试验,包括伴矿景天和鹅掌柴分为单作、地上部接触、地上部及土壤溶液交流及完全接触处理,以研究不同程度邻近作用下伴矿景天和鹅掌柴的根系趋避性、生长及Cd吸收状况;初步验证鹅掌柴根系分泌物对伴矿景天生长及Cd吸收的影响,研究结果可为超积累植物间作模式应用和研究提供依据和参考。
1 材料与方法
1.1 供试土壤和植物
供试土壤和伴矿景天扦插苗采自广东省仁化县董塘镇某土壤污染修复项目地,该地受到铅锌矿冶炼污染而弃耕,土壤类型是潜育水耕人为土。取0 ~ 15 cm表层土壤,风干、过10目筛,备用。土壤基本性质如下:pH 7.15(H2O,1: 2.5,/),有机质43.2 g/kg,无机氮22.2 mg/kg(其中铵态氮7.36 mg/kg,硝态氮14.9 mg/kg),有效磷23.3 mg/kg,交换性钾75.6 mg/kg,全Cd 4.04 mg/kg,全Zn 1 171 mg/kg,全Pb 528 mg/kg。鹅掌柴苗木购于江苏宿迁春之宜商贸有限公司,株高约15 cm,具有主根长度10 cm左右根系。伴矿景天种植时选取顶部枝条进行扦插,扦插苗长度约5 cm。
1.2 伴矿景天与鹅掌柴间作盆栽试验
1.2.1 盆栽试验设计和处理设置 试验用盆钵为立方体形,尺寸为24 cm×10 cm×10 cm,每盆可盛3 kg土壤,试验装置模仿自Selvam 和 Wong[7]及Semchenko等[8]的研究。设置5种具有不同邻近作用的种植处理(图1):A.伴矿景天单作(SpM);B.鹅掌柴单作(SaM);C.塑料板分隔间作(冠层作用)(COP);D.300目尼龙网分隔间作(土壤溶液作用)(COM);E.无分隔间作(完全作用)(CO);5个处理中植物间的邻近作用依次增强。每处理设5次重复,随机排列。每盆钵种植伴矿景天4株或鹅掌柴1株(移栽苗)。盆栽试验于中国科学院南京土壤研究所玻璃温室进行,于2019年4月27日进行植物扦插和移栽,2019年7月27日进行收获,期间每2天进行浇水保持土壤含水量在土壤最大田间持水量的60% ~ 70%,人工去除杂草,每周打乱盆栽摆放顺序和方向。试验期间无肥料施用。
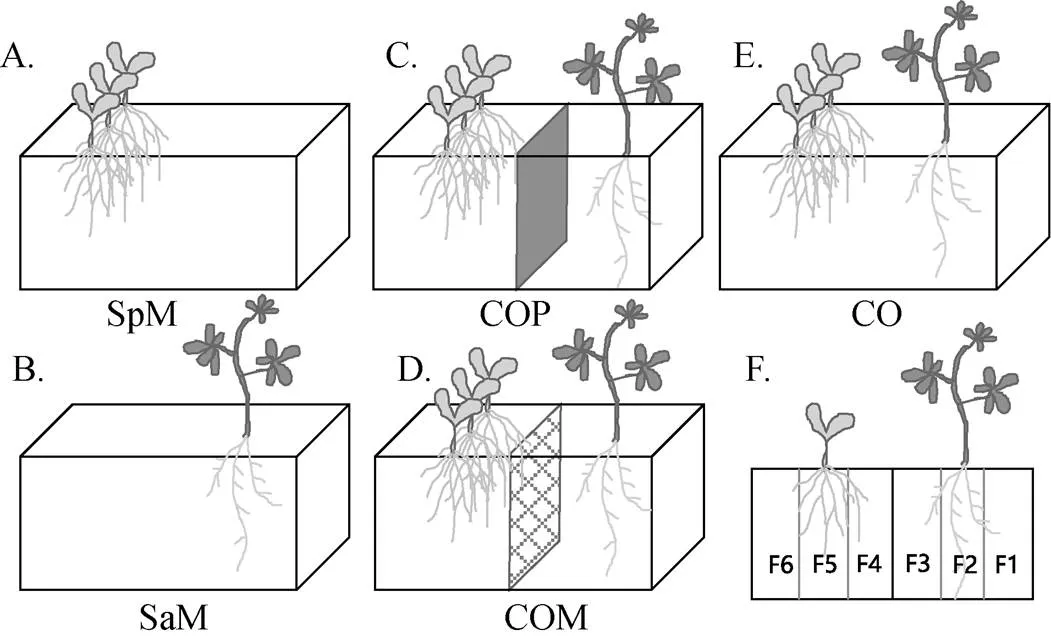
(A.伴矿景天单作;B.鹅掌柴单作;C.塑料板分隔间作;D.300 目尼龙网分隔间作;E.无分隔间作;F.分隔部分取样)
1.2.2 植物生长和植物性质测定 种植90 d后结束盆栽试验,收获地上部,以氧化锆陶瓷刀按盆钵长轴方向将其内土壤等分为6个分块(图1,F1 ~ F6),并分别用挖掘筛分法取出每个盆钵中6个部分土壤中的根系。两种植物根系外观显著不同,伴矿景天为须根系,直径常小于0.5 mm;鹅掌柴为直根系,根白色,直径约1 mm,可就此对二者加以区分,分别洗净测定根系构型(WinRHIZO Pro, version 2013b, Regent Instruments Inc., Canada)及鲜物质量,烘干后测定干物质量,比根长度按根系长度除以根干物质量计算,分析6个不同区域中根系的分布,以研究植物根系的趋避性[7]。测定地上部鲜物质量、株高、叶面积(数码相机拍照后利用Image J软件分析图片),洗净后80 ℃烘干至恒重,测定干物质量。H2O2-HNO3消解–火焰原子吸收法(SpectrAA 220FS, Varian)测定植物地上部Cd、Zn含量。
1.2.3 土壤性质测定 如图1,每盆栽土壤分为6个区域,分别测定土壤含水率,将鲜土保存于–20 ℃冰箱中备测。土壤pH采用0.01 mol/L CaCl2浸提(1:10,/),pH计测定;提取态Cd、Zn及K采用1 mol/L NH4OAc浸提(1:10,/),火焰原子吸收法测定;Olsen磷采用磷钼蓝比色法测定;以1 mol/L K2SO4(1:10,/)浸提土壤,浸提液分别用于测定可溶性有机碳(DOC)(焦磷酸锰(III)氧化法)[9]、铵态氮(靛酚蓝比色法)及硝态氮(紫外分光光度法)。上述养分及重金属的含量按称量的鲜土质量与含水率换算为烘干基土壤中的含量。
1.3 水培条件下鹅掌柴根系分泌物对伴矿景天生长和镉吸收的影响
试验2为两因素完全随机设计。因素1为营养液添加0 μmol/L和5 μmol/L Cd,因素2为含鹅掌柴根系分泌物营养液培养和空白营养液培养,共4处理,4次重复。0.8 L盆钵水培伴矿景天,每盆钵4株。培养期间所用营养液为1/2浓度Hoagland营养液,期间连续曝气,每天置换营养液。
取伴矿景天顶端枝条,以空白营养液预培养14 d后开始添加处理,处理时间为21 d。鹅掌柴根系分泌物以如下方法收集:挑选生长均匀的鹅掌柴,以相同0.8 L盆钵培养,每盆2株;每天日照开始2 h后将2株鹅掌柴取出,放入100 ml营养液中收集根系分泌物,收集1 h后将含有分泌物的100 ml营养液按处理在置换伴矿景天营养液时加入到盆钵中,以空白营养液补至0.8 L。之后再按处理在盆钵中加入1 ml含有或者不含有4 mmol/L Cd(NO3)2的营养液,使Cd处理所用营养液的Cd浓度为5 μmol/L。收获时测定地上部和根的鲜物质量,洗涤烘干后测定干物质量和伴矿景天Cd含量。培养试验在人工光照室进行,培养条件为 12 h/12 h昼夜循环,26 ℃/20 ℃昼夜温度设置,荧光灯提供300 μmol/(m2·s)强度的光照,空气相对湿度控制于60%。
1.4 数据处理和统计
对于处理的重复数据表示为均值±标准误,统计检验在R(Version 3.6.1)中进行,多组数据间的比较首先采用方差分析(ANOVA),如显著采用Duncan法进行多重比较。对于试验1,采用线性混合模型(linear mixed models,LMMs)分析根系参数对土壤性质间的作用关系。本试验为盆栽试验,试验用土经过筛并混匀后使用,因此考虑土壤性质的变异是两种植物根系作用引起的。单个性质作为模型因变量,单个根系参数作为固定效应,同一处理的不同盆及同一盆中的不同部分作为随机效应,以在统计上考虑同一盆不同部分土壤间的非独立性的影响。分别进行单物种根系单独作用(单作处理和塑料板分隔间作处理)及两物种根系共同作用(无分隔间作处理)时土壤性质与根系参数的线性混合模型分析。利用R中nlme程序包[10]的lme函数进行线性混合模型分析。上述统计检验的显著性水平为0.05。
2 结果与分析
2.1 间作条件下伴矿景天和鹅掌柴的生长和Cd、Zn吸收
表1显示了收获时两种植物地上部和根系的生物量及形态参数。间作较单作而言,伴矿景天地上部和根系的生长均受到鹅掌柴的抑制,表现在伴矿景天地上部鲜物质量、叶面积、根系鲜物质量及根系长度指标随间作邻近作用的逐渐增强而逐渐降低,上述指标在伴矿景天单作(SpM)及无分隔间作(CO)间差异达显著,然而CO与SpM处理的地上部干物质量差异仅达边际显著(= 0.071,LSD检验)。鹅掌柴地上部特征在处理间均无显著差异,其根系干物质量及根系长度在隔离间作的处理中较单作和无分隔间作低(表1)。
伴矿景天地上部形态特征受到鹅掌柴的影响,在COP、COM处理根系分隔间作时,其株高分别较单作(SpM)显著增加14.0%、12.0%,表现茎伸长的避阴反应。伴矿景天和鹅掌柴的比根系长度处理间亦有差异,但与根鲜物质量随邻近作用的增强逐渐降低不同,伴矿景天的比根长度在塑料板分隔间作处理(COP)中最低,而在无分隔间作处理(CO)最高(表1)。
在不同的土壤分块中,鹅掌柴根系与伴矿景天根系共存时(CO处理)伴矿景天根系生物量较伴矿景天单作(SpM)时显著下降,比根长度增加(图2中F2~ F5),鹅掌柴根系显著抑制了伴矿景天根系生长。同样地,鹅掌柴根系也受到伴矿景天根系的抑制(图2A),这体现了两种植物根系对彼此生长的抑制作用。离间作植物较远的土壤分块F1(对鹅掌柴)、F6(对伴矿景天)其根系参数在分别的单作(SpM、SaM)和间作(CO)间并未呈现显著差异,而总根系减少,根系的共存并未促进这两种植物根系向远离邻近植物的区域躲避生长。鹅掌柴在两种分隔间作处理(COP、COM)中F1分块根生物量高于单作(SaM)和不分隔间作(CO),可能是由于分隔后土壤体积减小,限制根系生长方向引起的。
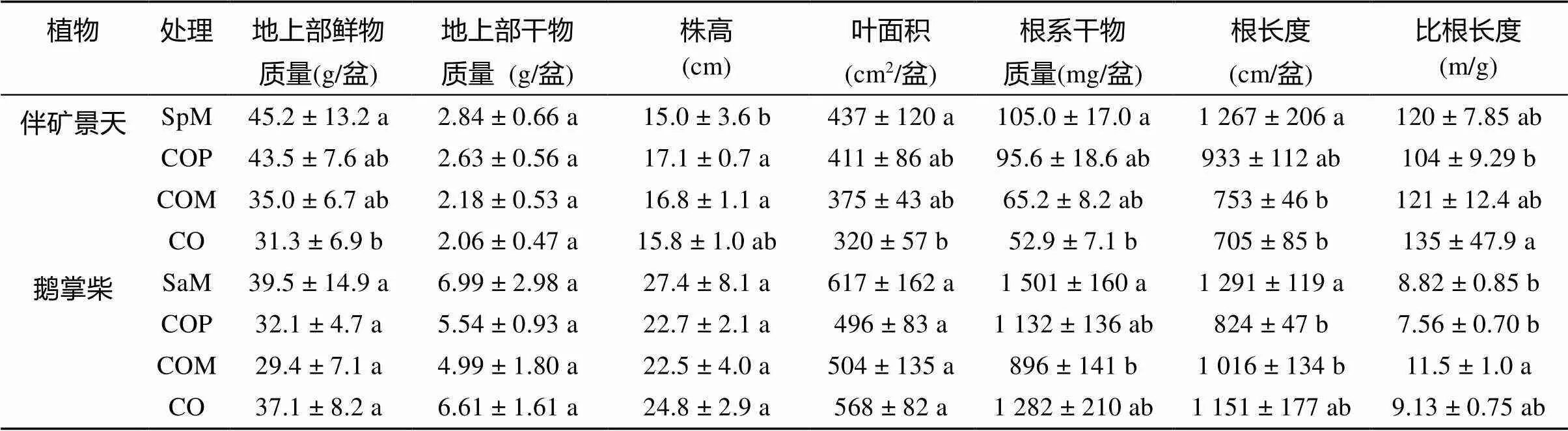
表1 伴矿景天和鹅掌柴地上部和根系特征
注:数据为平均值±标准差,= 5,不同小写字母表示同种植物不同处理间差异显著(< 0.05,Duncan检验)。SpM:伴矿景天单作;SaM:鹅掌柴单作;COP:塑料板分隔间作;COM:300 目尼龙网分隔间作;CO:无分隔间作;下同。
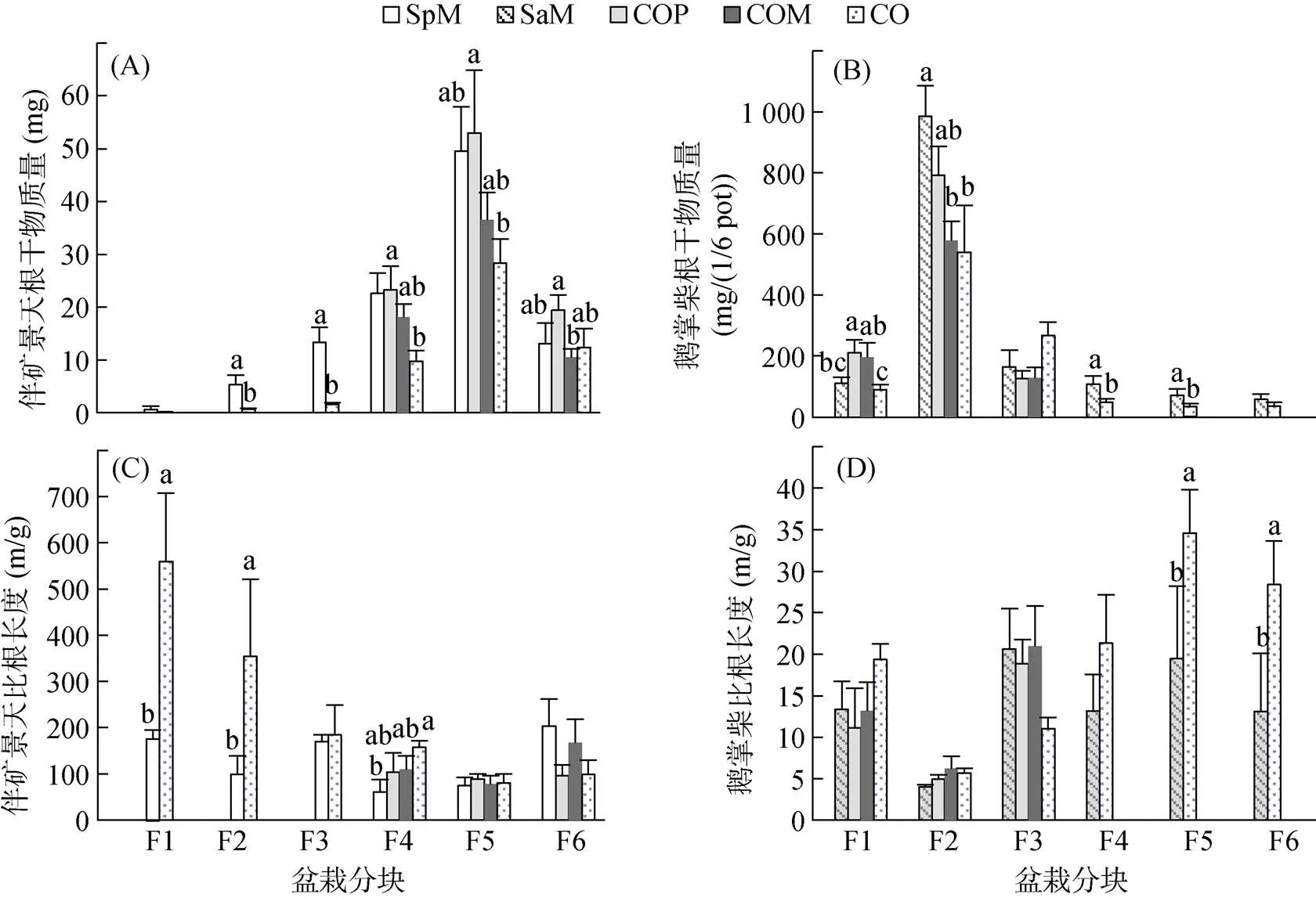
(图中小写字母不同表示同一盆栽分块不同处理间差异达显著水平(P < 0.05,Duncan检验))
伴矿景天和鹅掌柴地上部Cd含量在处理间并未出现显著差异(表2),伴矿景天地上部Cd含量达221 ~ 296 mg/kg,鹅掌柴对Cd具有一定的积累能力(富集系数1.26 ~ 1.63)。鹅掌柴Zn含量在无分隔间作(CO)处理中最高,达170 mg/kg,与最低的尼龙网分隔间作处理(COM,130 mg/kg)差异显著。由于伴矿景天地上部生物量的差异,其生长期间Cd和Zn地上部吸收量均随邻近作用的增强而降低,最高分别降低了30.0%、30.6%(SpM处理和CO处理间比较,表2)。鹅掌柴的两种金属吸收量在COM处理中最低。本试验中鹅掌柴地上部的Cd、Zn吸收量仅达伴矿景天的5% 左右(表2),间作处理中伴矿景天对植物地上部全Zn和全Cd吸收量作出主要贡献,各间作处理中两种植物的Cd、Zn吸收量及修复效率之和也较伴矿景天单作(SpM)低(表2)。
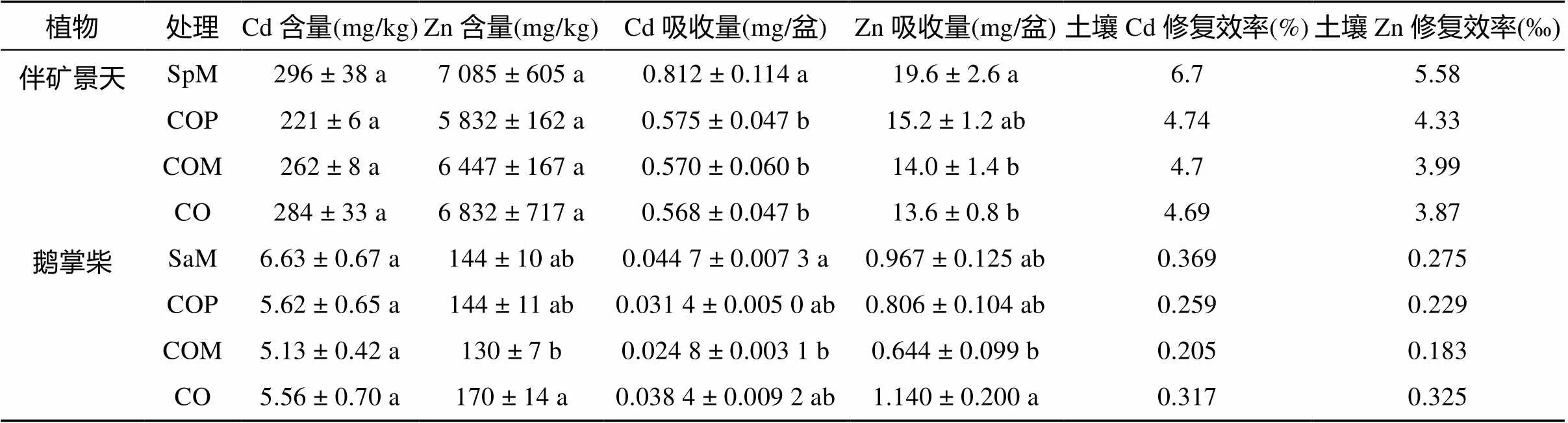
表2 伴矿景天和鹅掌柴地上部Cd、Zn含量和吸收量及土壤Cd、Zn修复效率
注:土壤Cd、Zn修复效率参照Jacobs等[11]以每处理的平均植物吸收量(mg/盆)、每盆土壤质量(3 kg)及土壤Cd、Zn初始含量(mg/kg)计算,未进行统计检验。
2.2 两种植物根系对土壤性质的影响
图3为各处理中不同盆栽分块土壤性质的差异,部分分块间的土壤养分参数具有显著差异,其中最容易观察到的趋势是在鹅掌柴生长的处理中F1 ~ F4分块速效K较伴矿景天单作处理(SpM)降低,表明鹅掌柴对土壤速效K有明显的吸收消耗作用。无机氮、DOC等在不同处理和不同分块之间变化趋势不明显,没有在图3中列出。

图3 盆栽中不同部分土壤性质变化
表3表示了线性混合模型拟合的根系参数对土壤性质参数影响。表3中斜率类似线性回归的斜率,线性混合模型引入盆中不同土壤分块作为随机效应,从统计上考虑了其非独立性对模型拟合的影响,斜率值大于0且显著时拟合的参数具有显著的正相关性,反之亦然。
两种植物根系单独作用于土壤时,其根系均导致了土壤速效K的下降,即吸收消耗。伴矿景天根系长度与有效P回归系数为正值,且达显著(= 0.034),表明伴矿景天根系单独作用时土壤有效P显著增加,有一定活化作用。而鹅掌柴根系单独作用时土壤有效P有一定下降,其根生物量与有效态回归系数达边际显著(= 0.054)。这表明两种植物共存时对K和P可能分别存在竞争和互补利用。二者根系共同作用时鹅掌柴根系参数均与速效K显著负相关,体现耗竭反应,而伴矿景天根系参数与速效K显著正相关,这可能是其根系分布与鹅掌柴负相关导致的。伴矿景天根系单独作用时,根系干物质量与有效态Cd、Zn的负回归系数(<0.001、0.045)表明伴矿景天根系对土壤有效Cd、Zn具有一定的吸收耗竭;而鹅掌柴根系参数与土壤有效态Cd、Zn并没有显著的回归系数,表明鹅掌柴根系对土壤有效态Cd、Zn作用不显著。
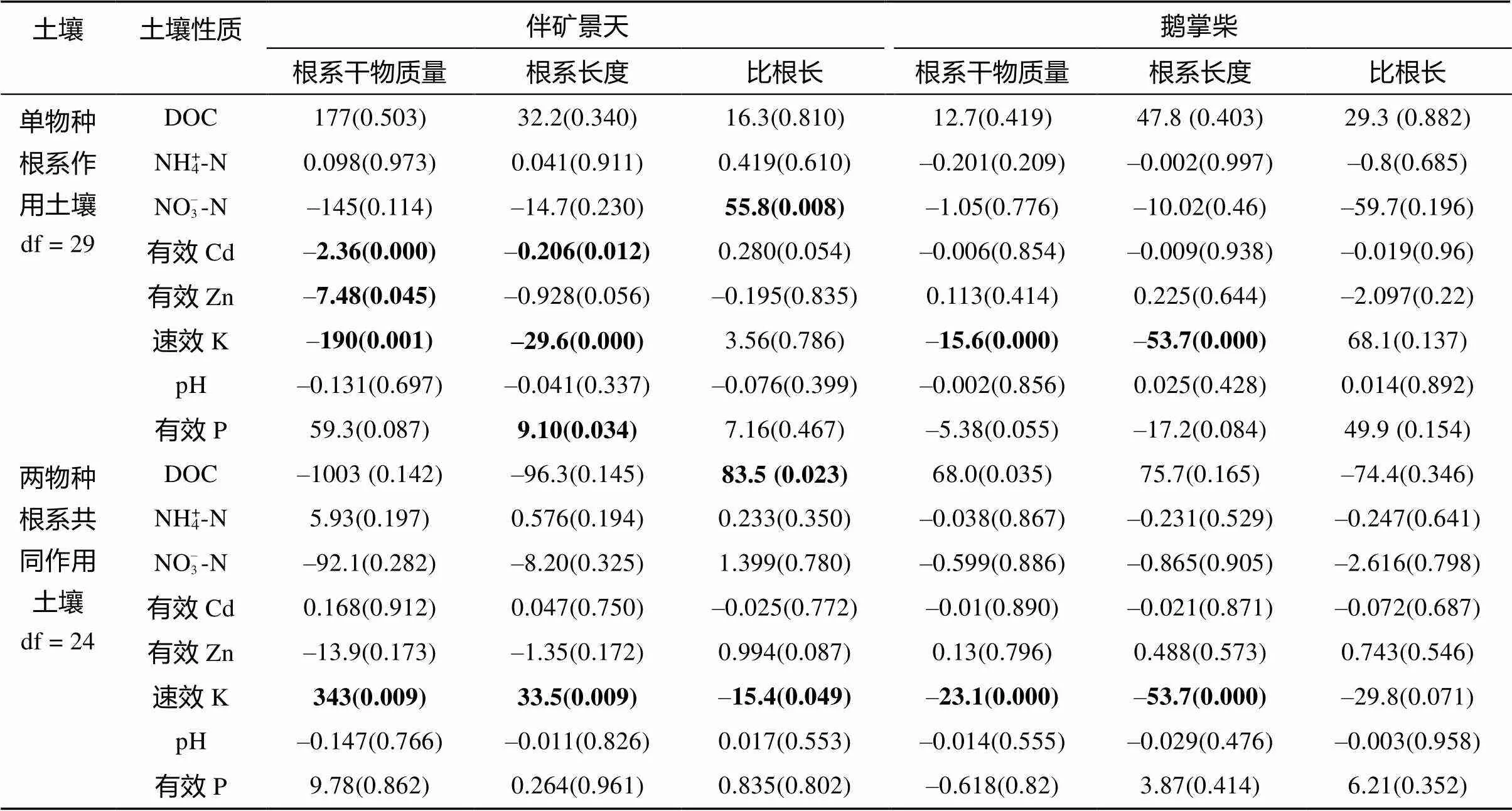
表3 土壤性质与根系性质线性混合模型的固定效应回归系数及其显著性
注:表中数据为模型固定效应的斜率系数(括号内为其P值),斜率系数乘103进行表达;加粗数值表示相关性达显著水平(P < 0.05)。
2.3 鹅掌柴根系分泌物对伴矿景天生长和Cd吸收的抑制作用
两因素方差分析结果表明水培条件下鹅掌柴根系分泌物对伴矿景天的生长和Cd吸收具有显著的主效应(表4)。无Cd处理中,鹅掌柴根系分泌物显著抑制了伴矿景天的根系鲜物质量和地上部鲜物质量;5 μmol/L Cd处理中,其抑制了伴矿景天地上部Cd含量。各处理间伴矿景天干物质量没有显著差异,这可能是作用时间较短的原因。

表4 水培条件下鹅掌柴根系分泌物对伴矿景天生长和Cd吸收的影响
注:表中数值为平均值±标准差,= 4;值表示两因素方差分析结果;不同小写字母表示同种植物不同处理间差异显著(< 0.05,Duncan检验)。
3 讨论
3.1 间作系统中植物的生长和Cd、Zn吸收
总体而言,本试验中鹅掌柴和伴矿景天间作时抑制了伴矿景天的生长和Cd吸收。与本研究结果不同,在本课题组以往的伴矿景天与作物(如芹菜[5]、玉米[1])间作试验中,伴矿景天的生长和Cd吸收并未受到抑制。植物对重金属的吸收与根系构型有关,例如前人研究表明东南景天根系长度等根系大小指标与Zn、Cd吸收呈正相关关系[12]。本研究中盆栽试验和水培试验伴矿景天根系大小都受到鹅掌柴的抑制,其Zn、Cd吸收也有所降低,其降低原因可能是抑制根系生长。
植物根系特征也是影响其共存和竞争的重要因素[13]。伴矿景天和鹅掌柴属不同生活型,其根系及地上部特征差异明显(表1),理想结果是通过鹅掌柴和伴矿景天根系分布深度差异,增加间作体系的修复植物根系分布深度,从而提高土壤垂直剖面中重金属修复效率(如Ma等[14]关于蜈蚣草和玉米间作的研究),然而本试验中二者根系出现了相互抑制生长的情形。人们曾经认为比根长和根系分布深度的差异是导致植物生态位分离和互补的重要因素,近年来的研究并不支持这一假说[13, 15]。本试验是盆栽试验,盆栽的体积限制了植物根系的生长,种植植物的间距也较田间情况窄,这可能强化了两种植物根系的接触,田间条件下可通过调整间作带宽、行比配置方式减小两种植物的根系接触。因此,田间情况下两种植物的相互关系有待进一步的实证研究。
3.2 间作系统中盆栽土壤养分和Cd、Zn变化
根系对土壤养分的异质性的产生已受到广泛的研究[16]。本研究发现两种植物吸收使土壤速效K降低(表3),二者对K可能具有竞争作用。伴矿景天根系单独作用时其根系提高了土壤的有效P,对土壤P具有一定活化作用。以往研究中伴矿景天可导致根际土壤酸化[17],但本研究中并未出现土壤pH降低现象,因此本研究中土壤P活化可能是根系分泌物等因素所致[18]。与伴矿景天相反,本试验中鹅掌柴对土壤P具有耗竭作用,间作时这两种植物对土壤P具有互补的利用模式。根系单独作用时伴矿景天根系生物量与土壤有效Cd、Zn的拟合系数呈负值并达显著,也显示了吸收耗竭作用,而鹅掌柴对土壤Cd和Zn的效应并不显著,本试验中两种植物对土壤Cd、Zn不存在竞争或互补的利用机制。
线性混合模型并未解释一些处理间的土壤性质差异(模型回归系数不显著),如土壤NO– 3、NH4+、pH等。除两种植物根系对土壤养分具有活化和吸收作用外,土壤中微生物也是参与养分竞争和循环的重要组分,对土壤养分的有效性具有影响[19-20]。已有研究报道超积累植物间作条件下根际微生物群落组成较单作发生变化[4, 21],其与间作条件下的根际矿质营养的地球化学特征的关系还有待进一步研究。
3.3 鹅掌柴化感作用对伴矿景天生长的影响
养分竞争是以往认为的根系相互作用主要介导因素之一[22],本文中鹅掌柴和伴矿景天的根系对土壤K和P具有耗竭或活化作用造成了速效K和有效P的变化,然而其含量并未到亏缺水平(NH4OAc提取态K,< 50 mg/kg[23];Olsen P,< 5 mg/kg[23]),因此本研究中土壤养分耗竭作用可能不是抑制相邻植物根系生长的主要因素。近年来有许多研究报道植物根系可通过特殊化感物质等识别相邻植物根系的存在及自我-非自我关系[24-25]。本研究在盆栽试验后设计了一个水培试验,证明鹅掌柴根系分泌物可抑制伴矿景天根系的生长与Cd吸收(表4)。本研究并未对鹅掌柴根系分泌物中的生物活性物质进行鉴定和效应验证,目前已知鹅掌柴同科的人参属()内多种植物中,酚酸类次生代谢产物随根系分泌或植物残体降解进入到根系土壤中,是引起西洋参[26]等药用植物自毒性和连作障碍的主要物质。化感物质除对植物直接产生毒性外,还可通过促进土壤病原菌生长及抑制共生的菌根真菌定植以抑制植物根系的生长[26-27]。这些报道为研究鹅掌柴根系分泌物对伴矿景天生长的影响机制指出了方向。植物种内和种间的化感效应普遍存在,农林业中作物及杂草不同物种间常呈现负的化感效应,影响作物的生长和产量[28];而正向的化感作用也是存在的,例如麦田中的麦仙翁()可通过化感作用提高小麦的产量和品质[29]。超积累植物与经济作物进行间作目前已得到一定的应用,但从化感作用的角度研究间作系统对污染修复效率的研究还很少,筛选超积累植物具有正向化感作用的间作植物促进其生长和重金属吸收可能是具有潜力的一个研究方向。
4 结论
盆栽试验条件下伴矿景天与鹅掌柴间作系统中,二者根系具有相互的生长抑制作用,并影响伴矿景天地上部生长和Cd、Zn吸收;间作系统较伴矿景天单作相比其Cd、Zn修复效率降低。两种植物对土壤K和P养分分别具有竞争和互补利用的现象,但可能不是两种植物根系相互作用的主要因素,鹅掌柴对伴矿景天的生长和Cd吸收的抑制作用可能是通过根系分泌物的化感作用所引起的。在进行污染土壤田间伴矿景天-鹅掌柴间作的植物修复时,可采取调整间作行距、带宽及行比等配置方式,以避免二者可能存在的化感抑制作用。
[1] Deng L, Li Z, Wang J, et al.Long-term field phytoextraction of zinc/cadmium contaminated soil byunder different agronomic strategies[J].International Journal of Phytoremediation, 2016, 18(2): 134–140.
[2] Wu Q T, Wei Z B, Ouyang Y.Phytoextraction of metal- contaminated soil byH: Effects ofand co-planting[J].Water, Air, and Soil Pollution, 2007, 180(1/2/3/4): 131–139.
[3] Zu Y Q, Qin L, Zhan F D, et al.Intercropping ofandaffects plant cadmium accumulation and root responses[J].Pedosphere, 2020, 30(4): 457–465.
[4] Saad R F, Kobaissi A, Goux X, et al.Soil microbial and Ni-agronomic responses tointerplanted with a legume[J].Applied Soil Ecology, 2018, 132: 60–73.
[5] Luo K, Ma T T, Liu H Y, et al.Efficiency of repeated phytoextraction of cadmium and zinc from an agricultural soil contaminated with sewage sludge[J].International Journal of Phytoremediation, 2015, 17(6): 575–582.
[6] 彭洪柳.粤北某铅锌冶炼厂周边农田镉铅污染风险与修复技术初探[D].芜湖: 安徽师范大学, 2019.
[7] Selvam A, Wong J W C.Cadmium uptake potential ofcocropped withand[J].Journal of Hazardous Materials, 2009, 167(1/2/3): 170–178.
[8] Semchenko M, John E A, Hutchings M J.Effects of physical connection and genetic identity of neighbouring ramets on root-placement patterns in two clonal species[J].The New Phytologist, 2007, 176(3): 644–654.
[9] Bartlett R J, Ross D S.Colorimetric determination of oxidizable carbon in acid soil solutions[J].Soil Science Society of America Journal, 1988, 52(4): 1191–1192.
[10] Pinheiro J, Bates D, Debroy S, et al.Nlme: linear and nonlinear mixed effects models[OL].2019-1-1.https://cran.r-project.org/web/packages/nlme/index.html.Accessed on 2019-12-6.
[11] Jacobs A, Drouet T, Noret N.Field evaluation of cultural cycles for improved cadmium and zinc phytoextraction with[J].Plant and Soil, 2018, 430(1/2): 381–394.
[12] Li T Q, Yang X E, He Z L, et al.Root morphology and Zn2+uptake kinetics of the Zn hyperaccumulator ofhance[J].Journal of Integrative Plant Biology, 2005, 47(8): 927–934.
[13] Semchenko M, Lepik A, Abakumova M, et al.Different sets of belowground traits predict the ability of plant species to suppress and tolerate their competitors[J].Plant and Soil, 2018, 424(1/2): 157–169.
[14] Ma J, Lei E, Lei M, et al.Remediation of Arsenic contaminated soil using malposed intercropping ofL.and maize[J].Chemosphere, 2018, 194: 737–744.
[15] Mommer L, van Ruijven J, de Caluwe H, et al.Unveiling below-ground species abundance in a biodiversity experiment: A test of vertical niche differentiation among grassland species[J].Journal of Ecology, 2010, 98(5): 1117–1127.
[16] Hinsinger P, Gobran G R, Gregory P J, et al.Rhizosphere geometry and heterogeneity arising from root-mediated physical and chemical processes[J].New Phytologist, 2005, 168(2): 293–303.
[17] Jiang J P, Wu L H, Li N, et al.Effects of multiple heavy metal contamination and repeated phytoextraction byon soil microbial properties[J].European Journal of Soil Biology, 2010, 46(1): 18–26.
[18] Hinsinger P.Bioavailability of soil inorganic P in the rhizosphere as affected by root-induced chemical changes: A review[J].Plant and Soil, 2001, 237(2): 173–195.
[19] Bezemer T M, Jing J Y, Bakx-Schotman J M T, et al.Plant competition alters the temporal dynamics of plant-soil feedbacks[J].Journal of Ecology, 2018, 106(6): 2287–2300.
[20] Crawford K M, Knight T M.Competition overwhelms the positive plant-soil feedback generated by an invasive plant[J].Oecologia, 2017, 183(1): 211–220.
[21] Zeng P, Guo Z H, Xiao X Y, et al.Effects of tree-herb co-planting on the bacterial community composition and the relationship between specific microorganisms and enzymatic activities in metal(loid)-contaminated soil[J].Chemosphere, 2019, 220: 237–248.
[22] Mommer L, Kirkegaard J, van Ruijven J.Root-root interactions: Towards A rhizosphere framework[J].Trends in Plant Science, 2016, 21(3): 209–217.
[23] 鲍士旦.土壤农化分析[M].3版.北京: 中国农业出版社, 2000: 83–107.
[24] Mahall B E, Callaway R M.Effects of regional origin and genotype on intraspecific root communication in the desert shrub(Asteraceae)[J].American Journal of Botany, 1996, 83(1): 93.
[25] Cossu M, Yano A, Li Z, et al.Advances on the semi-transparent modules based on micro solar cells: First integration in a greenhouse system[J].Applied Energy, 2016, 162: 1042–1051.
[26] He C N, Gao W W, Yang J X, et al.Identification of autotoxic compounds from fibrous roots ofL[J].Plant and Soil, 2009, 318(1/2): 63–72.
[27] Grainger T N, Levine J M, Gilbert B.The invasion criterion: A common currency for ecological research[J].Trends in Ecology & Evolution, 2019, 34(10): 925–935.
[28] 孔垂华, 胡飞, 王朋.植物化感(相生相克)作用[M].北京: 高等教育出版社, 2016: 362.
[29] Søgaard B, Doll H.A positive allelopathic effect of corn cockle,, on wheat,[J].Canadian Journal of Botany, 1992, 70(9): 1916–1918.
Root Interactions and Effects on Growth and Cadmium/Zinc Uptake byandin Intercropping System
SUN Xi1, 2, LI Zhu1, PENG Hongliu1, ZHAO Jie3, ZHU Renfeng3, WU Longhua1*
(1 Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 2 University of Chinese Academy of Sciences, Beijing 100049, China; 3 Jiangsu Fireflying Environmental Science and Technology Company, Nanjing 210008, China)
In the current study, a pot intercropping experiment was carried out to study the root interactions betweenand, and the plant growth and cadmium (Cd) / Zinc (Zn) uptake of the intercropping system.Whenintercropped with, the root-root interaction inhibited the root growth and shoot Cd and Zn uptake of each other.Cd and Zn removal rates of the intercropping system were lower than that ofsingle planting for 30.0% and 30.6% respectively.Soil nutrient properties were changed by the roots of the two plants, and there was competitive and complementary utilization of soil K and P, respectively.Both the concentrations of soil available K and P were not decreased to the deficit level, indicating that nutrient competition may not be the main factor of the root-root interaction of the two species.In a supplementary hydroponic experiment, the root exudates ofhad an inhibitory effect on the growth and Cd uptake of,indicating the allelopathy inhibition was one of the crucial mechanisms of root-root interaction between the two species likely
Phytoremediation; Intercropping;; Plant root interaction;
X53;S344.2;Q948.12
A
10.13758/j.cnki.tr.2021.04.014
孙曦, 李柱, 彭洪柳, 等.伴矿景天和鹅掌柴间作系统中根系相互作用对植物生长和镉锌吸收的影响.土壤, 2021, 53(4): 771–778.
国家自然科学基金杰出青年基金项目(41325003)资助。
(lhwu@issas.ac.cn)
孙曦(1991—),男,云南昆明人,博士研究生,主要从事土壤污染与修复研究。E-mail: xisun@issas.ac.cn

