脑部放疗同步靶向治疗驱动基因突变阳性NSCLC脑转移的临床价值
洪 福 钱立庭 詹必红 张洪波
1.安徽省肿瘤医院放疗科,安徽合肥 230031;2.中国科学技术大学附属第一医院 安徽省立医院放疗科,安徽合肥 230001
肺癌一直是全世界癌症相关死亡的主要原因[1]。驱动基因突变阳性非小细胞肺癌(non-small cell lung cancer,NSCLC)患者中脑转移(brain metastases,BM)发生率较高[2-3]。25%~50%的NSCLC 患者在整个疾病发生发展过程中出现BM[1-3]。驱动基因突变阳性NSCLC患者有发展BM 的倾向,首诊时表皮生长因子受体(epidermal growth factor receptor,EGFR)突变患者有30%~60%会发生BM[2-6],间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)重排患者发生BM 的概率为40%~70%[2,7-8]。目前,脑部放疗(radiotherapy,RT)是治疗BM 患者的主要方法之一。靶向治疗为驱动基因突变阳性患者提供了更好的生存效益。RT 联合靶向治疗的临床价值目前还不明确。因此,本研究主要探讨脑部RT 同步靶向治疗晚期驱动基因阳性NSCLC 合并BM 患者的临床价值,为脑部RT 和靶向治疗的最佳结合策略提供临床依据。
1 资料与方法
1.1 一般资料
回顾性分析安徽省肿瘤医院2017 年1 月至2020 年7 月收治的60 例驱动基因突变阳性NSCLC合并BM 患者的临床资料,根据治疗方案将患者分为同步治疗组(32 例),序贯治疗组(28 例)。两组一般资料比较,差异无统计学意义(P >0.05),具有可比性,见表1。纳入标准:①经颅脑MRI 或CT 证实存在BM;②经病理组织学或细胞学检查明确NSCLC 腺癌诊断;③基因检测证实驱动基因突变阳性。排除标准:①小细胞肺癌;②妊娠期或哺乳期女性;③患有其他未控制的严重疾病。本研究经医院医学伦理委员会批准。
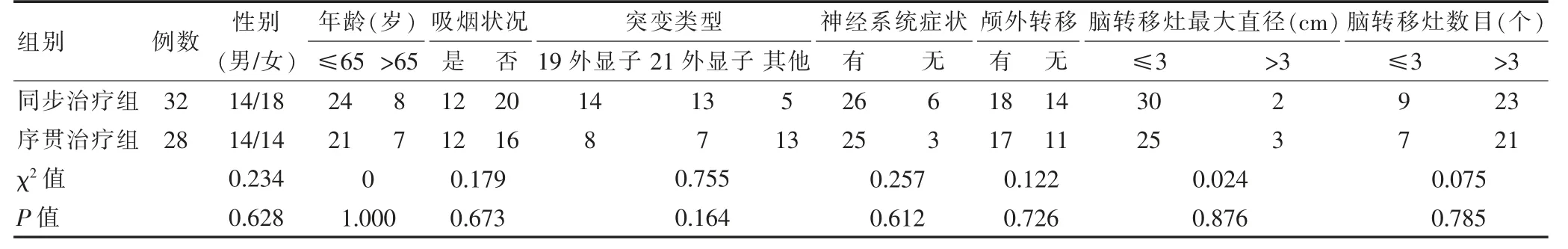
表1 两组一般资料比较(例)
1.2 治疗方法
1.2.1 同步治疗组 脑部RT 期间同步口服靶向药物治疗。脑部RT 采用全脑放疗(whole brain radiotherapy,WBRT)17 例,局部RT 9 例,WBRT+局部RT 6 例。
1.2.2 序贯治疗组 脑部RT 序贯靶向治疗,RT 前或者RT 结束后开始口服靶向药物治疗。脑部RT 采用WBRT 17 例,局部RT 2 例,WBRT+局部RT 9 例。
1.2.3 靶向治疗药物 包括吉非替尼[进口吉非替尼生产批号:1706212,生产商:阿斯利康制药有限公司;国产吉非替尼生产批号:DC1B8177,生产商:齐鲁制药(海南)有限公司]、埃克替尼(生产批号:A17092,生产商:贝达药业股份有限公司)、厄洛替尼(生产批号:SH0079,生产商:上海罗氏制药有限公司)、阿法替尼(生产批号:B72154,生产商:上海勃林格殷格翰药业有限公司)、奥希替尼(生产批号:1805067,生产商:AstraZeneca AB)、克唑替尼(生产批号:AD1475,生产商:Pfizer Manufacturing Deutschland GmbH Betriebsstatte Freiburg)。
1.2.4 脑部RT 方案 处方剂量:全脑剂量30~40 Gy/10~20 次,颅内转移灶局部剂量27~60 Gy/3~33 次[9]。
1.3 观察指标
比较两组近期疗效、不良反应发生率以及生存情况(包括根据RT 技术不同进行的亚组分析)。疗效评价参照实体瘤疗效评价标准(RECIST 1.1)[10]包括完全缓解(complete remission,CR):所有靶病灶消失;部分缓解(partial remission,PR):以基线直径总和为参照,所有靶病灶的直径总和减少至少30%;疾病进展(progressive disease,PD):以整个实验研究过程中所有测量的靶病灶直径之和的最小值为参照,直径和相对增加至少20%(如果基线测量值最小就以基线值为参照);除此之外,必须满足直径和的绝对值增加至少5 mm(出现一个或多个新病灶也视为疾病进展);疾病稳定(stable disease,SD):靶病灶减小的程度没达到PR,增加的程度也没达到PD,研究时可以直径之和的最小值作为参考;客观缓解率(objective remission rate,ORR)=(CR+PR)例数/总例数×100%。不良事件的评估使用通用术语不良事件标准(版本4.0)[11]。将不良事件的严重程度分为1~5 级:1 级轻度,无症状或轻度症状,仅临床或诊断发现,无需治疗;2 级中度,需要较小、局部或非侵入性治疗,与年龄相关工具性日常生活活动受限;3 级严重或具有重要医学意义,但不会立即危及生命,住院治疗或延长住院时间,致残,自理性日常生活活动受限;4 级危及生命,需紧急治疗;5 级死亡。生存参数包括颅内疾病无进展生存时间(intracranial progression free survival,iPFS)、总生存期(overall survival,OS)。iPFS 定义为BM 确诊后第一次治疗至颅内疾病进展或死亡。OS 定义为BM 确认至患者死亡或最后一次随访。通过住院或门诊对两组患者进行随访,自BM 确认之日起计算随访时间,截至2021 年1 月。
1.4 统计学方法
采用SPSS 23.0 统计学软件进行数据分析,计数资料用例数或百分率表示,组间比较采用χ2检验;生存曲线采用Kalpan-Meier 法,组间比较采用Log-rank检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 两组近期疗效比较
两组ORR 比较,差异无统计学意义(P >0.05)。见表2。
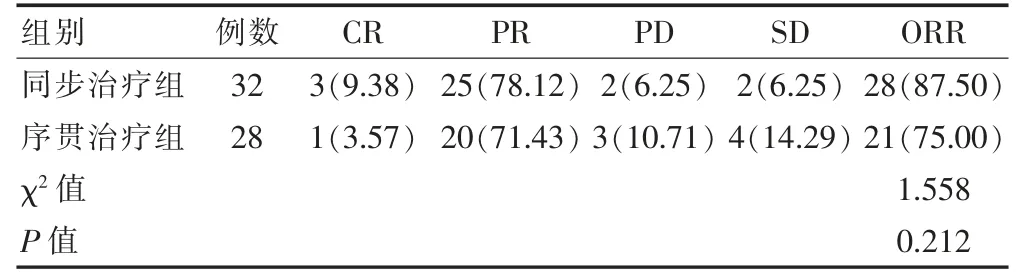
表2 两组近期疗效比较[例(%)]
2.2 两组不良反应发生率比较
两组均为1~2 级不良反应,且两组不良反应发生率比较,差异无统计学意义(P >0.05)。见表3。

表3 两组不良反应发生率比较[例(%)]
2.3 两组生存情况比较
两组中位OS 比较,差异无统计学意义(P >0.05),见图1A。同步治疗组iPFS 为14.2(95%CI:13.091~15.309)个月,高于序贯治疗组的9.0(95%CI:7.963~10.037)个月,差异有统计学意义(χ2=35.500,P <0.05),见图1B。亚组分析中,两组WBRT、局部RT、WBRT+局部RT 的中位OS 及中位iPFS 比较,差异无统计学意义(P >0.05),见图2~3。
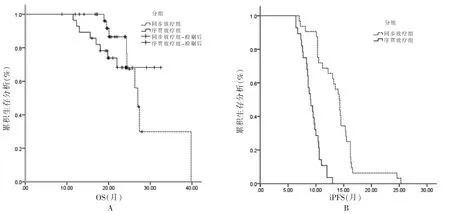
图1 两组OS、iPFS 比较
3 讨论
肺癌是最常见的癌症,也是癌症相关死亡最主要原因[1]。既往由于药物在血脑屏障(blood brain barrier,BBB)上的穿透有限,放射治疗一直被认为是治疗BM的基石。近年来,有证据显示靶向治疗如酪氨酸激酶抑制剂在脑脊液穿透率提高[7-9,12-14]。一项回顾性研究显示[15],与其他治疗方法比较,靶向治疗联合RT 的ORR 和生存期有所提高。本研究结果显示,两组ORR、中位OS 比较,差异无统计学意义(P >0.05);但同步治疗组iPFS 高于序贯治疗组(P <0.05)。对于RT和靶向联合治疗可改善iPFS,可能有以下几种解释。首先,中枢神经系统通常是靶向治疗后的初始进展部位,因此,更好的颅内疾病管理可能会改善iPFS。第二,BM 与原发或其他转移部位之间的EGFR 突变存在异质性。一项对转移性脑肿瘤组织的全外显子组测序研究显示[16],53%的转移瘤具有原发肿瘤不存在的基因改变。因此,单纯靶向本身不足以治疗驱动基因突变阳性NSCLC 患者BM。第三,RT 可以破坏BBB,增加BBB 的通透性,因为BBB 的存在会阻碍药物治疗颅内肿瘤的效果。目前,NSCLC 患者BM 的RT方案主要包括立体定向放射外科(stereotactic radiosurgery,SRS)、WBRT[4-7,17-19]。考虑到驱动基因突变阳性NSCLC 有较长生存期,处理脑转移瘤的治疗策略必须保留神经认知功能和生活质量。WBRT 与神经认知功能下降相关。WBRT 后患者在一系列认知测试中表现出下降,超过90%的患者在WBRT+SRS 治疗后3 个月表现出认知下降,而单独接受SRS 的患者有63.5%治疗后3 个月表现出认知下降[20]。而且即使在多发脑转移瘤中,SRS 的治疗效果也不劣于WBRT[20-28]。本研究中WBRT 后患者也出现记忆力下降,同步治疗组与序贯治疗组分别有68.75%和78.57%的患者出现RT 后记忆力下降。另外,在亚组分析中,两组WBRT、局部RT、WBRT+局部RT 的中位OS、中位iPFS 比较,差异无统计学意义(P >0.05)。提示与局部RT 比较,WBRT或WBRT+局部RT 并未带来总生存获益以及颅内疾病的局部控制,并且局部RT 的神经系统毒性更低。
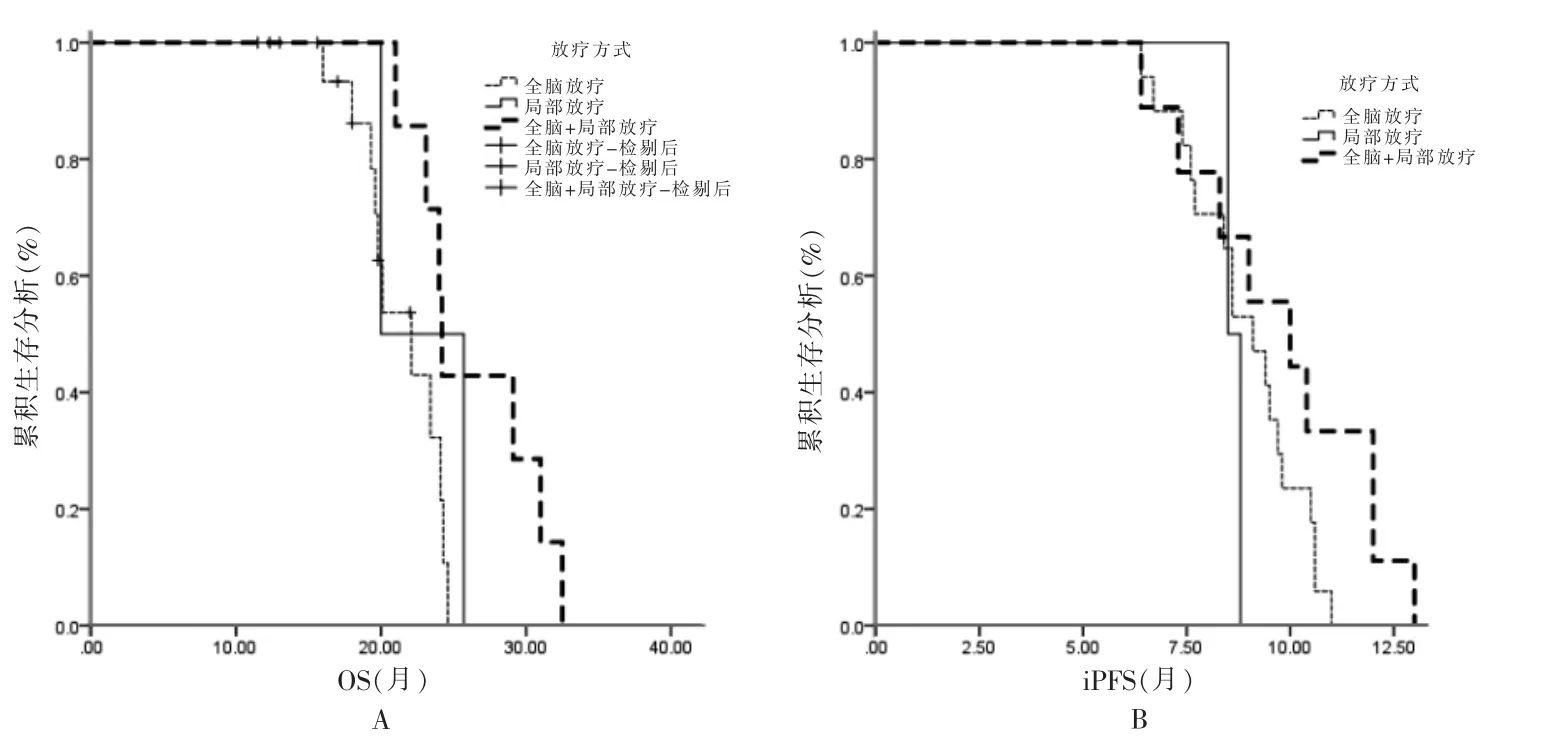
图3 序贯治疗组中WBRT、局部RT、WBRT+局部RT 的OS、iPFS 比较
本研究有一定的局限性:①本研究只包括来自单一研究机构的患者,例数相对较少;②由于是回顾性的研究,未定义的偏见或混杂因素可能影响临床结果。RT 联合靶向治疗近年来较多见,但RT 方式、介入时机等,都需要更多的前瞻性研究来提供证据支持,以实现更加有效、更加个体化的治疗。

