肺结核患者血清可溶性髓系细胞触发受体-1、干扰素-γ与降钙素原水平与临床预后的相关性研究
李 剑,杨梁梓,刘 智,傅佳鹏,刘志超,柯 学,傅向东,李国保
深圳市第三人民医院肺病三科,广东 深圳 518000
临床中肺结核属于常见呼吸道传染性病症,主要传播途径为飞沫传播,发病是由结核杆菌诱导的,肺结核在我国具较高患病率,是全球22个肺结核病高负担国家之一[1]。既往全球通过针对性方案治疗肺结核的方案,发挥显著功效,降低全球范围内肺结核的发病率,但近年来临床不完全统计的发现,肺结核发病率呈上升趋势,其中重要原因为耐药与耐多药肺结核的出现,且呈逐步递增趋势[2]。形成上述现象的原因为化疗方案不合理、化疗管理不完善、肺结核患者依从性差等。降钙素原(PCT)与可溶性髓系细胞触发受体-1(sTREM-1)均是反映严重细菌性感染敏感性强的血清学指标,而干扰素-γ(IFN-γ)则是反映机体免疫机制的重要性指标[3]。既往临床研究中上述指标均能有效诊断与评价感染性病症的预后,具有良好的敏感性与特异性[4]。因此本研究收集肺结核患者84例,通过检测其血清sTREM-1、IFN-γ、PCT水平,分析其在肺结核患者机体中的变化情况,现报告如下。
1 资料与方法
1.1 临床资料
收集2019年5月—2020年12月期间于深圳市第三人民医院接受诊疗的肺结核患者84例作为研究组;另外收集同期于医院体检的志愿者42例,作为对照组。肺结核纳入标准:(1)均符合《肺结核诊断和治疗指南》中肺结核诊疗标准者[5];(2)均行肺部X射线拍片、CT、痰培养实验等确诊为肺结核者;(3)患者肺部病灶范围为1~2个肺野者;(4)均入院接受针对性治疗者;(5)自愿参与研究且知情同意者。排除标准:(1)合并患其他严重心肾等脏器功能性不全者;(2)合并恶性肿瘤者;(3)患精神类疾病或认知障碍者;(4)临床资料不完整,或中途退出者。
1.2 方法
(1)亚组分组。据肺结核临床疗效评价标准将研究组分为两个亚组,有效组(53例)与无效组(31例)。评价标准如下:①细菌学评价:同期检查痰结核菌培养1次及连续查痰涂片3次,均呈现为阴性,可评价为有效;②痰液评价:痰带菌量减低或痰菌转阴可评价问有效,当痰带菌量无降低迹象,甚至增多可评价为无效;③X线评价:X线影像显示肺部病灶已明显吸收或者有吸收可评价为有效,反之X线影像显示肺部病灶无变化或病灶恶化评价为无效,符合上述标准可评价为有效[6]。
(2)血清学指标检测。①血清制备。抽取对照组、研究组(治疗前、治疗后2个月、治疗后6个月)所有研究对象的外周静脉血样6 ml,放置于非抗凝的干燥试管中,后采用医用台式低速离心机[上海医疗器械有限公司手术器械厂,沪食药监械(准)字2012第1410110号]以3 000 r/min的转速离心10 min,获取上层血清,后置于零下25℃的环境中贮存待检。②指标检测方法。其中血清IFN-γ、sTREM-1水平采用双抗体夹心酶联免疫吸附性试验(ELISA),配套试剂盒来源于上海酶联生物科技有限公司,需严格按照试剂盒说明书进行。血清PCT水平采用免疫荧光法检测,配套检测试剂盒与荧光酶标免疫检测仪均来源于法国梅里埃公司,严格按照操作标准执行。
1.3 统计学方法
数据通过统计学软件SPSS 22.0录入处理,计量资料以(±s)表示,组间比较行t检验,计数资料以n(%)表示,组间比较行χ2检验,采用ROC曲线综合分析血清sTREM-1、IFN-γ、PCT水平对肺结核预后的评价价值;采用COX回归分析疾病预后与血清sTREM-1、IFN-γ、PCT水平的关系,P<0.05提示差异有统计学意义。
2 结果
2.1 两组临床一般资料比较
两组性别比例、平均年龄、体重指数、吸烟史、慢阻肺等比较,差异无统计学意义(P>0.05)。研究组治疗前血清sTREM-1、PCT水平均高于对照组,而研究组治疗前血清IFN-γ水平低于对照组,差异有统计学意义(P<0.05),见表1。
表1 两组临床一般资料比较(±s) 例(%)
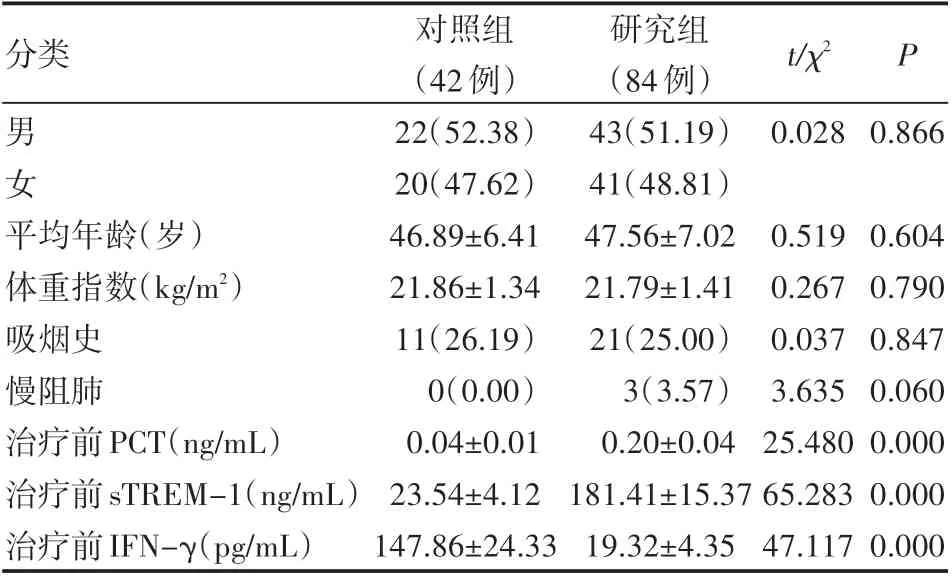
表1 两组临床一般资料比较(±s) 例(%)
分类男女对照组(42例)22(52.38)20(47.62)46.89±6.41 21.86±1.34 11(26.19)0(0.00)0.04±0.01 23.54±4.12 147.86±24.33研究组(84例)43(51.19)41(48.81)47.56±7.02 21.79±1.41 21(25.00)3(3.57)0.20±0.04 181.41±15.37 19.32±4.35 t/χ2 0.028 0.866 P平均年龄(岁)体重指数(kg/m2)吸烟史慢阻肺治疗前PCT(ng/mL)治疗前sTREM-1(ng/mL)治疗前IFN-γ(pg/mL)0.519 0.267 0.037 3.635 25.480 65.283 47.117 0.604 0.790 0.847 0.060 0.000 0.000 0.000
2.2 肺结核不用疗效患者血清学指标水平比较
肺结核患者有效组与无效组血清学指标治疗前比较,差异无统计学意义(P>0.05);经过治疗后,在治疗后2个月与6个月两个时间点有效组血清学指标PCT、sTREM-1水平均低于无效组,而有效组血清学指标IFN-γ水平高于无效组,差异有统计学意义(P<0.05),见表2。
表2 肺结核不用疗效患者血清学指标水平比较(±s)
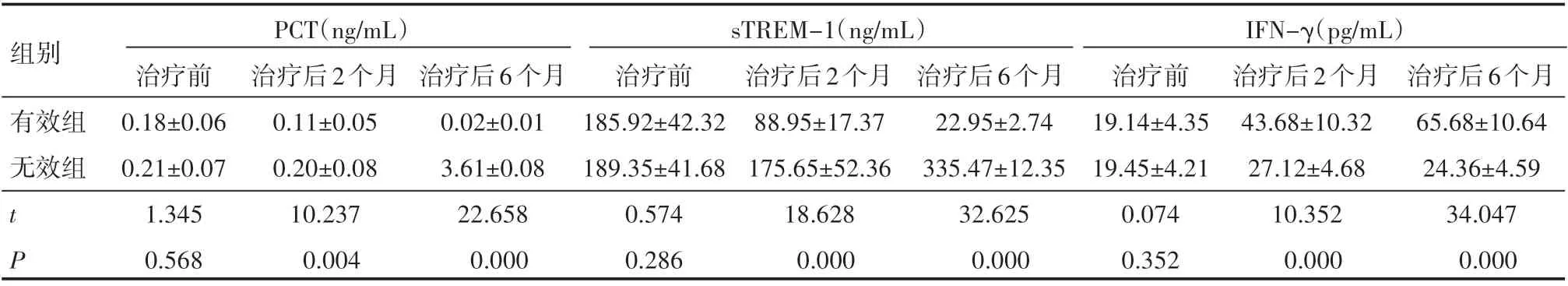
表2 肺结核不用疗效患者血清学指标水平比较(±s)
组别PCT(ng/mL)IFN-γ(pg/mL)有效组无效组tP治疗前0.18±0.06 0.21±0.07 1.345 0.568治疗后2个月0.11±0.05 0.20±0.08 10.237 0.004治疗后6个月0.02±0.01 3.61±0.08 22.658 0.000 sTREM-1(ng/mL)治疗前185.92±42.32 189.35±41.68 0.574 0.286治疗后2个月88.95±17.37 175.65±52.36 18.628 0.000治疗后6个月22.95±2.74 335.47±12.35 32.625 0.000治疗前19.14±4.35 19.45±4.21 0.074 0.352治疗后2个月43.68±10.32 27.12±4.68 10.352 0.000治疗后6个月65.68±10.64 24.36±4.59 34.047 0.000
2.3 不同时间点血清学指标对临床疗效评价的ROC曲线分析
经分析,肺结核患者治疗前血清PCT、sTREM-1、IFN-γ水平对于评定临床疗效与预后的价值较低,AUC分别为0.62、0.71、0.65。而治疗2个月后血清PCT、sTREM-1、IFN-γ水平具有较高评定临床疗效与预后的价值,AUC分别为0.82、0.86、0.89,见表3。
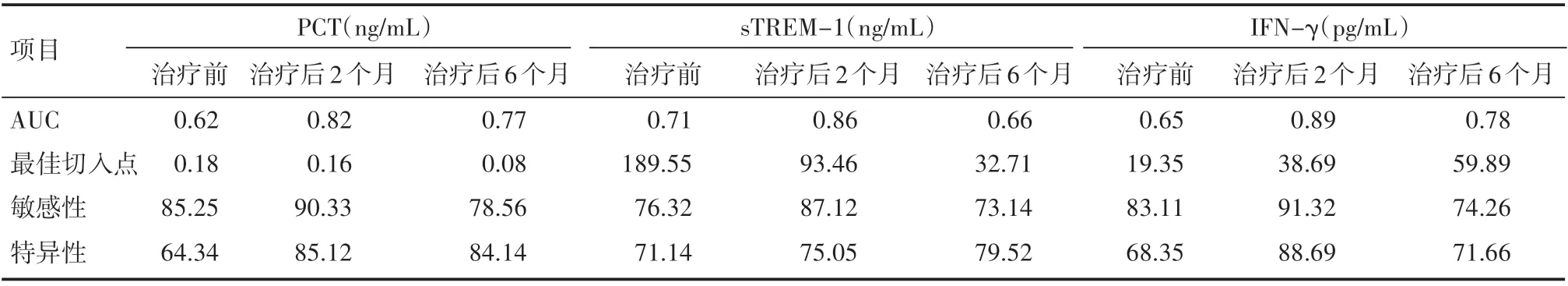
表3 不同时间点血清学指标对临床疗效评价的ROC曲线分析
2.4 肺结核患者不同因素COX回归分析
经单因素分析发现,年龄、合并胸腔积液、血清PCT、sTREM-1、IFN-γ水平的高低均是肺结核患者临床预后的危险因素(P<0.05)。进一步多因素分析发现血清PCT(≥0.16 ng/mL)、sTREM-1(≥93.46 ng/mL)、IFN-γ(≤38.69 pg/mL)均是肺结核患者预后的危险因素(P<0.05),见表4。

表4 肺结核患者不同因素COX回归分析
3 讨论
调查发现肺结核因治疗效果差,肺部X线影像改变以及痰菌变化缓慢,短期内难以判断临床疗效与预后情况,是临床治疗的困难点之一。本研究探究肺结核患者血清sTREM-1、IFN-γ与PCT水平与临床疗效与预后的相关性,分析发现血清PCT、sTREM-1、IFN-γ均是肺结核患者预后的危险因素。表示当血清PCT超过0.16 ng/mL、sTREM-1超过93.46 ng/mL、IFN-γ低于38.69 pg/mL时,提示肺结核患者临床疗效与预后较差,表明血清PCT与sTREM-1水平与肺结核预后呈负性相关,而IFN-γ水平与肺结核预后呈正性相关。PCT作为降钙素的前体,生理情况下血清PCT几乎不升高,而当机体受到外界细菌感染时,全身多种组织和细胞均可在炎症细胞和细菌分泌的内外毒素的刺激下大量合成PCT,PCT尤其对细菌毒素的刺激敏感,细菌感染机体的早期PCT即可迅速升高,因此PCT又是感染性疾病的早期诊断指标。本研究调查发现在结核杆菌感染方面,当血清PCT水平高于0.16 ng/mL时是影响其预后的危险因素,且在诊断疾病临床疗效与预后时的敏感性较高,该指标与临床预后呈负相关,即该指标水平升高,患者疗效与预后均较差。TREM-1是表达在巨噬细胞和中性粒细胞表面的膜受体蛋白,对免疫反应具有正调控作用,是免疫反应的发生和级联放大效应的重要触发器,sTREM-1为TREM-1的可溶性形式,水平主要受细胞外细菌的影响,当细菌感染时其水平表达会明显上调,因此可作为肺结核预后的诊断指标。IFN-γ是在抗原刺激作用下由CD4+细胞早期产生、CD8+后期产生的多活性糖蛋白,其可通过增强T细胞功能、促进其自身产生的作用,形成良性的正反馈机制,利于提升肺结核感染的免疫应答作用,从而阻断肺结核感染发病和病情的进一步加重,因此可作为诊断肺结核临床疗效的预后的指标[7]。
综上所述,经临床检测分析发现肺结核患者血清sTREM-1、IFN-γ、PCT水平与病情严重程度、临床疗效与预后均密切相关,治疗期间定期测定上述血清学指标水平有助于及时评价临床疗效与预后情况。

