幽门螺杆菌毒力因子CagA 对人正常胃上皮HFE145 细胞CDX1 表达及上皮间质转化的影响
张珊珊 苗 丰 刘 露 吕文瑶 张 绅 赵志峰
1.中国医科大学附属第四医院消化内科,辽宁沈阳 110032;2.中国医科大学附属第四医院肿瘤科,辽宁沈阳 110032
细胞毒素相关基因A(cytotoxin related gene A,CagA),是幽门螺杆菌(Helicobacter pylor,Hp)的重要毒力因素之一,是Hp-CagA 致病岛编码的蛋白质。研究显示,与CagA 阴性菌株比较,CagA 阳性菌株Hp感染胃癌风险明显增加[1-4]。CagA 与肠化生发生关系密切,CagA 与E-cadherin 和β-catenin 信号通路相互作用可能是导致肠化生的重要因素,但CagA 促使胃上皮向肠样上皮细胞转化的机制尚未完全阐明[5-6]。尾型同源盒基因1(cadual type homeobox transcription factor 1,CDX1)是一种同源盒转录因子,是一种βcatenin 依赖性基因,由解除调控的β-catenin 反式激活,可由Hp-CagA 触发,在人类肠道发育和功能维持中发挥重要作用[7-8]。对恒河猴的研究显示,Hp 感染胃黏膜后,胃上皮细胞CDX1 表达增加1.59 倍,异常表达的CDX1 与Barrett 食管发育及肠化生、异型增生和胃癌发生密切相关[9]。既往研究显示,稳定表达CagA 的胃癌细胞中CDX1 表达增加[10]。本研究观察Hp 毒力因子CagA 是否增加人正常胃上皮HFE145细胞中CDX1 表达及CDX1 对上皮间质转化(epithelial-mesenchymal transition,EMT)的影响,评估CDX1作为胃癌化学预防和潜在靶点的可行性。现将结果报道如下:
1 材料与方法
1.1 细胞系和试剂
人正常胃上皮细胞HFE145 细胞系(武汉普诺赛生命科技有限公司);Hp 野生型60190 菌株和CagA敲除60190ΔA 菌株(青旗上海生物技术发展有限公司);CagA 阳性质粒WT-CagA 和阴性质粒pcDNA3.1(韩国延世大学李勇教授提供);慢病毒转导人CDX1 shRNA(SC-35731-V,大连宝生物工程有限公司);转染试剂Lipofectamine2000(赛默飞世尔,919437);嘌呤霉素(MedChemExpress LLC,纯度99.87%,419E0418);E-cadherin、Vimentin、N-cadherin 一抗(圣克鲁斯生物技术,A-AJ1249a、WL00742A、LO-ANR-082-50);RIPA Lysis and Extraction Buffer、BCM 蛋白定量试剂盒、ECL 发光检测试剂盒(碧云天生物科技有限公司,89900、P1511-1、36223ES60)。
1.2 细胞培养
HFE145 细胞采用含10%胎牛血清的RPMI 1640培养基培养于37℃、5%CO2的细胞培养箱中,隔天换液,细胞生长至70%~80%的致密度时用0.25%胰蛋白酶消化传代,传至3~4 代后进行实验。
1.3 CagA 对HFE145 细胞影响
将细胞调整于5×105细胞/孔接种于6 孔版,37℃培养20 h,无菌PBS 洗涤1 次,以100∶1 的感染倍数添加60190 菌株和60190ΔA 菌株分别为60190 组、60190ΔA 组,空白组不加细菌,仅加培养基。24 h 后采用倒置显微镜观察细胞形态。
1.4 细胞转染
将细胞分为对照组、阴性组、CagA 组和联合组,分别采用Lipofectamine2000 转染空白试剂、pcDNA3.1、WT-CagA、WT-CagA 联合SC-35731-V,严格按照说明书操作。
1.5 Transwell 小室法检测转染后细胞迁移及侵袭能力
按“1.4”项下方法转染后,将细胞以5×103细胞/孔均匀接种于铺有基质胶的Transwell 小室底部,再将小室置于10%FBS 培养基的孔板中培养,24 h 后取出小室,清洗后采用多聚甲醛固定细胞,结晶紫染色,镜检计数。细胞迁移实验除不使用基质胶外其余步骤与侵袭实验相同。
1.6 Western blot 法检测转染后细胞中CDX1、CagA、E-cadherin、Vimentin 和N-cadherin 蛋白表达水平
Wester blot 法检测转染后四组CDX1、CagA、E-cadherin、Vimentin 和N-cadherin 蛋白表达水平,以GAPDH 为内参。
1.7 荧光素酶报告基因实验
采用引物正向:5’-CTCGAGGATCCCGATTCACAAAC-3’和反向:5’-AAGCTTCAACCCATCCAACC-3’扩增CDX1 启动子片段,然后用PCR 技术克隆到pGL3碱性荧光素酶载体中。为了测定CDX1 启动子中CagA 的结合位点,将CDX1 启动子的1000 bp 片段分为Mut 500 和Mut 1000,并进行了相同的克隆实验(Mut 500 引物,正向:5’-CTCGAGACTCCAGCTTCCATGA-3’和反向:5’-AAGCTTCACCCTGACTC-3;Mut 1000 引物,正向:5’-CTCGAGGGATTCCGATTCACAAAC-3’和反向:5’-AAGCTTTCCCTGGAATGCACAAAC-3’)。将WT-CagA 克隆到HA 标记的pSP36SR 载体中。HFE145 细胞细胞以6×105细胞/孔的密度接种于6 孔板中。用LT1(Mirus Bio LLC)与1.3 μg CagA cDNA psP65SR 载体、1 μg CDX1 启动子荧光素酶质粒和20 ng pNL1.1 质粒(Promega 公司)共转染细胞。2 d 后,收集细胞,裂解,并使用Nano-Glo 双荧光素酶报告系统(Promega 公司)分析荧光素酶活性。
1.8 统计学方法
采用SPSS 23.0 统计学软件进行数据分析,计量资料用均数±标准差()表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t 法,两组间比较采用t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 CagA 对HFE145 细胞生长的影响
空白组和690190ΔA 组HFE145 细胞呈多形或树形,细胞轮廓清晰,胞核、胞浆分界清楚;60190 组HFE145 细胞拉长,呈现典型“蜂鸟表型”。见图1。
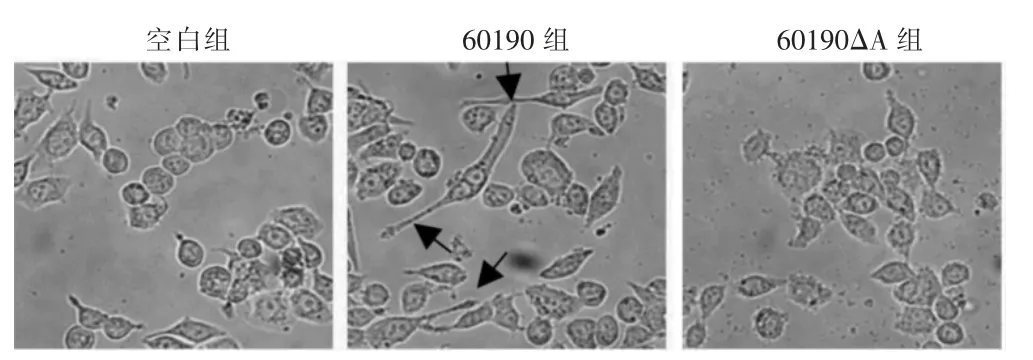
图1 CagA 对HFE145 细胞生长的影响(200×)
2.2 CagA 转染对HFE145 细胞CagA 和CDX1 蛋白表达的影响
对照组和阴性组未见CagA 表达,CagA 组和联合组CagA 蛋白表达水平比较,差异无统计学意义(P >0.05)。CagA 组CDX1 蛋白表达水平高于对照组和阴性组(P <0.05);联合组CDX1 蛋白表达水平低于CagA 组(P <0.05)。见图2。
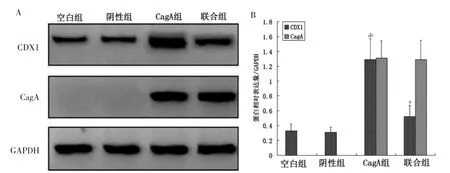
图2 CagA 转染对HFE145 细胞CagA 和CDX1 蛋白表达的影响
2.3 CagA 对HFE145 细胞迁移及侵袭能力的影响
CagA 组HFE145 细胞侵袭及迁移能力高于对照组和阴性组(P <0.05),联合组HFE145 细胞侵袭及迁移能力低于CagA 组(P <0.05)。见图3。

图3 CagA 对HFE145 细胞迁移及侵袭能力的影响
2.4 荧光素酶报告基因实验结果
缺失CDX1 外显子上游501~1000 碱基对不抑制荧光素酶活性,缺失1~500 碱基对抑制荧光素酶活性。见图4。

图4 荧光素酶报告基因实验结果
2.5 CagA 转染对EMT 相关蛋白的影响
CagA 组E-cadherin 蛋白表达水平低于对照组和阴性组(P <0.05),联合组E-cadherin 蛋白表达水平高于CagA 组(P <0.05)。CagA 组Vimenti 和N-cadherin 水平高于对照组和阴性组(P <0.05),联合组Vimenti 和N-cadherin 水平低于CagA 组(P <0.05)。见图5。

图5 CagA 转染对EMT 相关蛋白的影响
3 讨论
胃癌是最常见的恶性肿瘤之一,胃癌的发生包括弥漫性慢性胃炎、黏膜萎缩、肠化生、上皮内瘤变、浸润性胃癌等过程,Hp 感染促进肠化生的发展,作为胃癌前病变,肠化生已被广泛研究,但其形成和发展尚未完全阐明[11-13]。本研究结果显示,Hp 分泌的毒力因子CagA 可促进CDX1 的异常表达,促进细胞侵袭或迁移,诱导EMT 转化。既往研究显示,CDX1 是癌前病变向肿瘤性病变转换的重要机制,CDX1 基因敲除可逆转癌前病变的转化[14]。本研究及前期研究均显示其可诱导EMT 分化和癌前病变。
既往研究[15]显示,Hp 感染可诱导CDX1 表达,导致慢性炎症,随后胃上皮细胞凋亡增加,导致萎缩、分化状态改变、化生和表达肠标志物的肠细胞样细胞出现。CDX1 上调转录因子,如SALL4、KLF5(27)和PPARγ,促进胃上皮细胞向肠上皮细胞的转分化[16]。对668 例胃癌患者的临床研究显示,PPARγ 表达可预测肠型胃癌患者的预后,但对弥漫型胃癌的预后无预测作用[17]。由于CDX1 在显示肠化生的胃和食管组织中的表达水平高于正常水平[18],本研究揭示的功能可能有助于理解萎缩性胃炎和肠化生。
缺失CDX1 外显子上游501~1000 碱基对不抑制荧光素酶活性,缺失1~500 碱基对抑制荧光素酶活性,提示CagA 相关因子的潜在结合位点位于指定区域,在CDX1 外显子上游保留1~500 个碱基对的截短突变下,荧光素酶活性增加可能是由于启动子面积缩短而增加了结合亲和力,证实CagA 依赖性CDX1 的表达,并确定CagA 相关因子的潜在结合位点。CDX1 沉默部分逆转了CagA 转染细胞的侵袭表型,降低了EMT 相关蛋白的表达,恢复了正常上皮标志物的表达,这一结果支持了肠化生至少可以部分逆转的观点。尽管最近的研究发现根除Hp 可部分逆转癌前病变,但根除Hp 后肠上皮化生的可逆性仍存在争议[19-22]。抗糖尿病药物二甲双胍在体外和体内的作用与CDX1抑制相似:逆转肿瘤干细胞样表型,抑制肿瘤发生和肿瘤生长,提高对某些化疗药物的敏感性。研究显示,二甲双胍抑制肿瘤生长的途径包括:抑制细胞周期相关蛋白、激活AMPK(40)抑制mTOR 途径以及抑制胰岛素分泌和IGF-1 信号传导,CDX1 可能是二甲双胍的另一个靶点,具有肿瘤启动潜能的癌细胞群对其能量产生的反应更多地是氧化磷酸化而不是糖酵解,二甲双胍是一种有效的氧化磷酸化抑制剂,它有可能抑制了这些氧化磷酸化依赖性癌干细胞的活性,而这恰好是CDX1 表达细胞的一个主要特征[23-24]。动物研究[25]显示,二甲双胍治疗异种移植小鼠后CDX1 表达减少。提示使用可能抑制与CDX1 表达相关的表型变化的药物,例如在发生萎缩或肠化生后使用二甲双胍可能对预防病情进展有利。
总之,本研究发现Hp 毒力因子CagA 诱导的CDX1的异常表达促进胃上皮EMT,靶向性抑制CDX1 在逆转EMT 发生发展和胃癌防治的作用具有进一步研究的价值。

