探讨EGFR野生型进展期NSCLC患者TKI治疗意义
于芹,杨昊
(内蒙古肿瘤医院,内蒙古自治区 呼和浩特 010020)
0 引言
肺癌在最近这几十年中逐渐成为发病率最高的肿瘤,世界卫生组织公布的数据表明,在2008年全世界被诊断为肺癌的人数为1.61亿人,占癌症总发病人数的13%,居第一位,尤其针对野生型NSCLC患者缺乏有效的治疗手段,特别是二线以后的治疗,虽然目前免疫治疗不断给我们带来惊喜,但临床中因经济问题、免疫相关不良反应等诸多因素依旧使用受限。现本文对EGFR野生型NSCLC患者给予TKI治疗的疗效进行回顾性分析,以探讨对于高龄、PS评分高的NSCLC患者能否从TKI治疗中获益?以增加对于EGFR野生型NSCLC治疗方式的更多选择。
1 材料和方法
1.1 研究对象
该项目选取在河北省肿瘤医院诊治的自2016年1月至2017年12月期间的44例EGFR野生型进展期非小细胞肺癌患者,入组患者均为EGFR野生型,且有明确病理诊断和相关影像学检查,例如CT、MRI、PET/CT以及骨扫描等,以协助评估病情。
1.2 方法
(1)既往一线含铂双药化疗失败的患者,按照二线选择的治疗方案分化疗组和TKI组;(2)根据TKI用于EGFR野生型患者的时间分为一线TKI组和二线TKI组。
2 结果
2.1 二线治疗中化疗与TKI的对比
共有30例患者入组,20例患者入化疗组,10例患者入TKI组,TKI组患者平均年龄较大,PS评分较高(表1-1)。对两组DCR进行统计分析,P值为0.019,(表1-2)。对ORR进行对比,P值>0.05(表1-3)。化疗组的中位PFS达5.6个月,TKI组的中位PFS达3.0个月;P值有统计学意义(P=0.004)(图1-1,表1-4)。患者的一般情况(年龄、PS评分、吸烟指数),疾病特点(病理类型、分期、远处转移情况、血清肿瘤标记物,如CEA、SCC、NSE、CY-211)、其他内科合并症(是否合并慢性病、凝血功能是否异常)、治疗方案制定(有无手术、有无联合局部治疗、有无联合血管靶向治疗、治疗方式)均纳入COX模型,结果发现在单因素分析及多因素分析中,治疗方式的选择及有无联用血管靶向药物是影响PFS的独立预后因素,P值0.002和0.001(表1-5,表1-6)。化疗组和TKI组在OS、不良反应方面差异均无统计学意义(P>0.05)(图1-2,表1-7,表1-8)。
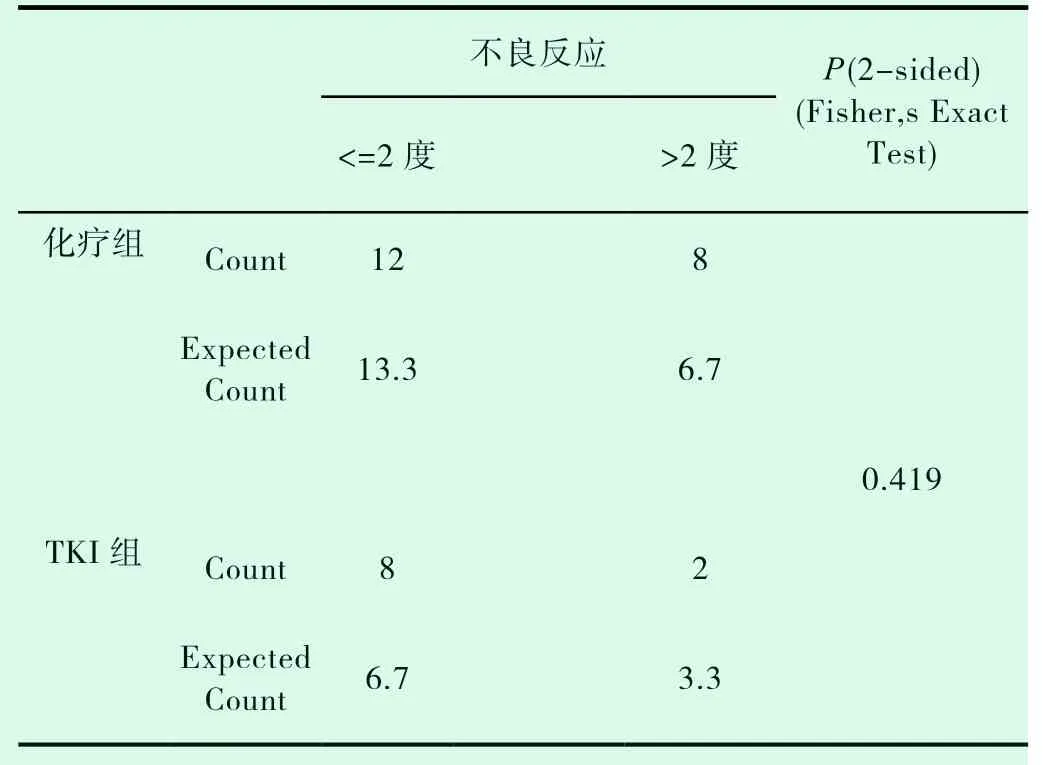
表1-8 TKI组、化疗组不良反应的比较
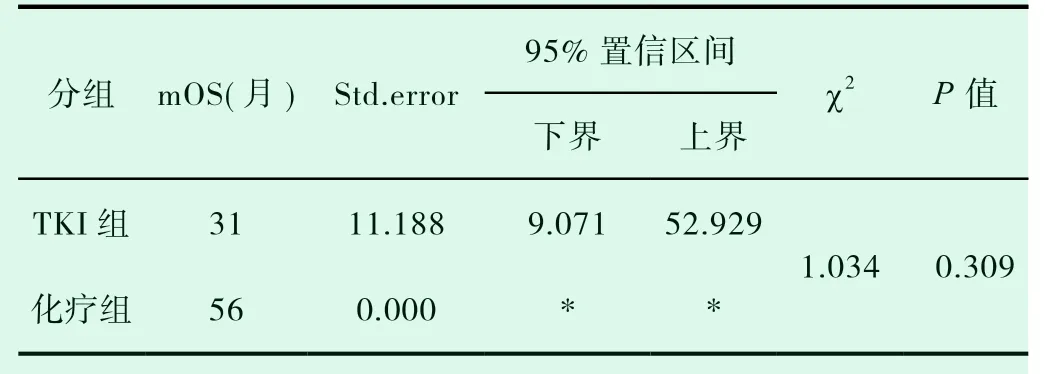
表1-7 TKI组、化疗组总生存期的比较
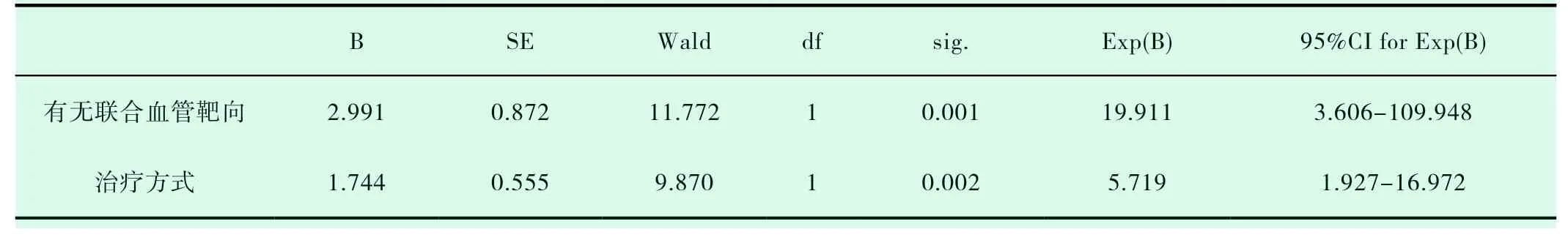
表1-6 影响PFS的COX多因素分析
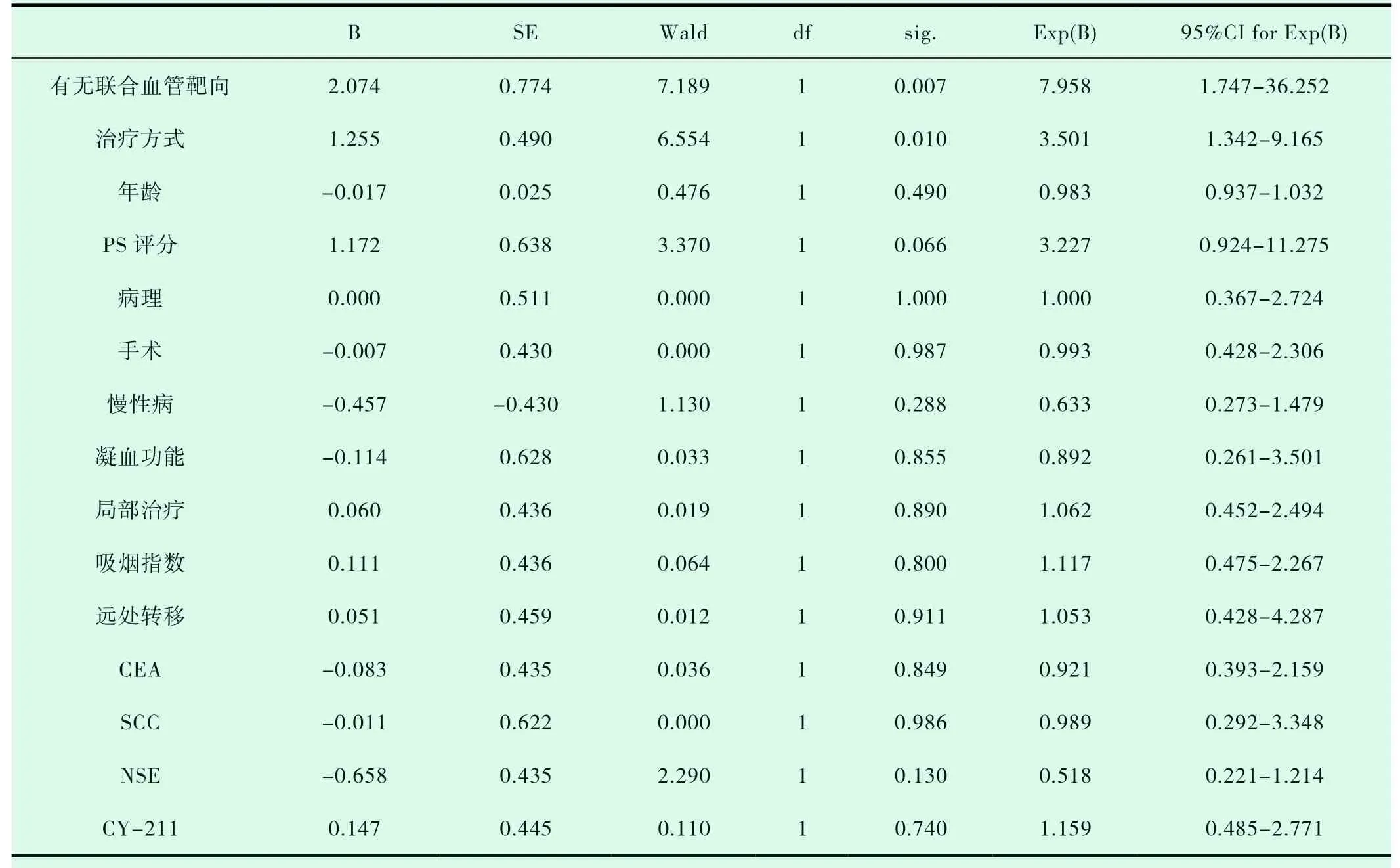
表1-5 影响PFS的COX单因素分析
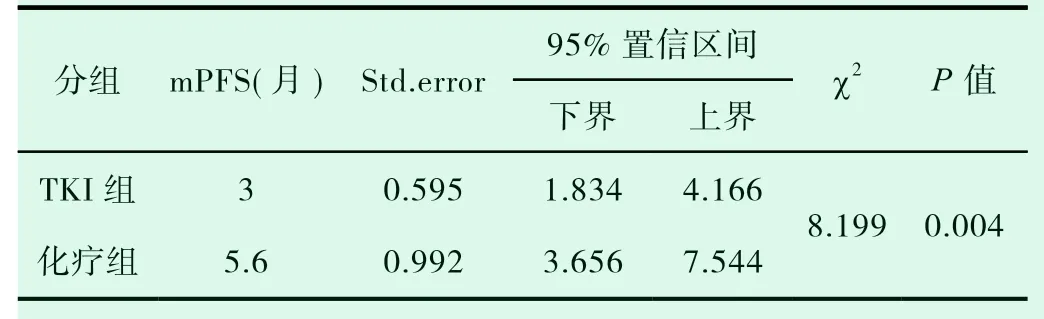
表1-4 TKI组、化疗组无进展生存期的比较
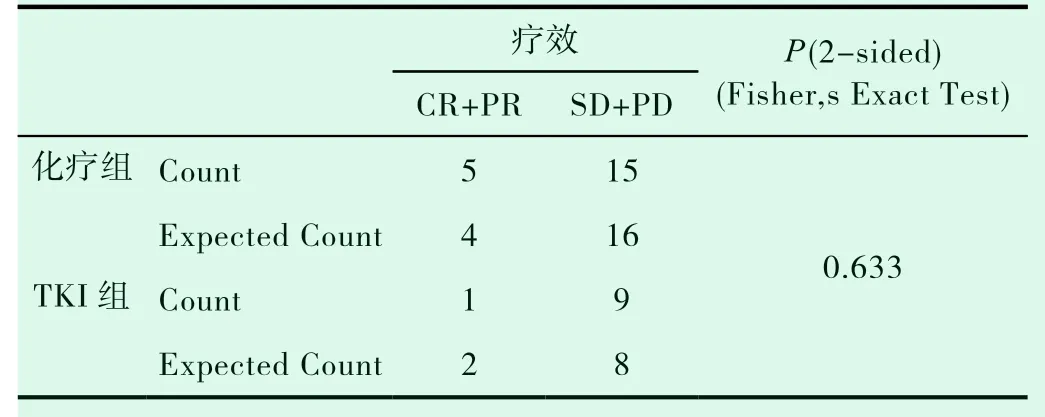
表1-3 两组有效率的比较
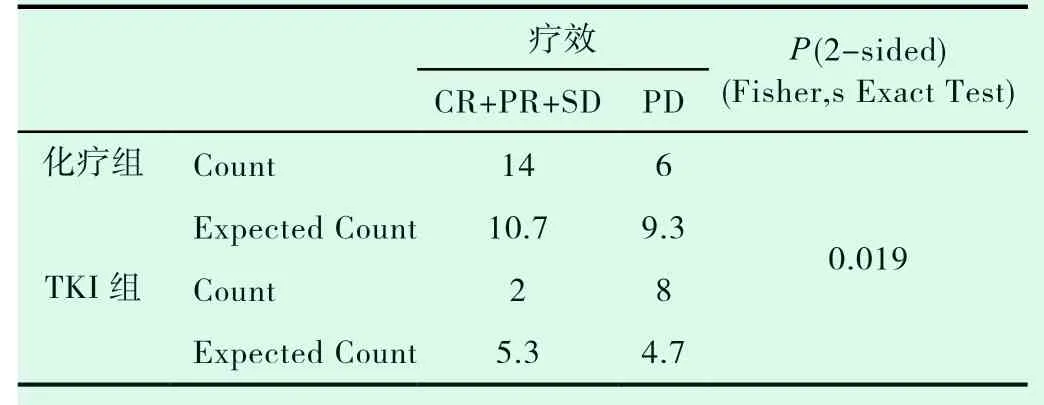
表1-2 两组疾病控制率的比较

表1-1 TKI组、化疗组的临床特征(n,%)
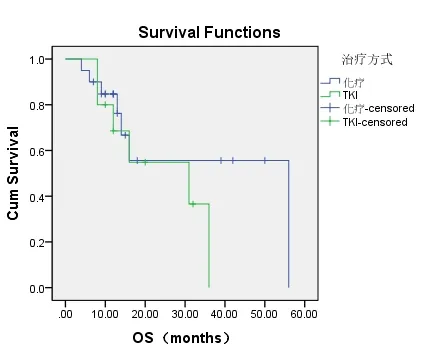
图1-2 TKI组与化疗组对总生存时间的影响
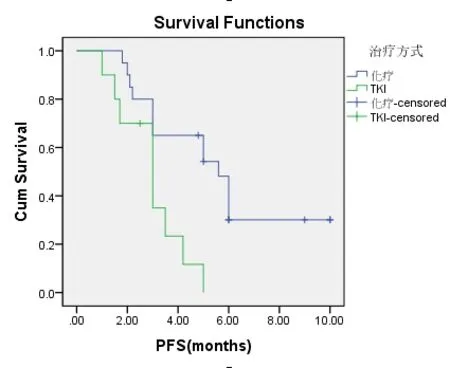
图1-1 TKI组与化疗组对无进展生存时间的影响
2.2 一线TKI组和二线TKI组的对比
一线TKI组入组14例患者,二线TKI组入组10例患者,两组患者的一般特点相近(表2-1)。两组的DCR、ORR进行统计学分析,P值均大于0.05(表2-2,表2-3)。一线TKI治疗的中位PFS是2个月,中位OS为6.0个月;二线TKI治疗的中位PFS是3个月,中位OS达31.0个月,P<0.05(图2-1,表2-4,图2-2,表2-5),差异均有统计学意义。将以上各因素纳入COX模型,结果证明治疗方式的选择是影响PFS的独立预后因素(表2-6,表2-7);凝血功能(P=0.043)、治疗方式(P=0.018)、血清NSE水平(P=0.034)及血清CY-211水平(P=0.049)对OS有影响(表2-8);多因素分析中,治疗方式、血清NSE水平为OS独立预后因素,P值分别为0.017、0.029(表2-9)。两组的不良反应分析差异无统计学意义(P>0.05)(表2-10)。
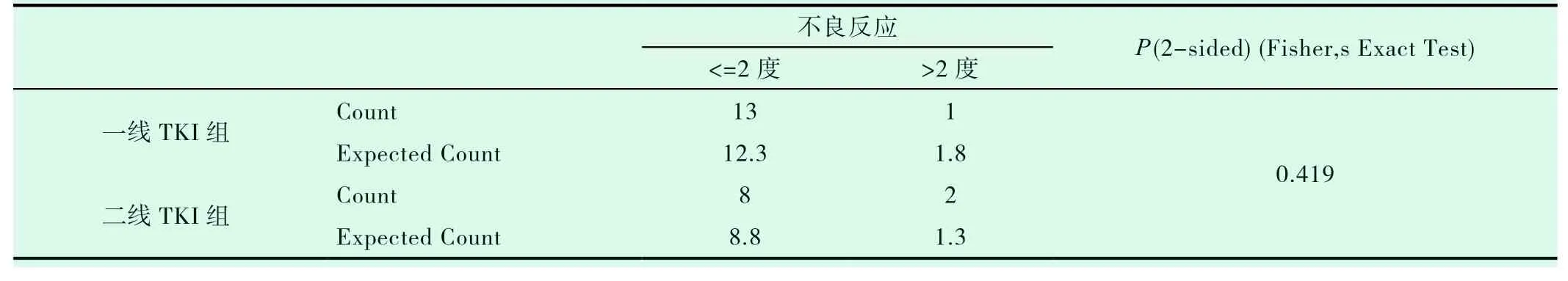
表2-10 一线、二线TKI组不良反应的比较

表2-9 影响OS的COX多因素分析
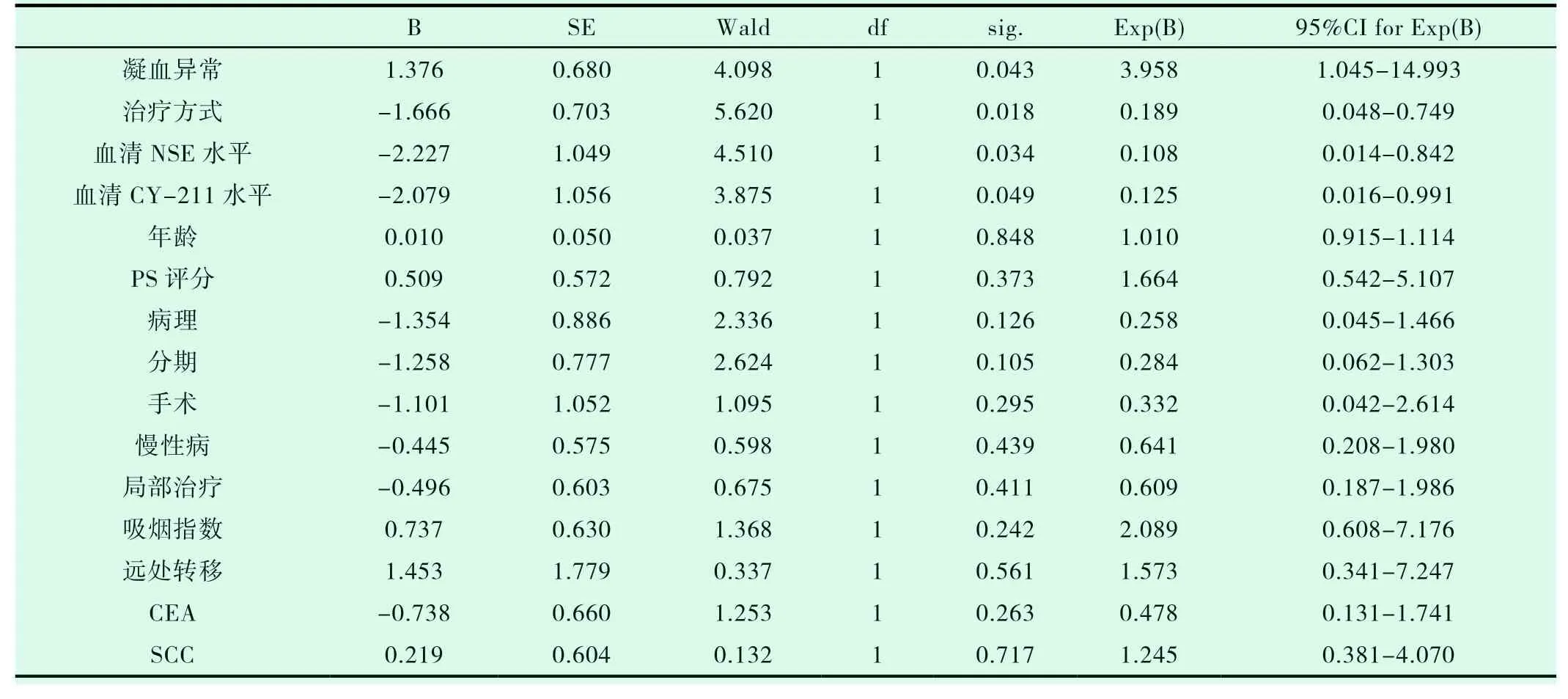
表2-8 影响OS的COX单因素分析

表2-7 影响PFS的COX多因素分析
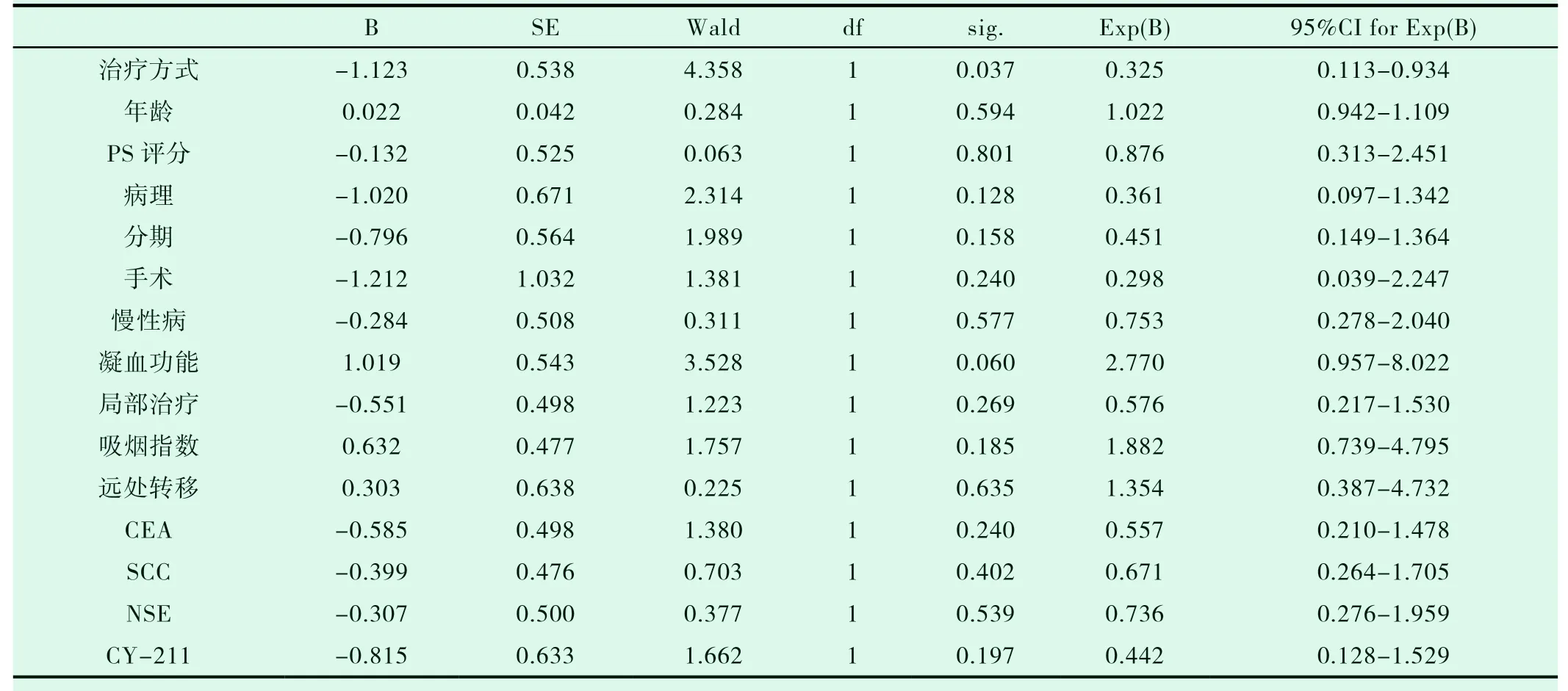
表2-6 影响PFS的COX单因素分析
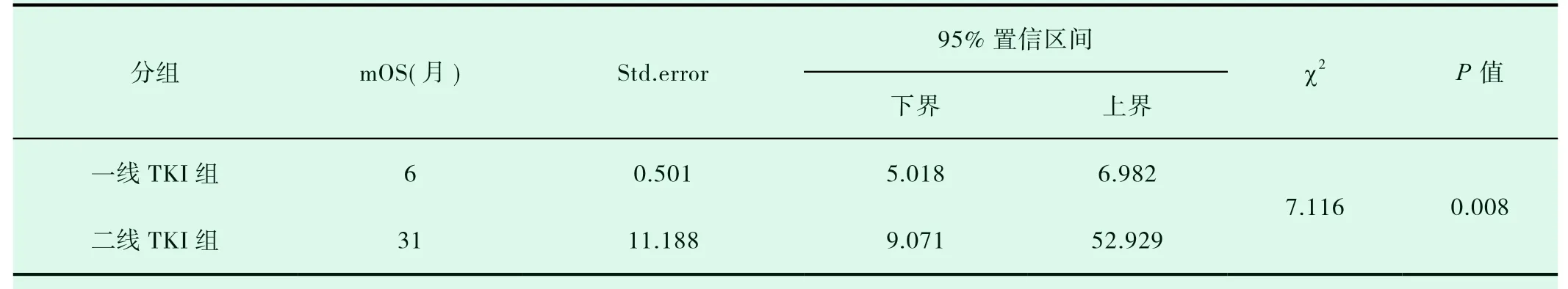
表2-5 一线、二线TKI组总生存期的比较

表2-4 一线、二线TKI组无进展生存期的比较

表2-3 两组有效率的比较
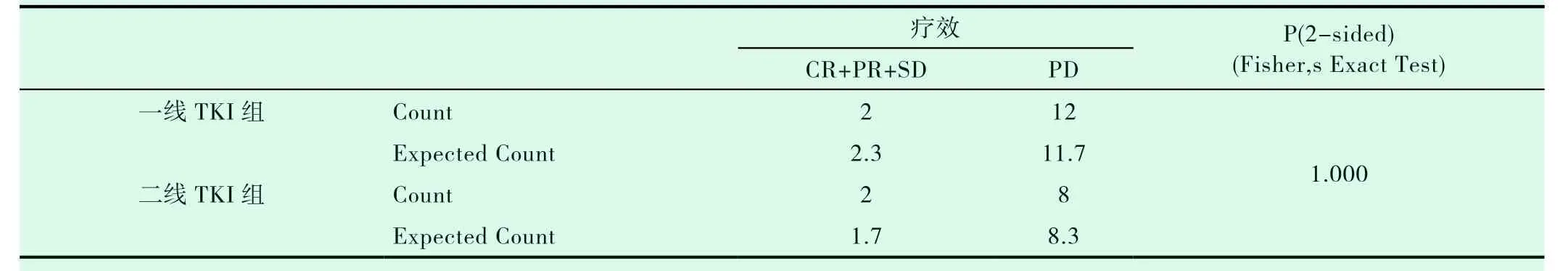
表2-2 两组疾病控制率的比较
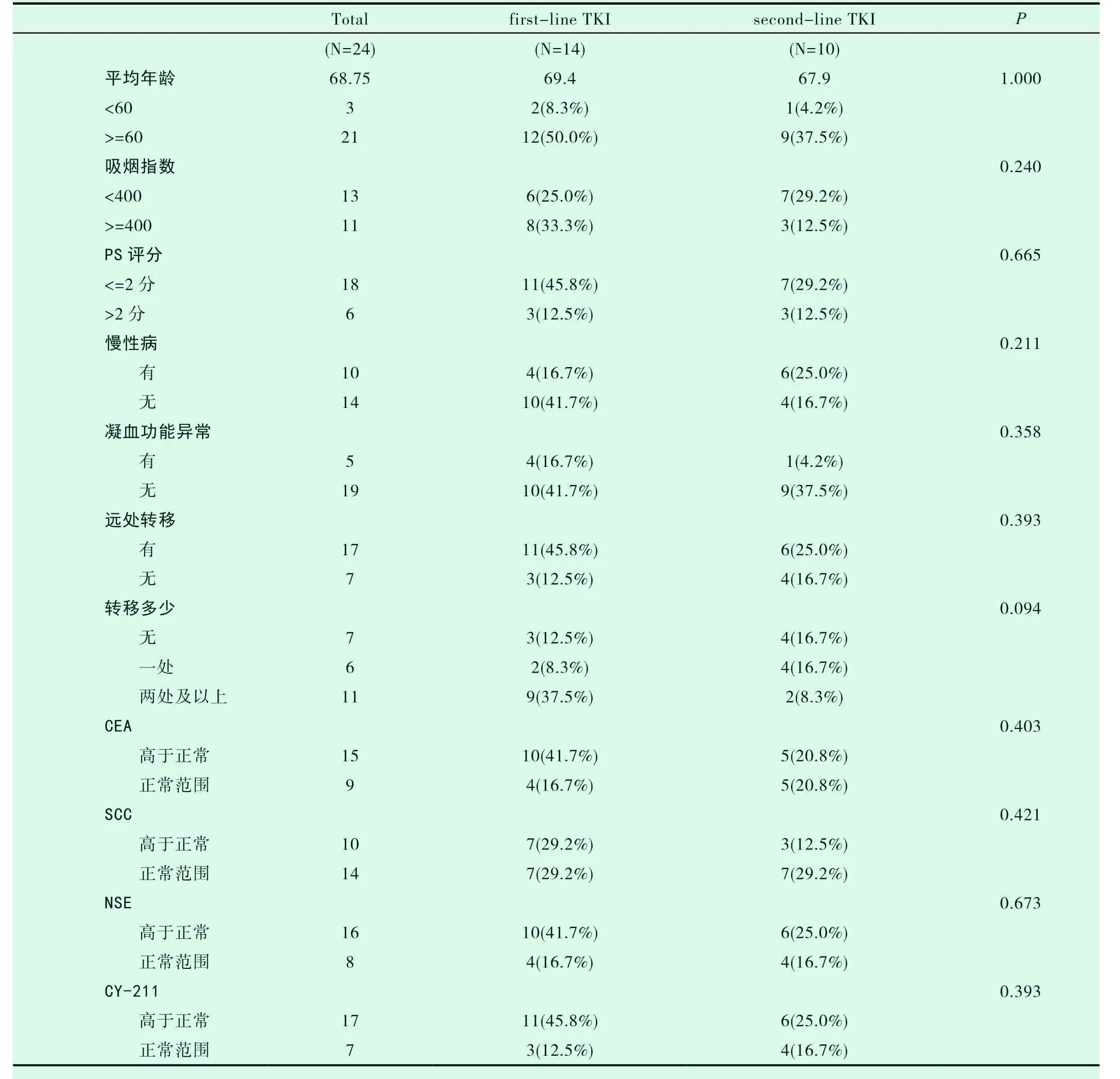
表2-1 一线、二线TKI组的临床特征
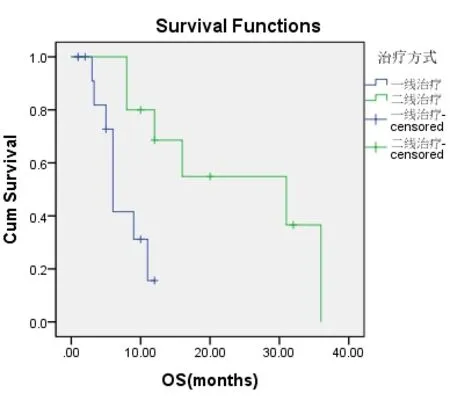
图2-2 一线治疗与二线治疗应用TKI对总生存时间的影响
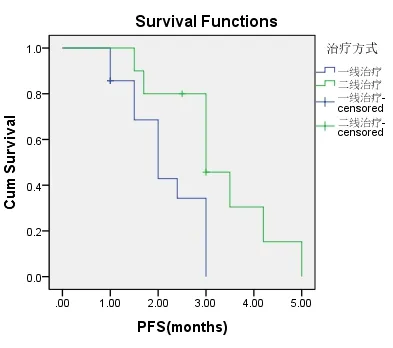
图2-1 一线治疗与二线治疗应用TKI对无进展生存时间的影响
3 讨论
非小细胞肺癌占原发性肺癌的85%左右,治疗方式有手术、放疗、化疗、靶向治疗及免疫治疗,但即使接受手术的患者,大部分在术后五年内会出现局部复发及远处转移,最终导致死亡[1]。针对EGFR突变的NSCLC患者,EGFR-TKIs在各种指南中已被推荐为一线治疗,而占有大比例的EGFR野生型患者治疗方式的选择主要集中于化疗、免疫治疗或二者结合的治疗方案,尤其在二线治疗失败后,患者一般状态往往欠佳,可供选择的药物更是寥寥无几。因此,针对给予野生型患者TKI治疗的临床疗效及目前临床广泛使用的基因检测手段、优劣值得进一步的讨论分析。
3.1 TKIs在EGFR野生型NSCLC患者治疗中的地位
一项mate分析研究结果表明,给予EGFR野生型NSCLC患者TKI治疗,与化疗组相比,在PFS和ORR方面,化疗组具有优势,OS方面,两组差异无统计学意义[2],这和本文得出研究结果基本一致。所以对于EGFR野生型患者,化疗可能会是一个比EGFR-TKI更好的治疗选择,但无论既往研究还是本研究均为非随机化入组,所以这项建议值得商讨。
在二线治疗中,EGFR野生型患者选择厄洛替尼还面临诸多疑问,几项研究[3-5]结果均表明,厄洛替尼对复治的非小细胞肺癌且EGFR为野生型患者可有一定疗效。Jazieh等[6]回顾性分析相关研究(BR.21、TITAN等),得出厄洛替尼可作为EGFR野生型非小细胞肺癌患者的二、三线治疗选择。Osarogiagbon等[7]对150例EGFR野生型NSCLC患者的数据进行分析研究,结果显示厄洛替尼对PFS有影响,可延长PFS;TKI与化疗的对比研究中,TAILOR和DELTA研究[8,9]证实,相比较厄洛替尼,多西他赛可较为明显改善PFS,提高缓解率与疾病控制率,但未转化为生存获益;TAILOR试验中[8],给予化疗的患者,中位OS为8.2个月,中位PFS为2.9月;给予 TKI治疗的患者OS为5.4个月,TKI组2.4月,化疗组更具优势。因此EGFR野生的NSCLC患者二、三线治疗的标准方案仍是化疗,而TKI药物治疗只作为非最优选择方案,对于那些PS评分较差以及不能耐受化疗的患者从中获益的可能性更大。
非小细胞肺癌且EGFR为野生型的患者一线使用TKIs治疗的意义更无研究支持,奠定了EGFR-TKIs临床疗效的 IPASS研究结果显示,EGFR-WT组,化疗组与TKIs组的PFS有统计学意义,化疗疗效显著优于TKI,但对OS无显著影响[10];韩国的First-SIGNAL研究也得到相近结果[11]。另一项TORCH研究,对比一线给予厄洛替尼治疗后出现进展,进展后给予化疗与一线化疗进展后使用厄洛替尼的疗效,EGFR野生组中首次PFS风险比2.07,提示一线使用厄洛替尼,可能疾病会更快发生进展,而化疗组的OS与PFS结果更为理想,两者有显著差异[12]。
3.2 目前EGFR基因检测的现状
肺癌样本的分子检测目前主要应用组织样本、血液样本进行检测,目前驱动基因检测的金标准。常用检测方法包括直接测序法、PCR、突变扩增阻滞系统(ARMAS)法、荧光原位杂交(FISH)及高通量二代测序(NGS)等;本研究中确诊为EGFR野生型的检测方法有突变富集PCR法、ARMAS法及NGS法;标本来源包括:组织、血液ctDNA、胸水ctDN。DNA测序法是进行基因突变检测最直观和最准确的方法之一,也被认为是金标准。PCR法相对比DNA直接测序法,具有灵敏度、特异度均较高,操作相对简单,具有高通量的特点[13,14],但只能发现有限的EGFR基因突变,且成本较高[15]。因临床中部分患者获取组织标本困难,且面临需要多次取材明确病理、并进行基因检测的需求,利用血液、胸水ctDNA进行EGFR基因的ARMS法检测也于2015年获中国国家食品药品监督管理局(CFDA)批准。其检测血浆EGFR敏感型突变的灵敏度在65%-88%,特异度在99%-100%[16,17],对标本肿瘤细胞DNA含量及质量要求较低,可检测灵敏度低至1%的突变[18]。目前,二代测序技术(NGS)已广泛应用于肿瘤诊疗的临床工作中及基础科研中,它具有很好的基因检测深度和广度[19],灵活性好,性价比高,通过测序及数据分析,很好的满足了临床需求。
欧洲一项名为IFUM的研究[17],结论是利用ctDNA标本,进行EGFR突变的特检测,其特异度为99.8%。灵敏度65.7%;这与LIU等[16]的研究结果一致,即与组织样本相比,血浆ctDNA的EGFR突变检测的灵敏度为67.5%,特异度为100%。在IFUM研究、IPASS研究、FASTACT2研究、及国内一项针对230例晚期NSCLC患者的研究中,都证实通过血液标本进行EGFR基因的突变检测,对于指导临床治疗、预测靶向药物疗效等方面都与组织检测结果具有高度一致性[17,20-21]。相比而言,血液ctDNA检测具有无创、便捷、适时可获取的特点,在一定程度上解决了组织样本不足、异质性及反复动态活检的问题。尽管血液及组织样本检测的一致性在60%-95%之间,但金标准仍是组织检测,血液检测可作为组织检测的重要补充[17]。
尽管目前EGFR野生型的NSCLC患者缺乏有效的、毒性低的治疗方式,但随着液体活检的不断成熟,多基因检测的认可,以及免疫治疗所带来的喜人成绩,相信在对野生型患者的优化治疗、全程管理上同样会有新的突破。

