丁酸钠协同成纤维细胞生长因子2 体外诱导骨髓间充质干细胞向心肌细胞分化的研究
赵亚如 刘 洋 吕 洋 王文华 王浩宇 王巧敏 王海萍
河北北方学院组织学与胚胎学教研室,河北张家口 075000
随着饮食结构的改变,缺血性心脏病(ischemic heart disease,IHD)患病率逐渐升高,临床一般采用药物、介入或者搭桥等传统治疗,但这些方法只是缓解症状,心肌细胞(cardiac myocytes,CMs)如果在心肌缺血区域内坏死,会形成纤维性瘢痕组织,从而发展为心力衰竭。通过临床前研究表明,随着骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSC)移植,梗死面积总体减少了约7%,心功能改善了约11%[1]。研究发现,通过加入化合物或者细胞因子、基因修饰、微环境的调节和物理因素刺激等都可以促进BMMSC 向CMs 分化[2-4]。丁酸钠通过抑制组蛋白去乙酰化酶(histone deacetylase,HDAC),使转录激活,从而促使BMMSC 向CMs 分化[5],但低浓度的丁酸钠抑制细胞增殖[6],这限制丁酸钠诱导分化的能力。成纤维细胞生长因子2(fibroblast growth factor 2,FGF-2)可以通过ERK 和JNK 途径协同调节细胞增殖再生[7-8];丁酸钠可以抑制HDAC 促进FGF-2 生成[9-10],因此为了提高其分化的效率,本研究选择FGF-2 与丁酸钠联合诱导BMMSC 向CMs 分化。
1 材料与方法
1.1 实验动物、试剂
SPF 级2~3 周龄SD 大鼠(25±10)g 购自北京斯贝福生物技术有限公司[许可证号:SCXK(京)2016-0002,合格证号:No.1103241911030990],实验过程遵循3R 原则。
流式细胞仪和鼠抗缝隙连接蛋白43(connexin 43,CX43)抗体(货号:610061)购自美国BD 公司;免疫细胞化学染色试剂盒(货号:SP-9000)购自北京中杉金桥生物技术有限公司;心肌肌钙蛋白I(cardiac troponin I,cTnI)抗体(货号:GTX109331)购自美国Gene Tex 公司;兔抗Desmin 抗体(货号:ET1606-30)购自河北华安生物药业有限公司。
1.2 研究方法
1.2.1 BMMSC 的分离和纯化 2~3 周龄SD 大鼠,颈椎脱臼、医用酒精消毒,依次取出四肢长骨,用含有Pen-Strep 的PBS 冲洗骨髓腔,放入细胞培养瓶中,置于恒温培养箱中。培养48 h 后更换培养基,以后每隔72 h换1 次培养基,当贴壁细胞融合至90%左右进行传代。
1.2.2 BMMSC 的鉴定 第3 代BMMSC 做流式,消化、吹打为细胞悬液,均匀分装到3 个离心管中,第1 个加适 量CD29-PE 抗 体、CD45-FITC 抗 体、CD90-PECyTM7 抗体,第2 个加入适量PE 抗体、FITC 抗体、PECyTM7 抗体,第3 个加入适量PBS,4℃避光孵育30 min,上机检测。
1.2.3 BMMSC 体外诱导分化 取第3 代细胞进行诱导培养,分为4 组,对照组:加入普通完全培养基,丁酸钠组:加入浓度为1 mmol/L 丁酸钠培养基,FGF-2组:加入1 ng/ml FGF-2 的培养基,联合组:加入含有浓度为1 mmol/L 丁酸钠和1 ng/ml FGF-2 的培养基。培养72 h 后,全部换成普通完全培养基,继续培养4 周。
1.2.4 定量反转录PCR(quantitative reverse transcriptase-mediated PCR,qRT-PCR)对心肌特异性基因的检测 分别提取经药物诱导后1、2和4 周总RNA,反转录为cDNA,以GAPDH 为内参,对目的基因GATA-4 进行扩增,GAPDH 正向引物20 bp:5’-ACTCTACCCACGGCAAGTTC-3’,反向引物20 bp:5’-TGGGTTTCCCGTTGATGACC-3’;GATA-4 正向引物20 bp:5’-TTTTATCCGCGAGCCTACGG-3’,反向引物20 bp:5’-AGGTACCGCTGTTGCTTGAA-3’,2-△△Ct相对定量分析数据,观察目的基因的表达。
1.2.5 Western blot 检测心肌特异性蛋白的表达诱导4 周后的细胞,消化、离心收集细胞,加入裂解液,在4℃冰箱50 min,测蛋白浓度;在蛋白样品中添加适量的蛋白上样缓冲液;把蛋白样品加到各个上样孔内,进行电泳、转膜、封闭,一抗(1∶1000)孵育膜,4℃、摇床过夜,二抗(1∶10 000)室温孵育膜,ECL 化学发光、成像仪成像、最后图像分析。
1.2.6 免疫组织化学测心肌特异性蛋白的表达 取诱导4 周后的细胞,消化、计数细胞,然后爬片,多聚甲醛固定,用0.5% TritonX-100 室温透膜20 min;内源性过氧化物酶阻断剂室温15 min;滴加山羊血清,37℃温箱15 min;滴加一抗(1∶100)4℃过夜;复温30 min 后加生物素标记的羊抗兔IgG,室温20 min;滴链酶卵白素-过氧化物酶,37℃15 min;滴加DAB,室温显色2 min;染核、分化、反蓝、脱水、透明、树脂封片,采集图片。
1.3 统计学方法
采用SPSS 26.0 统计学软件进行资料分析,计量资料采用均数±标准差()表示,组间比较采用t 检验,多组间比较采用重复测量方差分析和单因素方差分析,两组间比较采用LSD-t 检验,以P <0.05 为差异有统计学意义。
2 结果
2.1 形态学观察结果
原代细胞接种至培养瓶中呈悬浮状态,培养48 h后,首次换液细胞贴壁数量明显增加并且开始出现形态改变见图1A(封三);培养1 周的BMMSC 细胞进一步伸展,出现梭形、多角形和不规则形等多种形态见图1B(封三);诱导培养4 周后的BMMSC,相邻细胞间具有明显的方向性排列,一些细胞甚至成了漩涡样结构见图1C(封三);联合组诱导4 周后,相邻细胞间排列的方向性,漩涡样结构与其他诱导组相比较更加明显见图1D(封三)。

图1 BMMSC 的培养与诱导
2.2 表面抗原鉴定结果
用流式细胞仪测第3 周BMMSC 的表面抗原。最后测得表面抗原CD29、CD45、CD90 的阳性表达率分别为93.3%、1.4%、95.1%。结果显示全骨髓贴壁法分离培养的细胞为纯化的BMMSC。见图2。

图2 BMMSC 流式细胞术的鉴定
2.3 qRT-PCR 结果
整体分析:各组GATA-4 基因的表达、时间点及分组和时间交互作用比较,差异有统计学意义(P <0.05)。组内比较:经药物诱导后的三组细胞诱导2 周GATA-4 基因的表达均高于诱导1、4 周,差异有统计学意义(P <0.05);诱导4 周基因的表达高于诱导1 周,差异有统计学意义(P <0.05)。组间比较:经药物诱导后联合组诱导2 周GATA-4 基因的表达高于其他各组,差异有统计学意义(P <0.05);联合组诱导1、4 周GATA-4 基因的表达与其他各组比较,差异无统计学意义(P >0.05)。见表1。
表1 四组GATA-4 mRNA 表达水平比较(,n=3)
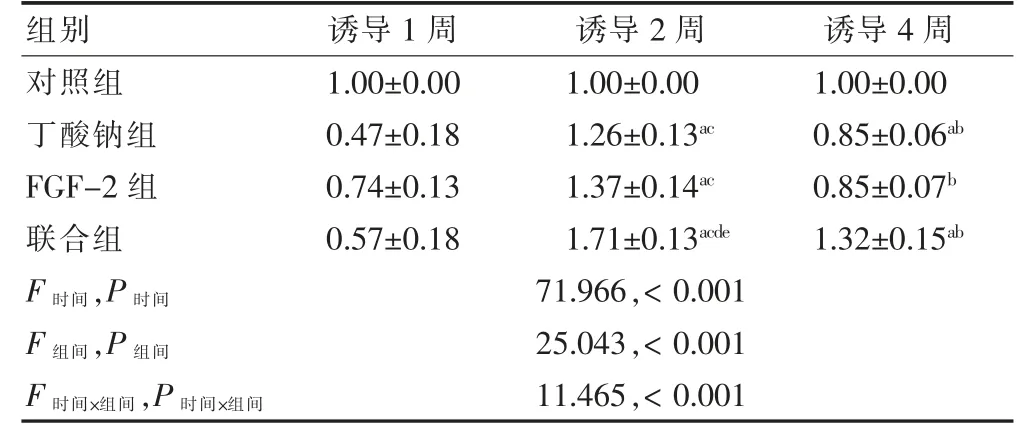
表1 四组GATA-4 mRNA 表达水平比较(,n=3)
注:与同组诱导1 周比较,aP <0.05;与同组诱导2 周比较,bP <0.05;与同期对照组比较,cP <0.05;与同期丁酸钠组比较,dP <0.05;与同期FGF-2 组比较,eP <0.05。FGF-2:成纤维细胞生长因子2
2.4 Western blot 检测结果
联合组CX43、结蛋白(Desmin)和cTnI 蛋白的表达量均高于其他各组,差异有统计学意义(P <0.05)。丁酸钠组和FGF-2 组CX43、Desmin 和cTnI 蛋白的表达量均高于对照组,差异有统计学意义(P <0.05);FGF-2 组cTnI 蛋白的表达量高于丁酸钠组,差异有统计学意义(P <0.05),两组CX43、Desmin 蛋白的表达量比较,差异无统计学意义(P >0.05)。见图3,表2。
表2 四组心肌特异性肌蛋白的表达水平比较(,n=3)
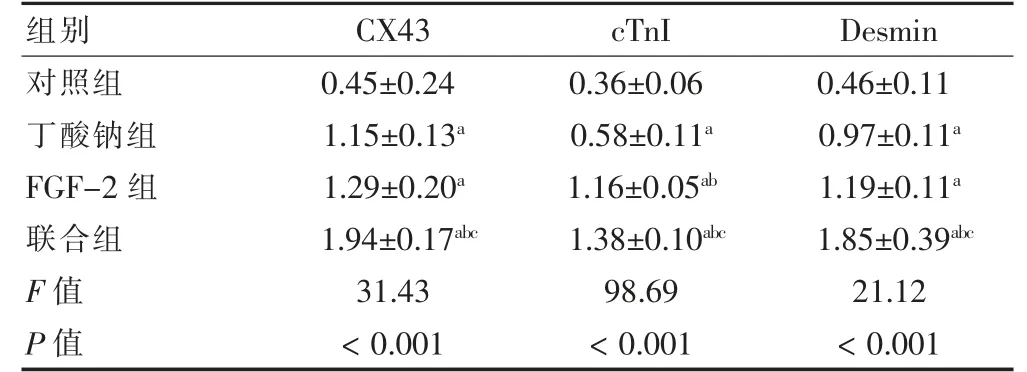
表2 四组心肌特异性肌蛋白的表达水平比较(,n=3)
注:与对照组比较,aP <0.05;与丁酸钠组比较,bP <0.05;与FGF-2组比较,cP <0.05。CX43:缝隙连接蛋白43;Desmin:结蛋白;cTnI:心肌肌钙蛋白I;FGF-2:成纤维细胞生长因2 子
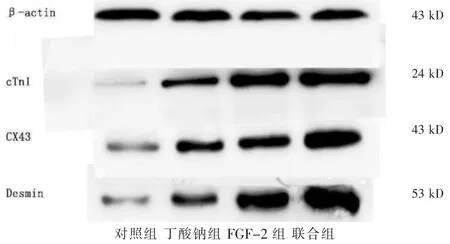
图3 Western blot 结果
2.5 免疫组化检测结果
BMMSC 诱导4 周后,联合组心肌肌钙蛋白T(cardiac troponin T,cTnT)和cTnI 蛋白的表达量高于其他各组,差异有统计学意义(P <0.05);FGF-2 组cTnT 和cTnI 蛋白的表达量高于对照组,差异有统计学意义(P <0.05),FGF-2 组的cTnT 高于丁酸钠组,差异有统计学意义(P <0.05);丁酸钠组cTnT 和cTnI 蛋白的表达量高于对照组,差异有统计学意义(P <0.05)。见表3。
表3 四组CTnT、CTnI 的阳性率比较(%,,n=3)

表3 四组CTnT、CTnI 的阳性率比较(%,,n=3)
注:与对照组比较,aP <0.05;与丁酸钠组比较,bP <0.05;与FGF-2组比较,cP <0.05。cTnT:心肌肌钙蛋白T;cTnI:心肌肌钙蛋白I;FGF-2:成纤维细胞生长因子2
3 讨论
近年来,将外源性干细胞移植入受损的心脏中,得到了广泛研究和认可[11-12]。干细胞分为胚胎干细胞和成体干细胞。因间充质干细胞较胚胎干细胞具有低的免疫原性、获取相对容易、没有道德问题等特性,使它被广泛研究用于心肌再生[13-14]。
丁酸钠具有显著的诱导分化的特点,它可以通过Wnt 通路诱导干细胞向神经分化[15];通过激活ERK 调控Runx2 基因的表达刺激干细胞分化成骨细胞[16]等。因GATA-4 和MEF-2c 为心肌特异性转录因子[17],丁酸钠通过促进GATA-4 和MEF-2c 心脏特异性转录因子组蛋白乙酰化,使其与目标DNA 结合,从而促进干细胞向CMs 的分化[18-19]。FGF-2 是刺激干细胞迁移、增殖和分化的强力有丝分裂原,FGF-2 不仅能促进干细胞分化为心肌细胞,还可以重编程成纤维细胞为心肌样细胞[20]。本研究运用二者联合和单独诱导BMMSC 细胞3 d,比较他们之间的分化效率。
cTn 是心肌收缩的调节蛋白,由3 种亚基组成:cTnT、cTnI 和TnC,cTnI 和cTnT 是特定于心肌,用于心脏病实验室诊断[21-22]。CX43 主要存在于心脏内,位于CMs 间隙连接处,以促进动作电位的传播[23]。Desmin是中间丝的主要蛋白质成分,在心脏中表达丰富[24]。BMMSC 经药物诱导4 周后,从蛋白水平和基因的表达水平表明,联合组明显高于其他组,这个结果可能是因为丁酸钠的受体和FGF-2 的受体可以一起形成异源复合物,并触发细胞内信号PI3K 和ERK 通路的表达[25]。
以上研究结果显示,丁酸钠和FGF-2 诱导BMMSC向心肌样细胞分化,联合比单独诱导效果好,为临床优化治疗IHD 的细胞疗法提供理论支持。

