AR-V7对前列腺癌细胞增长及Akt/mTOR信号通路的影响
艾孜麦提·阿不都热合曼, 马东升, 安恒庆,2
(新疆医科大学1第一附属医院泌尿外科, 2公共卫生与预防医学博士后流动站,乌鲁木齐 830011)
前列腺癌(prostate cancer,PCA)是男性泌尿生殖系统中最常见的恶性肿瘤,按世界卫生组织(world health organization,WHO)2018年全球癌症统计,在世界范围内,其发病率在男性所有恶性肿瘤中位居第二位,仅次于肺癌[1]。我国PCA 的发病率和死亡率近年来呈现明显上升趋势[2]。雄激素受体(androgen re‑ceptor, AR)在PCA 的发生、发展及转移中起重要作用,前列腺中主要的雄激素是双氢睾酮,与胞质内AR结合后,促进类固醇-受体复合物进入核内,激活雄激素反应元件(androgen response elements,ARE),调控靶基因的转录表达。正常情况下AR 信号通路促进前列腺上皮细胞的分化,而异常的信号通路则会调节细胞周期、存活、增殖, 从而使得肿瘤恶化[3]。雄激素剥夺治疗(androgen deprivation therapy,ADT)是PCA 患者中首先的治疗方案,但经过中位时间18~24个月的内分泌治疗后,几乎所有患者都进展为去势抵抗型PCA(castration resistant prostate cancer,CRPC)[4]。CRPC 其调控机制和作用机制尚未完全阐明,不过已有研究结果提示AR 信号持续激活是CRPC 发生发展的重要原因,其中AR-V7是AR信号通路在低雄激素水平的环境中能被激活的原因之一[5-6]。磷脂酰肌醇3 激酶/丝氨酸苏氨酸激酶/雷帕霉素激酶(PI3k/AKT/mTOR)信号通路对疾病发病有着重要作用,PCA 细胞中发现PI3k/AKT 信号通路经常被异常激活,并已被证明在CRPC 进展中发挥重要作用[7-9]。AR 和Akt/mTOR 通路的相互反馈激活已被证实,癌细胞在其中一个途径被药物抑制时适应另一个途径生存[10-11]。本研究将pIRES2-EGFP-AR-V7 接种于PC-3 细胞,验证AR-V7 的表达情况,随后检测Akt、mTOR、p-AKT、p-mTOR 的蛋白和基因水平,探讨AR-V7 与Akt/mTOR 通路之间的相互作用,为CRPC的机制研究提供新的思路。
1 材料与方法
1.1 细胞株和主要试剂PC-3 细胞来源于丰辉生物,胎牛血清(FBS)(Excell Bio 公司),Lipofectamine 3000® Transfection Reagent(Invitrogen 公司),pIRES2-EGFP 空载质粒(新疆昆泰锐生物公司),SmaI 内切酶、PmlI 内切酶(NEB 公司),T4 DNA Ligase(takara 公司),Trans1-T1 Phage Resistant Chemically Competent Cell、pEASY®-T1Cloning Kit、CCK-8 细胞增殖/毒性检测试剂盒(全式金生物公司),AnnexinVPE/7AAD Kit(BD公 司), TRIzol ™Reagen(ambion 公 司), Akt(pan)(C67E)RabbitmAb, Phospho-Akt(Ser473)Antibody, mTOR(7C10)RabbitmA(CST 公司),Real Time PCR instrument(ABI公司)。
1.2 细胞培养PC-3 细胞用含1% 青-链霉素、10%胎牛血清的F-12K 培养基、在含5% 的CO2和饱和湿度37℃的培养箱中培养,将处在生长状态下的细胞进行传代。
1.3 pIRES2-EGFP-AR-V7 重组质粒构建和细胞转染使用全基因化学合成的方法合成AR-V7 CDS区序列,连接到pIRES2-EGFP 表达质粒载体上,取处于对数生长期的PC-3 细胞,按Lipofectamine3000 转染试剂说明书分别将pIRES2-EGFP 空载质粒及pIRES2-EGFP-AR-V7 重组载体传染PC-3 细胞,并且为后续实验确定最佳转染条件。
1.4 实验分组AR-V7 重组载体组(pIRES2-EGFPAR-V7 过表达载体质粒传染PC-3 细胞,转染试剂浓度0.75 µL/mL,转染时间48 h),空载对照组(pIRES2-EGFP 空载质粒传染PC-3 细胞,转染试剂浓度0.75µL/mL,转染时间48 h),空白对照组(正常培养48 h)。
1.5 CCK8 检测细胞增殖取生长状态良好汇合率达90% 的PC-3 细胞,按照1.4 实验分组进行转染,每组5重复。干预完成后,弃去培养基,每孔加入10 µL配置好的10% CCK-8 溶液,继续在培养箱中孵育,2 h后用酶标仪测定450 nm处的OD值。
1.6 流式细胞仪检测细胞凋亡 取生长状态良好汇合率达90% 的PC-3 细胞,按1.4 实验分组干预细胞,将每组细胞瓶内的培养液吸出至离心管内(内含已经悬浮的发生凋亡或坏死的细胞),PBS 洗涤贴壁细胞2 次,将PBS 一并收集至离心管内,胰酶消化细胞,将细胞转移到离心管内,1000 r/min 离心5 min,弃上清。用预冷的PBS 洗涤2 遍,弃上清。加入500 µL 1×Binding Buffer 重悬细胞,过200 目筛网,制成单细胞悬液。每管加入5 µL Annexin V-PE 和10 µL 7-AAD,轻轻混匀,4℃避光放置5 min。在30 min 内进行流式细胞仪检测。
1.7 实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)检测AKT、mTOR 基因表达按1.4实验分组干预完成后,弃去每组细胞瓶中的培养基,加入1 mL Trizol 消化细胞,使Trizol 平铺在细胞层面上,反复摇晃细胞培养瓶,装入1.5 mL EP管中。后续实验按照qRT-PCR实验报告操作。
1.8 蛋白免疫印迹法(western blot,WB)检测AKT、p-AKT、mTOR、p-mTOR 蛋白表达按1.4 实验分组干预完成后,弃去每组细胞瓶中的培养基,加入3 mL 无菌的PBS 缓冲液反 复 冲 洗2 遍,弃去PBS 缓冲液,用胰酶消化细胞。离心后弃去上清留细胞沉淀,用5 mL 无菌PBS 洗1 遍后收集细胞。后续实验按照WB实验报告操作。
1.9 统计学分析用SPSS 24.0软件进行分析。符合正态性、方差齐的计量资料采用均数±标准差做统计描述,多组比较采用单因素方法分析,两两比较用SNK-q检验,计数资料用百分比形式进行统计描述,两组比较采用χ2检验。检验水准α=0.05。
2 结果
2.1 验证3组AR-V7基因及蛋白表达水平AR-V7基因过表达后AR-V7 mRNA 在AR-V7 重组载体组中的表达水平(11.740±1.968)明显高于空白对照组(1.003±0.090)、空载对照组(1.121±0.125),差异均有统计学意义(P<0.05),AR-V7 的蛋白表达水平在AR-V7重组载体组中的表达水平(0.722±0.043)明显高于空白对照组(0.283±0.161)、空载对照组(0.219±0.084),差异均有统计学意义(P<0.05),见图1、2。

图1 3组AR-V7 mRNA表达量图

图2 3组WB实验条带图及柱状图
2.2 3组细胞增殖活性比较PC-3细胞在AR-V7重组载体组中的增殖活性(OD=0.967±0.037)明显高于 空 白 对 照 组(OD=0.981±0.049)、空 载 对 照 组(OD=0.967±0.037),差 异 均 有 统 计 学 意 义(P<0.05),见图3。
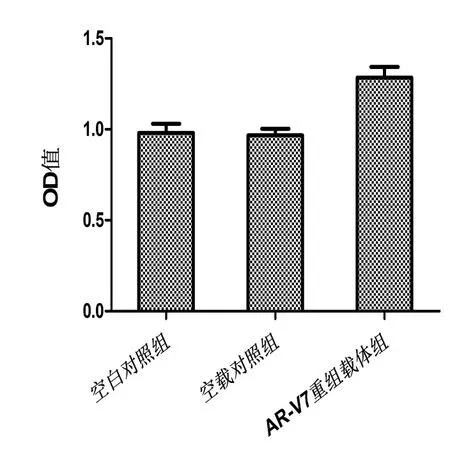
图3 3组细胞增殖柱状图
2.3 3 组细胞凋亡率比较空白对照组、空载对照组、AR-V7 重组载体组细胞凋亡率分别为(6.103±0.870)%、(6.320±0.949)%、(5.000±0.881)%,各组间差异均无统计学意义(P>0.05),见图4。

图4 3组细胞凋亡流式图
2.4 Akt、mTOR 基因表达水平Akt 基因表达水平在各组间差异无统计学意义(P>0.05),mTOR 基因表达水平在各组间差异无统计学意义(P>0.05),见表1、图5。

图5 各组AKT和mTOR基因表达柱状图
表1 PC-3细胞中各基因表达水平分析(±s)

表1 PC-3细胞中各基因表达水平分析(±s)
分组空白对照组空载对照组AR-V7重组载体组AKT 1.019±0.231 0.987±0.127 1.333±0.211 mTOR 1.017±0.219 1.064±0.108 1.389±0.507
2.5 Akt、p-Akt、mTOR、p-mTOR 蛋白表达水平p-Akt 和p-mTOR 蛋白在AR-V7 重组载体组中的表达水平明显低于两个对照组(P<0.05)。各组Akt及mTOR蛋白表达水平无显著差异(P>0.05),见表2、图6。
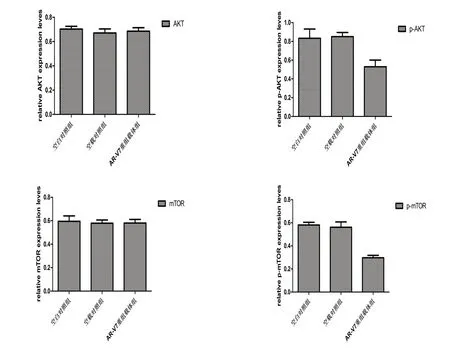
图6 PC-3细胞中各蛋白表达水平的柱状图
表2 PC-3细胞中各蛋白的表达水平分析(±s)
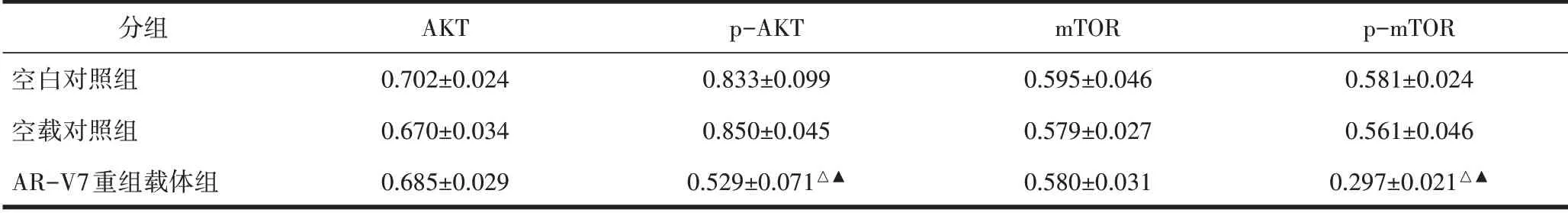
表2 PC-3细胞中各蛋白的表达水平分析(±s)
注:与空白对照组相比,△P<0.05;与空载对照组相比,▲P<0.05。
分组空白对照组空载对照组AR-V7重组载体组AKT 0.702±0.024 0.670±0.034 0.685±0.029 p-AKT 0.833±0.099 0.850±0.045 0.529±0.071△▲mTOR 0.595±0.046 0.579±0.027 0.580±0.031 p-mTOR 0.581±0.024 0.561±0.046 0.297±0.021△▲
3 讨论
PCA 初诊时多数已属中晚期。内分泌治疗是中晚期PCA 患者的基础治疗,但最后绝大部分患者仍然无法避免药物抵抗的事实,从而进入CRPC 阶段,常规的内分泌治疗往往对这些患者病情的改善并无太大的作用[12]。CRPC 的机制目前尚不明确,相关分子网络较为复杂,多条信号通路协同参与,同时随疾病的进展而变化,已有研究表明,在CRPC 阶段中AR信号持续激活促进PCa 细胞的存活,其中AR 通路被激活的原因包括AR 基因的突变、扩增、剪接突变体产生、蛋白分子伴侣改变以及AR 与其他相互通路的串扰等[13-14]。
本研究结果显示:AR-V7 重组载体细胞的增殖活性显著升高,提示AR-V7 可以促进PCa 细胞的增殖。与文献[15]结论一致。Bryce 等[16]发现了PCA 通过激素治疗后AR-V7 的阳性率和表达强度明显升高,其中阿比特龙治疗后约55% 的患者可检测到AR-V7,苯那鲁胺治疗后AR-V7 的表达可从15% 增加到50%。研究者对AR-V7 进行qRT-PCR 检测发现,与普通PCA 相比,CRPC 的AR-V7 表达水平明显升高[17]。有研究将PCA 根治术后患者根据AR-V7 表达水平教中位数水平的高低进行了分组,随访数据显示,与AR-V7水平高于中位数的患者相比,AR-V7水平低于中位数患者的无进展生存率明显更高[18]。提示,在阻断雄激素的状况下,AR-V7 可独立激活下游通路,能使AR 信号通路处于激活状态,促使肿瘤生长,最终导致患者进入去势抵抗状态,使疾病进一步进展,预后更差。
本研究结果表明:pIRES2-EGFP-AR-V7 重组载体组p-Akt、p-mTOR 蛋白表达水平显著降低,但是AKT 和mTOR 的基因表达在各组细胞中没有显著差异,说明AR-V7 抑制了AKT 和mTOR 的被磷酸化。AKT 是PI3K 的重要下游靶激酶,AKT 被磷酸肌醇依赖性蛋白激酶-1(phosphoinositide dependent protein kinase-1,PDK1)磷酸化而活化形成p-Akt,后者可以介导下游信号传导,mTOR 是一种丝氨酸/苏氨酸激酶,是PI3K/Akt 信号通靶点,p-mTOR 由Akt 磷酸化mTOR 形成的,可以促进细胞代谢、生长增殖及存活等生理活动[19-20]。值得注意的是,在许多实验中确认了PI3K 与AR 通路的串扰是CRPC 发生的另外一种机制[21]。本研究结果显示:AR-V7 抑制了AKT 和mTOR 的磷酸化,说明AR-V7 与PI3K/AKT 之间存在一定的相互作用,但是AR-V7 是具体怎么调节PI3K/AKT信号通路的磷酸化,这需要今后进一步研究。
综上所述,AR-V7 基因对PCA 细胞的生长有促进作用,同时AR-V7抑制了p-Akt及p-mTOR蛋白表达,为CRPC的靶向治疗指出了新的方向。

