靶向CD47抗肿瘤治疗的研究进展
柳菁菁 ,唐辰晨,李慧,程颖
近年来,以程序性死亡受体1(programmed cell death protein 1,PD-1)/程序性死亡受体-配体1(programmed cell death-ligand 1,PD-L1)、细胞毒性T淋巴细胞相关抗原4(cytotoxic lymphocyte antigen 4,CTLA-4)为代表的免疫检查点抑制剂在恶性肿瘤的治疗中取得了显著的疗效,并相继获批上市,成为恶性黑素瘤、非小细胞肺癌、小细胞肺癌(small cell lung cancer,SCLC)、胃肠系统肿瘤、肾癌和尿路上皮癌等实体肿瘤的标准治疗方案,开创了抗肿瘤治疗的新时代,实现了肿瘤患者的长期生存[1]。虽然免疫治疗取得了突破性进展,但其有效率仅在30%左右,发现新的免疫靶点、研发新型药物已成为目前的研究热点。
一般情况下,正常组织和细胞可通过表达抗吞噬作用分子来避免被吞噬细胞吞噬的能力,对癌细胞而言则可依赖于类似的机制来逃避免疫消除[2-4]。因此,识别和靶向吞噬作用的检查点被认为有可能是消除肿瘤免疫逃逸的新途径[5]。CD47是一种广泛表达于多种细胞膜表面的免疫球蛋白样蛋白质,在多种肿瘤细胞高表达,能够与巨噬细胞表面的信号调节蛋白α(signal regulatory protein α,SIRPα)结合,向巨噬细胞发出“别吃我”信号,使得肿瘤细胞逃避免疫监视[6-9]。此外,CD47还与肿瘤细胞凋亡和增殖等细胞学过程密切相关。目前,阻断CD47/SIRPα信号从而恢复巨噬细胞对肿瘤细胞的吞噬作用成为抗肿瘤新药研发的热点方向之一。本文将就CD47的结构和功能、靶向CD47新药的研究现状和进展等进行系统阐述。
1 CD47的发现和鉴定
CD47是一种相对分子质量为44~55 kDa的细胞表面糖蛋白,属于免疫球蛋白超家族(IgSF)[10],其由5个跨膜结构域、1个细胞外N末端IgV结构域和一个细胞质内C末端交替剪接结构域组成,根据其在细胞内尾部4种可变不同剪接异构体分为4个亚型。亚型1在角质形成细胞中表达,亚型2主要在造血细胞、血管内皮细胞和上皮细胞中表达,亚型3和亚型4在神经元细胞、肠黏膜细胞和睾丸细胞中均有表达。20世纪80年代,CD47首次被鉴定为人卵巢癌的肿瘤抗原(图1),因为其与整合素αvβ3结合,因此被称为整合素相关蛋白(integrin associated protein,IAP)[11]。1994年,LINDBERG等[12]在缺乏整合素的红细胞表面上发现了CD47,证明CD47可独立于整合素而介导细胞信号转导,因此以CD47命名逐渐代替了IAP。多项研究证实,CD47几乎在所有正常人类细胞中都有表达,并且在多种肿瘤细胞表面高表达,其表达水平和肿瘤的预后呈负相关[5,13]。
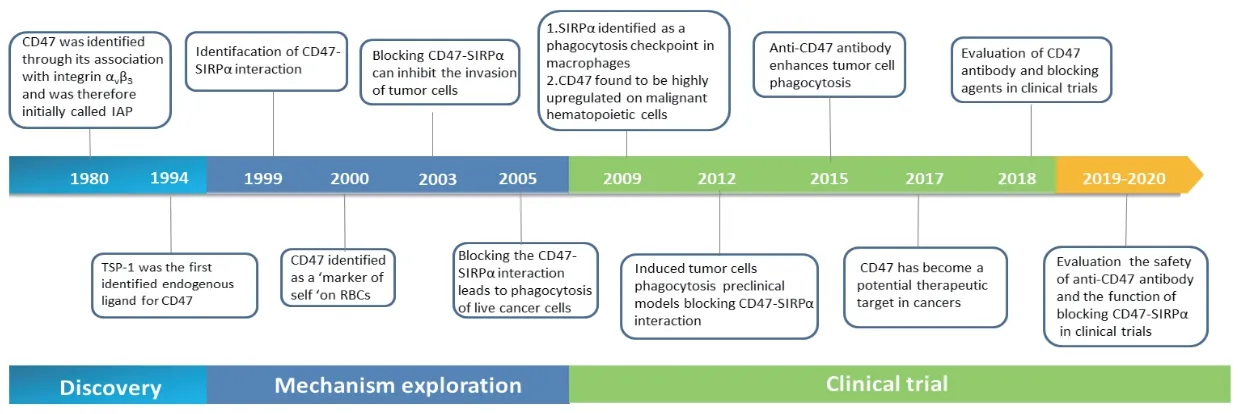
Fig.1 Research progress in CD47-signal regulatory protein α (SIRPα) in cancer图1 CD47-SIRPα轴在肿瘤中的研究进展
2 CD47的受体
CD47主要与整合素(integrins)、血小板反应蛋白1(thrombospondin-1,TSP-1)和SIRPα这3类细胞外受体相互作用,进而调节细胞黏附、细胞迁移以及炎性反应和吞噬等功能[14]。CD47可以与整合素αvβ3、αⅡbβ3、α2β1、α4β1、α5和α6β1等多个亚型相互作用[14-16,20-21],形成的复合体,连接到细胞内配体细胞骨架1(protein linking IAP with cytoskeleton-1,PLIC-1),从而激活异三聚体G蛋白,形成CD47-整合素-G蛋白复合体,介导多种细胞效应,如诱导环磷腺苷(cyclic adenosine monophosphate,cAMP)信号激活。
TSP-1为一种同三聚体多结构域细胞外基质糖蛋白,TSP1通过其碳末端结合结构域(C-terminal binding domain)上的VVM序列与CD47相结合,进而影响多种细胞功能,如细胞迁移和黏附、细胞增殖和凋亡、调节血管生成和炎性反应等[16-17]。
SIRPα是一种有3个IgSF结构域的跨膜蛋白,在巨噬细胞、粒细胞、肥大细胞及造血干细胞等髓系细胞系广泛表达[18],包含4个酪氨酸磷酸化位点和2个免疫受体酪氨酸相关的抑制性基 序(immunoreceptor tyrosine-based inhibitory motif,ITIM)。CD47与SIRPα结 合,可诱导ITIM发生磷酸化[19],招募和激活不同的蛋白酪氨酸磷酸酶(protein tyrosine phosphatase,PTPase)(如酪氨酸磷酸酶SHP-1和SHP-2)[20],导致肌球蛋白ⅡA(myosin IIA)去磷酸化发生解聚[21],从而抑制巨噬细胞的吞噬功能[22](图2)。
3 靶向CD47的抗肿瘤作用及机制
3.1 直接诱导肿瘤细胞的凋亡
有研究表明,在许多白血病细胞中,如慢性B淋巴细胞白血病细胞、早幼粒细胞白血病NB4细胞和Jurkat T细胞,CD47抗体与TSP-1结合后,通过半胱天冬酶独立细胞死亡方式诱导细胞凋亡。CD47诱导凋亡的作用不仅限于白血病,在人乳腺癌MCF-7、AU-565和MDA-MB-231细胞中,抗CD47抗体4N1K可激发CD47诱导细胞凋亡[23]。抗CD47抗体对诱导癌细胞凋亡的影响各不相同,其原因可能包括:每个抗体的特异性CD47靶向域不同、免疫球蛋白G(immunoglobin G,IgG)的不同亚型、参与抗体的连接方式不同等[24-25]。
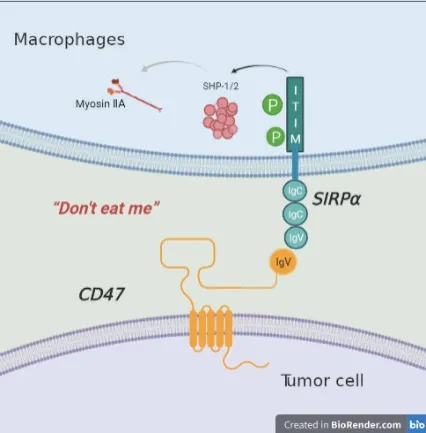
Fig.2 Regulatory effect of CD47-signal regulatory protein α (SIRPα) axis on phagocytosis.ITIM:Immunoreceptor tyrosine-based inhibitory motif.图2 CD47-SIRPα轴对吞噬作用的调节
3.2 增强吞噬细胞的吞噬作用
抑制CD47-SIRPα轴可以促进吞噬细胞对肿瘤细胞的吞噬作用。体外研究证明,抗CD47抗体阻断CD47-SIRPα信号通路可以促使巨噬细胞吞噬急性髓系白血病干细胞,但不吞噬CD34阳性表达(CD34+)的正常细胞。体内和体外实验证实,阻断CD47-SIRPα还可增强中性粒细胞对肿瘤细胞的吞噬作用[11]。该研究同时进一步揭示了CD47调控细胞的机制,发现激活SIRPα及其下游靶点,改变CD47与SIRPα的连接位置;并且在吞噬突触处激活SIRPα可抑制整联蛋白的活化,从而限制了巨噬细胞的扩散;再利用化学方法激活整联蛋白,即可恢复吞噬作用。由此证实了,CD47-SIRPα抑制巨噬细胞的吞噬可能是通过由内而外的抑制整联蛋白信号发挥作用,此机制的发现对癌症免疫疗法的应用产生了影响。
3.3 促进树突状细胞的吞噬作用与细胞因子的产生
肿瘤细胞表面的CD47与树突细胞上的SIRPα复合物结合,可抑制树突细胞对肿瘤细胞的吞噬作用。CD47和SIRPα间的相互作用可能抑制树突状细胞的成熟和树突状细胞产生炎性细胞因子[26-27]。此外,树突状细胞也可以介导肿瘤抗原呈递给T细胞,从而激活获得性免疫反应[5]。
3.4 加强抗体依赖性细胞毒性(antibodydependent cellular cytotoxicity,ADCC)和补体依赖细胞毒性(complement-dependentcytotoxicity,CDC)
有研究表明,获得性免疫系统的激活也可能是抗CD47的抗肿瘤作用机制[5]。抗CD47抗体可能通过Fc依赖的ADCC和CDC途径清除肿瘤细胞。此外,抗CD47抗体可以通过中性粒细胞激活ADCC从而清除肿瘤细胞,与CD47-SIRPα轴共同通过先天性免疫系统发挥抗肿瘤作用。ADCC或CDC通路的激活依赖于抗CD47抗体IgG亚型的特异性,因IgG不同亚型引发ADCC和CDC的能力不同[28]。
4 靶向CD47新药在肿瘤治疗中的临床研究进展
目前已有多种靶向CD47-SIRPα轴的抗体和小分子抑制剂正在不同的肿瘤中进行临床研究(表1)。然而,由于红细胞表面同样表达CD47,因此较早研发的药物会导致巨噬细胞错误的清除健康的红细胞,使患者出现严重贫血等不良反应[29]。此外,淋巴细胞、血小板细胞、胎盘细胞、肝细胞和脑细胞等也有较高的CD47表达,可导致一些药物引起高胆红素血症和血小板减少症等不良反应[30-31]。2018年12月,抗CD47单抗Ti-061和CC-90002就因为临床安全问题终止了研究。因此CD47靶向药物在临床开发中,已采用低起始剂量、维持剂量等多种策略来减轻其毒性。
4.1 CD47单克隆药物
4.1.1 Hu5F9-G4(magrolimab)
Hu5F9-G4是一种人源化抗CD47单克隆抗体[32]。在小鼠异种移植瘤模型中,Hu5F9-G4能够吞噬多种淋巴瘤细胞和实体瘤细胞[25,33-37],并可选择性地清除肿瘤细胞而不影响正常细胞。一项Hu5F9-G4联合利妥昔单抗治疗非霍奇金淋巴瘤的Ⅰb期研究评价了静脉注射Hu5F9-G4(起始剂量为1 mg/kg,静脉注射,每周10~30 mg/kg维持剂量)与利妥昔单抗联合用药的安全性及有效性,并因此确定Ⅱ期研究的推荐剂量[38]。该研究结果显示,22例入组的患者中(15例弥漫大B细胞淋巴瘤,7例滤泡性淋巴瘤),治疗相关不良事件主要为1或2级,贫血和输液相关反应是最常见的不良反应。Hu5F9-G4起始剂量和维持剂量可减轻贫血的发生率,剂量限制性毒性(doselimiting toxicities,DLTs)事件少见。在推荐的Ⅱ期剂量下(30 mg/kg),客观缓解率(objetive response rate,ORR)达到50%,36%的患者达到完全缓解(complete response,CR)。除了联合治疗的策略外,Hu5F9-G4单药治疗在实体瘤患者中也显示了较好的安全性和初步疗效。在Hu5F9-G4首次治疗晚期实体瘤的临床研究中[39],将62例患者随机分为4个队列,其中队列A(11例)用于确定起效剂量;队列B(14例)用于确定每周维持剂量;队列C(22例)用于研究第2周的负荷剂量;另设一个肿瘤活检队列(15例)。队列A中,剂量为0.1~3.0 mg/kg;在随后的治疗组中,患者接受了3~45 mg/kg的维持剂量治疗,大多数不良反应为轻度至中度,包括短暂性贫血(57%)、外周血涂片血凝反应(36%)、乏力(64%)、头痛(50%)、发热(45%)、寒战(45%)、高胆红素血症(34%)、淋巴细胞减少(34%)、输液相关反应(34%)和骨骼肌疼痛(18%)。然而,维持剂量高达45 mg/kg时并没有达到最大耐受剂量。Hu5F9-G4可以在10 mg/kg或更高的剂量下克服CD47抗原沉默现象。在30 mg/kg剂量下,有1例患者的肿瘤组织可见强抗体染色。2例获得部分缓解(partial response,PR)卵巢/输卵管癌患者的缓解时间分别为5.2和9.2个月。最终确定起始1 mg/kg,每周维持剂量为45 mg/kg为Hu5F9-G4的推荐剂量。除了实体瘤以外,Hu5F9-G4在血液系统疾病中的治疗也进行了探索。2019年第61届美国血液学会年会(American Society of Hematology,ASH)会议上公布了Hu5F9-G4联合阿扎胞苷对初治高风险骨髓增生异常综合症和不适宜诱导化疗的急性髓细胞性白血病患者的研究数据,ORR分别为92%和64%,CR更是达到50%以上。常见治疗相关的不良事件为贫血(37%)、中性粒细胞减少症(26%)和血小板减少症(26%)[40]。2020年,美国食品药品监督管理局(Food and Drug Administration,FDA)也给予了Hu5F9-G4治疗新诊断骨髓增生异常综合症的突破性疗法资格。
4.1.2 Lemzoparlimab(TJC4)
Lemzoparlimab(TJC4)是中国自主研发的新型全人源化CD47单克隆抗体,其创新点在于保证抗肿瘤活性的同时,能够最大程度地减少与正常红细胞结合,从而减少临床严重贫血的发生。在2020年癌症免疫治疗年会(Society for Immunotherapy of Cancer,SITC)上报告了一项Ⅰ期临床试验数据[41],该研究分为2部分,第1部分为单药剂量爬坡递增后,在递增剂量范围内采用的2种联合用药方案[Ⅰb期时联用帕博利珠单抗(pembrolizumab),Ⅰc期时联用利妥昔单抗];第2部分为上述2种联合疗法的剂量扩展研究。单药剂量爬坡组中共有20名患者入组,Lemzoparlimab每周耐受剂量高达30 mg/kg,没有发现剂量限制毒性或药物相关严重不良事件,所有治疗相关不良事件中除了1例患者出现3级脂肪酶升高外均为1或2级,所有的队列都观察到一过性血红蛋白降低,平均降低率在10%左右且没有剂量依赖性,没有药物相关性贫血的发生。截止到2020年11月10日,已经初步观察到Lemzoparlimab的治疗疗效,包括1例PR和3例疾病稳定(stable disease,SD)。目前正在进行Lemzoparlimab联合帕博利珠单抗治疗实体瘤和联合利妥昔单抗(Rituximab)治疗淋巴瘤(NCT03934814)和AML/MDS(NCT04202003)的临床研究(表1)。
4.1.3 Letaplimab(IBI188)
Letaplimab也是中国自主研发的重组全人源化抗CD47单克隆抗体,在2020年SITC会议上公布了该药的Ⅰa期临床研究结果。NCT03763149研究是在美国开展的,旨在评估Letaplimab单药治疗晚期恶性肿瘤(如结肠癌)的耐受性、安全性和药代动力学(pharmaeokineties,PK)/药效学(pharmacodynanfics,PD)特性。该研究共设置了7个剂量组,从0.1~30.0 mg/kg,每周给药1次,直至疾病进展、毒性不可耐受或其他需要终止治疗的情况。入组20例受试者,完成了所有预设剂量的爬坡,最高探索剂量为30.0 mg/kg,每周1次,整体耐受性良好,未发生DLTs。与治疗相关的不良事件大部分为1~2级,无治疗相关死亡发生。总体贫血发生率为15%(3/20),仅1例患者(5%)在首次给药当天出现3级一过性贫血,第2天恢复,总体而言耐受性良好。信达生物制药(苏州)有限公司目前正在中国开展“评估Letaplimab联合阿扎胞苷治疗初诊中高危骨髓增生异常综合征(myelodysplastic syndromes,MDS)受试者安全性和有效性的Ⅰb/Ⅲ期研究”以及“评估IBI188联合阿扎胞苷治疗急性髓系白血病(acute myelocytic leukemia,AML)受试者安全性及有效性的Ⅰb/Ⅱ期研究”。同时该公司正在美国开展评估IBI188联合阿扎胞苷治疗初诊中高危MDS受试者安全性和有效性的Ⅰb期研究。
4.1.4 AK117
AK117是中国研制的第二代抗CD47抗体,2020年SITC会议上公布了其初步研究结果,在澳大利亚-新西兰临床试验注册中心(Australian New Zeland clinical trials registry,ANZCTR)开展的晚期实体瘤和淋巴瘤患者的剂量递增临床试验中(表1),该研究共设置7个剂量组,从0.3~45.0 mg/kg,每周给药1次,直至疾病进展、毒性不可耐受或其他需要终止治疗的情况。目前已经完成了0.3、1.0和3.0 mg/kg的临床试验,正在进行10 mg/kg的剂量爬坡,这些队列受试者中均未发生药物相关的贫血症状,也无需使用低剂量诱导。各剂量组受试者对药物耐受性良好,无DLTs事件发生。
4.2 CD47-SIRPα融合蛋白药物
4.2.1 Trillium(TTI-621和TTI-622)
TTI-621和TTI-622都是利用CD47天然配体SIRP-α不结合红细胞表面CD47的特点开发的SIRPα-Fc融合蛋白,可结合人肿瘤细胞上的CD47,阻止其向巨噬细胞传递抑制性信号,也可以利用巨噬细胞表达的Fc受体进一步增强吞噬作用。临床前研究表明,TTI-621能与多种人肿瘤细胞上的CD47紧密结合,并选择性地促进巨噬细胞介导的对血液和实体瘤细胞的吞噬。此外,在小鼠白血病和淋巴瘤模型中,这些体外效应转化为显著的抗肿瘤活性[42]。重要的是,TTI-621与人红细胞的结合最小,最大限度地降低了溶血性贫血相关的潜在毒性[43]。也有研究证明,TTI-621阻断CD47后可增强巨噬细胞对肿瘤的吞噬作用。在一项I期研究(NCT02663518)中,研究者评估了TTI-621在复发/难治性血液肿瘤中的安全性和抗肿瘤活性[44];164例淋巴瘤患者接受了TTI-621治疗,其中剂量爬坡组18例,扩展队列146例(35例为联合西妥昔单抗,4例为联合纳武利尤单抗),治疗相关不良事件包括输注反应、血小板减少、寒战和疲劳等。目前正在进行一项评估TTI-621单药或联合治疗在复发/难治性血液恶性肿瘤和实体瘤患者中的作用的临床研究(NCT02890368)(表1)。

表1 CD47靶向药物的临床研究Table 1 Clinical studies of CD47-targeting drugs
与TTI-621采用IgG1的Fc段不同,TTI-622采用IgG4的Fc段,由于TTI-622的IgG4 Fc段与Fc受体的相互作用比IgG1更为有限,因此推测TTI-622会向巨噬细胞传递更适度的“吞噬”信号。2020年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)会议上,TTI-622用于治疗复发/难治性淋巴瘤的Ⅰ期初步临床数据公布,已经观察到1例PR、1例CR,进一步显示了该类疗法的治疗潜力。
4.2.3 ALX148
ALX148是一个对CD47高亲和力的结合片段与一个无活性的Fc段相融合的融合蛋白。ALX148可抑制CD47与野生型SIRPα结合,从而增强巨噬细胞对肿瘤细胞的吞噬作用。一项ALX148的多中心Ⅰ期临床试验数据显示,在先前接受含铂化疗病情进展、尚未接受免疫检查点抑制剂治疗的头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)患 者中,ALX418与帕博利珠单抗联合治疗的ORR为40%,中位无进展生存期(progression-fress survival,PFS)为4.6个 月[95%可信区间(confidence interval,CI)为0.5~7.5],中位总生存期(overall survival,OS)未达到。此外,在先前接受过至少一种抗人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)治疗方案后疾病进展的胃/胃食管交界肿瘤患者中,ALX418与曲妥珠单抗联合治疗的ORR为20%,中位PFS为2.2个月(95%CI为1.9~5.4),中位OS期为8.1个月(95%CI为3.4~12.8)。基于这2项研究结果,2020年2月FDA已授予ALX148用于一线治疗HNSCC,以及二线治疗HER2阳性胃或胃食管交界腺癌患者的快速通道资格认定。
4.3 小分子CD47调节剂
RRx-001是一种小分子免疫调节剂,可以抑制C-myc表达以及下调CD47和PD-L1的表达水平,其还可以使肿瘤相关巨噬细胞从肿瘤前的M2型重极化到抗肿瘤的M1型[45],恢复对既往一线治疗的敏感性。在首个评价RRx-001在人体中安全性、耐受性和药代动力学的I期研究中[46],25例实体瘤患者接受10~83 mg/m2不同剂量的RRx-001治疗,每1~2周重复1次,至少4周;没有观察到DLTs,在21例可评估患者中,1例(5%)为PR,14例(67%)为SD,6例(29%)为PD;患者耐受性良好,最常见的不良反应为注射部位疼痛(84%),主要为1~2级;该研究最终确定Ⅱ期推荐剂量为16.7 mg/m2。BRAINSTORM是一项旨在评估RRx-001联合全脑放疗(whole-brain radiation therapy,WBRT)治疗脑转移瘤的最大耐受剂量研究,在这项2期1/2期研究中共31例患者入组,RRx-001在WBRT前注射1次,在WBRT期间每周注射2次,计划4个剂量组(5.0、8.4、16.5和27.5 mg/m2)[47]。该研究初步证实了,RRx-001联合WBRT的良好耐受性和颅内缓解率,没
有观察到DLTs,最常见的严重不良事件是3级乏力(6.9%,2/29)。中位颅内缓解率为46.0%(95%CI为24.0~68.0),中位总生存期为5.2个月(95%CI为4.5~9.4),无神经系统死亡发生。在一项Ⅱ期QUADRUPLE THREAT研究(NCT02489903)中,SCLC患者在疾病进展后再接受RRx-001治疗[每周第1天给予静脉注射RRx-001(4 mg),共21 d],随后给予依托泊苷联合顺铂或卡铂再次治疗,主要研究终点为OS率和ORR。26例患者中1例(3.8%)为CR,6例(23.1%)为PR,12个月的OS率为44.1%[48]。基于该研究的初步良好结果,目前正在进行RRx-001联合依托泊苷/顺铂或卡铂对比含铂化疗三线及以上治疗既往接受过免疫治疗的SCLC的Ⅲ期研究(REPLATINUM和NCT03777657),并进一步探索循环肿瘤细胞上的c-Myc、CD-47和PD-L1以及循环单核细胞上的SIRPα表达。
4.4 双特异性抗体
TG-1801是一种新型、首创、抗CD47/CD19的双特异性抗体,TG-1801可有效提供抗B细胞肿瘤吞噬的活性,同时避免与之前靶向CD47通路药物相关的毒性问题。此外,CD47和CD19的共同靶向性不仅增强了预期安全性,而且通过保留其IgG1 Fc的功能,TG-1801还可以诱导ADCC的发生,提供抗肿瘤活性的第二机制。主要开发用于治疗复发性或难治性B细胞淋巴瘤患者。正在进行多中心Ⅰ期研究,旨在评价TG-1801的安全性、药代动力学、疗效和推荐的Ⅱ期剂量。此外,中国自主研发的抗PD-1/CD47双特异抗体新药也正在进行Ⅰ期临床试验(NCT04097769)。
6 结论
CD47作为非常有前景的免疫治疗靶点,目前已经有一些靶向CD47-SIRPα的抗肿瘤新药已经在实体瘤和血液系统肿瘤中看到了较好的抗肿瘤活性,并且在联合靶向药物、免疫靶向药物和放疗等领域也看到了初步的安全性和疗效,很可能将在肿瘤治疗中发挥重要的作用。未来需要更好地了解CD47诱导信号在调节免疫中的作用,为开发更有效的癌症免疫疗法提供思路。

