轻中度颈动脉狭窄患者斑块CT血管造影特征
伊东娜,张天助,张 璋,杨 帆,李锋坦,张宁男楠,李 东
(天津医科大学总医院医学影像科,天津 300052)
30%的缺血性卒中由大动脉粥样硬化导致的栓塞或低灌注引起[1]。美国心脏协会/美国卒中协会和《颈动脉狭窄诊治指南》均以颈动脉狭窄程度达70%作为需要施行血管重建的标准[2-3]。不明原因栓塞性卒中患者中,30%~40%同侧颈动脉轻度狭窄;其中同侧颈动脉存在高风险斑块者约为对侧的5.5倍[4]。无论狭窄程度如何,颈动脉粥样硬化斑块均可导致缺血性卒中,使得斑块特征和易损性成为可能影响治疗决策的重要因素。本研究观察轻中度颈动脉狭窄患者颈动脉粥样硬化斑块特征,并评价据其诊断高危斑块的价值。
1 资料与方法
1.1 研究对象 回顾性分析2020年6月—10月63例于天津医科大学总医院经颈动脉CT血管造影(CT angiography,CTA)诊断的颈动脉狭窄患者,男56例,女7例,年龄32~85岁,平均(66.5±9.5)岁。纳入标准:①年龄≥18岁;②根据北美症状性颈动脉内膜切除试验(North American symptomatic carotid endarterectomy trail,NASCET),颈动脉狭窄程度为轻度(<30%)或中度(≥30%且<70%)[3];③CTA后2日内颅脑CT和/或平扫MRI资料完整。排除标准:①单侧颈动脉狭窄程度≥70%;②颅内段颈动脉及颅内其他血管狭窄程度高于颅外段;③心源性栓塞、小血管闭塞或其他病因型缺血性卒中[5];④颅内出血、颅内血管瘤或占位性病变等;⑤曾接受颈动脉支架植入术或颈动脉内膜切除术;⑥存在CTA禁忌证。参照《颈动脉狭窄诊治指南》[3]标准将患者分为有症状组及无症状组。有症状组37例,男31例、女6例,年龄32~85岁,平均(65.0±10.4)岁;无症状组26例,男25例、女1例,年龄54~83岁,平均(68.7±7.8)岁。本研究通过医院伦理委员会批准(编号:IRB2020-KY-261)。检查前患者均签署知情同意书。
1.2 仪器与方法 采用GE Discovery CT 750 HD CT扫描仪。嘱患者仰卧,行头颈部轴位CT平扫,参数:管电压120 kV,管电流300 mA,层厚、层间距均为5 mm,探测器宽度40 mm,螺距0.984∶1。使用高压注射器经肘静脉以3.5 ml/s流率注射非离子型碘对比剂(优维显370 mgI/ml)80 ml,跟注30 ml生理盐水。采用Smart Prep技术,将ROI置于上腔静脉,触发阈值设定为100 HU,行颈动脉CTA。采用标准算法重建图像,重建层厚、层间距均为0.625 mm,视野25 cm×25 cm,矩阵512×512。
1.3 图像分析 将数据上传至GE ADW 4.6后处理工作站,由2名具有5年以上工作经验的影像科医师采用双盲法,根据临床诊断及颅脑CT/MRI判定与症状相关的颈动脉,意见相左时经讨论达成一致。对有症状组选择症状同侧颈动脉进行分析,共纳入40支狭窄动脉,包括轻度狭窄24支、中度狭窄16支;无症状组选择存在41支斑块侧颈动脉,包括轻度狭窄24支、中度狭窄17支。参照《头颈部血管超声若干问题的专家共识(颈动脉部分)》[6]判断颈动脉斑块位置;测量最狭窄处斑块厚度;计算颈动脉狭窄程度;选取CT平扫图像中颈动脉最狭窄处附近3个层面,避开血管周围软组织结构,距颈动脉壁外缘至少1 mm,手动勾画血管周围脂肪组织(perivascular adipose tissue,PVAT)ROI,测量CT值,并计算3个层面的平均值;自动或手动匹配CT平扫与CTA对应层面,避开颈动脉管腔、斑块内钙化、脂质成分及线束硬化区域,分别于3个不同层面手动勾画斑块ROI,使CT平扫与CTA对应层面的ROI位于相同位置,测量CT值并计算其平均值,斑块强化值为CTA与CT平扫 CT值的差值。以上参数每名医师各测量1次,计算2名医师的平均值作为结果。见图1、2。记录患者性别、年龄及病史。
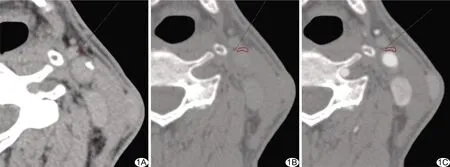
图1 有症状组颈动脉狭窄患者男,71岁 A.于轴位CT平扫(A)图像中勾画PVAT ROI;B、C.分别于轴位CT平扫(B)及CTA(C)图像中勾画斑块ROI
1.4 统计学分析 采用SPSS 22.0统计分析软件。以组内相关系数(intra-class correlation coefficient,ICC)评价观察者间测量结果的一致性,ICC≤0.40为一致性较差,0.40
2 结果
有症状组与无症状组患者性别、年龄及病史差异均无统计学意义(P均>0.05),见表1。

表1 有症状组与无症状组颈动脉狭窄患者基本资料比较(n=63)
2.1 一致性分析 观察者间测量颈动脉狭窄程度、最狭窄处斑块厚度、PVAT CT值及斑块强化值的一致性均高,无症状组ICC分别为0.972、0.849、0.836及0.836(P均<0.05),有症状组ICC分别为0.958、0.903、0.843及0.854(P均<0.05)。
2.2 斑块特征及相关参数 有症状组PVAT的 CT值及斑块强化值均高于无症状组(P均<0.05);组间斑块分布及厚度、颈动脉狭窄程度差异均无统计学意义(P均>0.05),见表2。

表2 有症状组与无症状组狭窄动脉患者斑块特征及CT相关参数比较(n=81,支)
2.3 二元Logistic回归分析 PVAT 的CT值和斑块强化值均为有症状颈动脉狭窄的独立危险因素,见表3。

表3 二元Logistic回归分析颈动脉斑块的危险因素
2.4 诊断效能 根据PVAT的 CT值诊断高危斑块的AUC为0.739[95%CI(0.628,0.850)];截断值为-94.825 HU时,敏感度和特异度分别为70.00%和80.50%;根据斑块强化值诊断高危斑块的AUC为0.662[95%CI(0.543,0.780)],截断为7.83 HU时,敏感度和特异度分别为67.50%和63.40%,见图3。

图2 无症状组颈动脉狭窄患者男,72岁 A.于轴位CT平扫(A)图像中勾画PVAT ROI;B、C.分别于轴位平扫CT(B)及CTA(C)图像中勾画斑块ROI

图3 CTA参数诊断高危斑块的ROC曲线
3 讨论
与脏器脂肪相比,PVAT分化程度更低、更接近前脂肪细胞,具有释放促炎性细胞因子和生长因子的特性[7]。病理状态下,促炎性细胞因子可诱导PVAT脂肪细胞去分化,导致含脂滴少、体积小的脂肪细胞数量增多[8],脂质与水含量的平衡被打破[9],使PVAT逐渐由脂相过渡至水相。动脉粥样硬化对PVAT中的脂肪细胞成熟和脂质积累具有抑制作用,炎症过程中,水肿和炎症细胞累积均可导致PVAT密度增高[10]。PVAT 的CT值与其脂肪细胞大小及分化程度呈负相关[11],因此,基于CT测量PVAT密度可评估PVAT的组织结构与代谢活性,进而评估动脉粥样硬化斑块进展状态。本研究有症状组PVAT 的CT值显著高于无症状组,提示PVAT存在炎症;采用常规CT成像可非侵入性定量评估该参数,以避免CTA中因管腔充盈对比剂带来的射线硬化伪影对脂肪CT值的干扰。
既往研究[12-13]表明,CTA和超声造影所见斑块强化程度均与斑块内新生血管数量相关。本研究发现,注入对比剂后,颈动脉斑块CT值出现不同程度升高,且有症状组斑块强化程度显著高于无症状组。在动脉粥样硬化疾病进程中,炎症及氧化应激反应等过程可上调血管生成因子,使病理性新生血管增加;而新生血管缺乏平滑肌细胞与内皮细胞,完整性欠佳,易发生渗漏引起局部炎症;新生血管破裂可致斑块内出血[13-14]。由于斑块内新生血管密度不同,颈动脉CTA中,注入对比剂后,斑块CT值会出现不同程度升高;斑块强化程度可作为颈动脉斑块内微血管密度的替代标志物[15]而用于预估斑块内出血风险,但对于新生血管影响斑块向缺血性脑卒中发展的程度尚无定论。
综上所述,PVAT的CT值和斑块强化程度可用于判断轻中度颈动脉狭窄患者高危斑块。本研究的主要不足在于样本量少,且缺少对斑块及症状进展的随访资料;解读斑块强化值时,缺少对应的组织学资料,未能观察斑块强化值与新生血管密度之间的相关性,有待完善。

