卒中后抑郁患者血清miR-223-3p和HMGB1的表达及诊断价值
樊军,樊建军
(鲁山健民医院 内科,河南 平顶山 467300)
卒中后抑郁(post-stroke depression,PSD)是一种与卒中发病相关的情感障碍疾病,以卒中发病数周至数年后出现卒中症状以外的持续性情绪低落、兴趣减退等抑郁症状为特征,是缺血性卒中常见的并发症之一[1]。PSD的发病率为25%~79%,其发病与卒中不良预后相关[2-3]。然而PSD的发病机制尚不清楚,神经炎症、胺假说和神经递质等多种因素均可能参与PSD的发病[4]。微小RNAs(microRNAs, miRNAs, miRs)不仅可参与调节炎症反应和神经发育[5],还在抑郁和自杀行为中起着关键作用,循环中的某些miRNAs可作为严重抑郁症等精神疾病潜在的新的血液标志物[6]。研究发现miR-223-3p参与调控趋化因子信号传导[7]等多种炎症反应过程。炎症与卒中患者神经功能缺损症状和PSD发病均存在相关性,但目前尚无有关miR-223-3p与PSD的相关性研究。高迁移率组蛋白Box1(high-mobility group box-1,HMGB1)是一种新的细胞因子样核蛋白,卒中发生后其立即从缺血组织的坏死细胞释放并激活早期的炎症反应,其浓度与脑损伤后疾病的严重程度和预后相关[8]。而卒中患者HMGB1水平升高是否与PSD发病有关,目前也无相关研究。鉴于此,本研究旨在观察并分析miR-223-3p及HMGB1在PSD患者血清中的表达情况,探讨将miR-223-3p及HMGB1作为PSD诊断的生物标志物的可能性。
1 资料与方法
1.1 一般资料选取2018年6月至2019年6月鲁山健民医院收治的159例急性缺血性卒中患者作为研究对象,其中男101例,女58例,年龄32~86岁,平均(62.21±10.56)岁。依据住院治疗期间或随访时是否发生PSD症状将患者分为PSD组(51例)和非PSD组(108例)。
1.2 选取标准(1)纳入标准:①急性缺血性脑卒中的诊断符合《中国急性缺血性脑卒中诊治指南2018》[9]的诊断标准,并在入院后24 h内经头颅磁共振成像(magnetic resonance imaging,MRI)检查确诊;②首次发病,且在发病后12 h内入院;③PSD的诊断符合中国精神障碍分类及诊断标准(CCMD-3)[10],且由2名受过量表评估培训的临床医生对所有患者进行汉密尔顿抑郁量表17(Hamilton depression scale-17,HAMD-17)评估,HAMD-17≥7分为抑郁症[11];④年龄>18岁;⑤良好配合完成抑郁评估量表且完成随访;⑥签署知情同意书。(2)排除标准:①有抑郁症、精神分裂症等精神疾病;②有认知障碍或意识障碍;③有急、慢性感染性疾病;④近期应用糖皮质激素或免疫抑制剂;⑤服用氯丙嗪、丙戊酸钠等可能导致抑郁或加重抑郁的药物;⑥合并恶性肿瘤等其他严重疾病。
1.3 miR-223-3p和HMGB1的检测方法收集患者入院后次晨的空腹血液10 mL至 EDTA抗凝管中,立即将血样以800 g,4 ℃低温离心15 min,吸取上层血清分装至EP管中,并储存在-80 °C冰箱。通过RT-PCR法检测患者血清miR-223-3p的相对表达量,具体如下。采用mirVanaRNA分离试剂盒(Applied Biosystem,美国)分离并纯化总血清RNA。采用Nanodrop 2000分光光度计(Thermo Fisher Scientific,美国)对每个RNA样本浓度及纯度进行检测,取A260/A280值在1.8~2.1且经RNA完整性鉴定(基于琼脂糖凝胶电泳)合格的RNA样品进行后续实验。采用HiScript Ⅱ RT SuperMix for qPCR逆转录试剂盒(南京诺唯赞生物科技有限公司,中国)将提取出的总RNA按500 ng、10 μL体系进行cDNA逆转录,反应条件为50 ℃ 15 min,85 ℃ 10 s;取1 μL cDNA、5 μL 2×ChamQ SYBR qPCR Master Mix(南京诺唯赞生物科技有限公司,中国)和miR-223-3p特异性前向、逆向引物(10 μmol·L-1)各0.2 μL,按说明书完成反应体系的配置,采用ABI 7500荧光定量 PCR机(Thermo Fisher,美国)进行检测。miR-223-3p的引物序列为前向:5’-GGGGTGTCAGTTTGTCAAA-3’,逆向:5’-GTGCGTGTCGTGGAGTCG-3’。U6的引物序列为前向:5’-GCTTCGGCAGCACATATACTAAAAT-3’, 逆向:5’-CGCTTCACGAATTTGCGTGTCAT-3’。每个PCR样本重复3次,采用2-△△Ct相对定量法对miR-223-3p的相对表达量进行计算。采用人HMGB1 ELISA试剂盒(上海信裕生物科技有限公司,中国)以双抗体夹心法检测患者血清HMGB1水平,依照配套说明书进行检测。
1.4 随访所有患者接受门诊随访,完成为期 1 a的随访。随访开始时间为急性缺血性脑卒中确诊时间,随访截止时间为发病后1 a,以PSD为终点事件。
1.5 观察指标(1)患者的一般临床资料,包括性别、年龄、受教育年限、吸烟史、饮酒史、高血压史、糖尿病史和体质量指数(body mass index,BMI)。(2)患者入院后次晨空腹血液送检的血常规、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇( high density lipoprotein cholesterol,HDL-C)、空腹血糖( fasting blood glucose,FBG)等常规实验室检查结果。(3)急性缺血性卒中患者梗死灶的位置、TOAST病因分型及入院时的美国国立卫生研究院卒中量表(National Institute of Health stroke scale, NIHSS)评分结果。

2 结果
2.1 患者临床资料两组患者在年龄、性别、受教育年限、高血压史、BMI、饮酒史、吸烟史、TC、TG、LDL-C、HDL-C、梗死灶部位及TOSAT分析方面的比较,差异均无统计学意义(P>0.05);PSD组患者NIHSS评分及HMGB1水平高于非PSD组,miR-223-3p相对表达量低于非PSD组(P<0.05)。见表1。

表1 两组患者临床资料比较
2.2 卒中患者发生PSD的危险因素分析将表1中有差异的指标纳入多因素logistic回归分析(α入=0.05,α出=0.10)寻找PSD的危险因素,以是否发生抑郁(0=无抑郁,1=抑郁)为因变量,以miR-223-3p、NIHSS评分及HMGB1水平为自变量。结果显示,miR-223-3p相对表达量降低及NIHSS评分和HMGB1水平升高是卒中患者发生PSD的独立危险因素(P<0.05)。见表2。
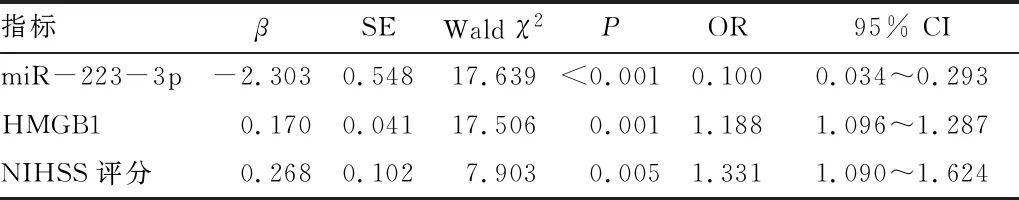
表2 卒中患者PSD发病的危险因素分析
2.3 卒中患者血清miR-223-3p、NIHSS评分及HMGB1间相关性分析Pearson相关检验结果提示,卒中患者血清miR-223-3p与HMGB1水平(r=-0.606,P<0.001)和NIHSS评分(r=-0.553,P<0.001)均呈负相关,HMGB1与NIHSS评分(r=0.566,P<0.001)呈正相关。
2.4 卒中患者血清miR-223-3p和HMGB1水平对PSD发病的诊断价值分析ROC曲线分析miR-223-3p和HMGB1水平对卒中患者PSD发病的诊断价值的结果显示,两者ROC曲线下面积分别为0.796和0.775,两指标的灵敏性较高但特异性稍低。联合miR-223-3p和HMGB1两指标对PSD发病的诊断价值进行评估时,灵敏性提升至88.2%、特异性提升至73.2%,约登指数上升为0.577。见表3。

表3 卒中患者血清miR-223-3p和HMGB1对PSD发病的诊断价值
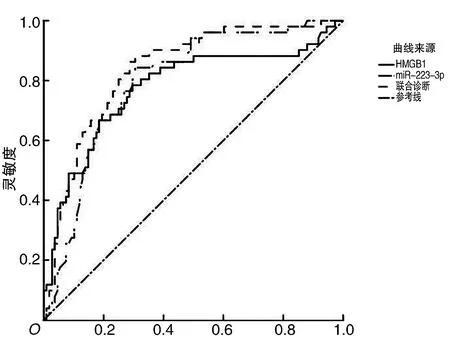
图1 卒中患者血清miR-223-3p和HMGB1对PSD发病诊断价值的ROC曲线
3 讨论
2017版全球疾病负担研究报告称卒中和抑郁症均是全球致残率较高的疾病,且卒中和抑郁症也是导致社会经济负担增加的主要疾病[12]。PSD是卒中后最常见且疾病负担最重的精神性疾病并发症[13],与无PSD患者相比,PSD患者有着更高的病死率、认知障碍、致残率和较低的生活质量[14]。因此,早期识别PSD的相关危险因素有助于指导临床医生更早发现并评估抑郁的发病和严重程度并积极进行干预,对改善卒中患者的预后具有重要意义。针对PSD的发病机制,有研究表明神经炎症可能参与了PSD的发病,如PSD患者下丘脑-垂体-肾上腺轴调节失调导致炎症加重[4]。近年来越来越多的研究关注miRNAs在中枢神经系统如何参与并调节炎症反应、氧化应激、内皮功能障碍等多种生物学过程,其在血液循环中的稳定存在具有作为疾病诊断的潜在的新型生物标志物的价值[15]。近期有研究发现多种miRNAs与PSD存在密切相关性[16]。
研究发现miR-223-3p水平与caspase-1和IL-1β水平呈负相关,miR-223-3p在抑制炎症小体激活和细胞凋亡中发挥作用[17]。另有研究发现miR-223-3p升高可减轻单核细胞、中性粒细胞和早期活化的巨噬细胞的浸润,并下调促炎细胞因子IL-6和IL-12及趋化因子CCL2、CCL3、CXCL1[18]。值得注意的是,有研究还发现过表达miR-223-3p可减少脑梗死面积,最终改善神经功能缺损症状,改善学习和记忆[19]。卒中诱发的炎症和促炎介质的激活已成为卒中诱发神经功能损伤机制的最新研究重点,HMGB1是一种典型的损伤性相关蛋白,在正常脑组织中HMGB1通常定位于细胞核中,而卒中发生后其转移至细胞质并由受损细胞分泌至胞外,在卒中发病的早期阶段作为促炎因子激活炎症反应,可破坏血脑屏障,导致神经元凋亡等[8]。目前有研究认为HMGB1所介导的炎症反应与抑郁症的发病存在相关性[20],但miR-223-3p及HMGB1在PSD患者血清中的表达情况目前国内外尚无文献报道。
本研究结果显示,PSD组患者NIHSS评分及HMGB1水平高于非PSD组,且miR-223-3p相对表达量低于非PSD组,提示miR-223-3p相对表达量降低与HMGB1水平升高可能与PSD的发病有关。研究发现,抑郁小鼠模型中发现小鼠海马区小胶质细胞HMGB1的mRNA转录水平及晚期糖基化终末产物(receptor for advanced glycation end products,RAGE)受体mRNA转录水平显著上调,提示HMGB1RAGE通路的激活可能诱导抑郁症状[20]。卒中发生后,受损脑组织释放HMGB1增加,HMGB1与RAGE受体结合后可激活活化丝裂原活化蛋白激酶,继而使NF-κB激活,导致炎症反应加重[8],该通路激活后最终导致靶细胞对TNF-α、IL-1β、IL-6等炎症因子的合成和分泌增多[21],这些炎症因子均参与了抑郁症的发病,而miR-223-3p同样参与NF-κB炎症通路的激活[22]和促炎细胞因子IL-6和IL-12等的释放[18],这提示miR-223-3p也可能在抑郁症的发病中发挥一定的作用。同时本研究还发现卒中患者血清miR-223-3p与HMGB1水平及NIHSS评分均呈负相关,而HMGB1与NIHSS评分呈正相关,提示卒中患者miR-223-3p相对表达量降低且HMGB1水平升高者的神经功能缺损症状更重,较高NIHSS评分的卒中患者与PSD的发病率呈正相关[20]。此外,有研究发现慢性不可预知性应激诱导小鼠出现抑郁症状,是通过提高HMGB1水平而导致小胶质细胞的活化,最终诱导出小鼠的抑郁症状[23]。
同时,本研究采用ROC曲线分析了血清miR-223-3p与HMGB1水平对卒中患者PSD发病的诊断价值,结果显示,两指标的ROC曲线下面积分别为0.796和0.775, miR-223-3p的最佳诊断阈值为0.52,HMGB1的最佳诊断阈值为66.75 μg·L-1,提示缺血性卒中患者血清miR-223-3p水平降低与HMGB1水平升高对PSD的发病有着较高的诊断价值,但两指标的特异性稍低。联合miR-223-3p和HMGB1两指标对PSD发病的诊断价值进行评估时,灵敏性和特异性及约登指数均得到一定程度的提升,提示对缺血性卒中患者早期联合监测miR-223-3p和HMGB1的表达情况,可有效预测PSD的发生。
综上所述,本研究发现急性缺血性脑卒中患者血清miR-223-3p相对表达量降低及HMGB1水平升高是PSD发病的独立危险因素,早期将两指标联合检测可有效预测PSD的发病,而miR-223-3p和HMGB1如何参与调控PSD发病及病情进展过程中具体的分子机制及信号通路,仍需进一步深入研究。

